Решение перечисленных задач возможно только при наличии достаточного количества зарегистрированных и доступных для измерения показателей, отражающих уровень качества продукции.
 Скачать 253.46 Kb. Скачать 253.46 Kb.
|
 т.е. отношение концентрации растворённого вещества в подвижной фазе (г/л) к его концентрации в неподвижной фазе (г/л). если коэффициенты распределения отдельных компонентов смеси достаточно между собой различаются, то при промывании колонки образуются отдельные зоны чистых веществ, т.е. происходит полное разделение смеси. (Чем больше Краспр., тем быстрее вещество движется по колонке). Например, смесь веществ А и В пропускают через воронку в подвижном растворителе, причём Краспр. компонента В больше Краспр. компонента В, поэтому скорость распределения компонента А будет больше и компонент А уходит вниз колонки. В        В В  А Первичная А Первичная          позиция А позиция А Промывая колонку растворителем между компонентами образуется чёткая граница. При дальнейшем промывании из колонки будет вытекать: Подв.раств. + А Подв.раств. Подв.раств. + В Разновидностью распределительной хроматографии является бумажная и тонкослойная. В тонкослойной — разделение проводится на пластинках, покрытых тонким слоем окиси алюминия, силикагеля или другого сорбента, который удерживает неподвижный растворитель. Нижний край пластинки с нанесённой на неё пробой опускают в подвижный растворитель. Хроматография на бумаге является разновидностью метода распределительной хроматографии, носителем для неподвижного растворителя служит при этом фильтровальная бумага, а не колонка с сорбентом. Разделение веществ происходит вследствие различия в распределении между двумя жидкими фазами, одна из которых подвижна (смесь органических растворителей), а другая — неподвижная и представляет собой воду, находящуюся в волокнах фильтровальной бумаги. Разделение смесей веществ или ионов с помощью хроматографии на бумаге основано на различной скорости движения компонентов, которые характеризуются коэффициентом движения Rf. Величины коэффициентов ионов вычисляют по формуле: Rf = 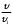 = = 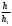 где: υ — скорость движения зоны иона на бумаге где: υ — скорость движения зоны иона на бумагеh — расстояние, пройденное зоной иона на бумаге υ1 — скорость движения фронта подвижного растворителя h1 — расстояние, пройденное растворителем Под фронтом растворителя понимают видимую границу распространения растворителя по бумаге. Коэффициент движения каждого катиона — постоянная величина, не зависит от концентрации анализируемого раствора, температуры, присутствия других катионов и природы аниона, с которым связан изучаемый катион. Однако, коэффициент движения Rf зависит от состава и свойств используемого подвижного растворителя, а также от сорта хроматографической бумаги. Чем больше величина Rf, тем быстрее и дальше продвигается катион по бумаге и тем лучше отделяется он от другого катиона с низким значением Rf. Например, у катионов Fe3+ и Cu2+ коэффициенты движения значительно отличаются по величине, поэтому они чётко разделяются. Просто и удобно проводить разделение ионов с помощью круговых хроматограмм, полученных на обеззоленных фильтрах “синяя лента” с использованием в качестве хроматографической камеры-эксикатора. Для контакта с растворителем из фильтра вырезается полоска — “фитиль”, который погружается в растворитель (а), или контакт с растворителем осуществляется с помощью конуса, сделанного из этой же фильтровальной бумаги и вставленного в середину отверстия, находящегося в середине фильтра-хроматограммы.        Конус бумажный Конус бумажный  фитиль фитиль     растворитель растворитель   растворитель растворительДля расчёта Rf какого-то иона, например, Fе3+, на середине фильтра помещают 0,05 мл раствора, содержащего Fe3+, при этом этот процесс должен быть медленным, постепенным, чтоб происходило впитывание раствора за счёт капиллярных сил бумаги. Образовавшееся пятно осторожно обводят простым карандашом, фиксируя его положение на бумаге, фильтр сушится и бритвой вырезается фитиль. После этого фильтр устанавливается над сосудом с растворителем, таким образом, чтоб контакт фильтра с ним осуществлялся через фитиль:    фильтр    фитиль фитиль  растворитель в тигле растворитель в тиглеОставляют систему в таком виде на 2-3 часа, поместив её в эксикатор с крышкой (хроматографическую камеру) для размывания первичной хроматограммы, после этого вынимают фильтр из эксикатора и отмечают карандашом границы фронта растворителя, таким образом, получаем величины: h — расстояние, пройденное зоной иона на бумаге (для Fe3+ - экспериментально, 1,5 см) h1 — расстояние, пройденное растворителем (экспериментально, для смеси 90 % С2Н5ОН и 10 % 5 н HCl, 4,8 см) отсюда RFe3+ = 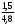 = 0,31 = 0,31Аналогично можно определить для любого иона (Rcu2+ = 0,45). После этого можно провести хроматографическое разделение на бумаге смеси этих катионов. Причём, учитывая величины Rf , можно сделать заключение, что Cu2+ будет быстрее и дальше продвигаться по бумаге, т.к. имеет большую величину Rf, чем Fe3+. Кроме круговых хроматограмм можно использовать бумажные полосы, помещённые в стеклянные камеры, эксикаторы, пробирки. Конец этих полос помещают в растворитель (восходящая хроматография, нисходящая хроматография). а) Восходящая бумажная хроматография. Исследуемое вещество наносят на линию старта, которая проводится на расстоянии 1-2 см от нижнего края ХР-бумаги. Бумагу помещают в камеру с подвижным растворителем таким образом, чтобы линия старта была выше границы растворителя. (Камера закрыта крышкой). Под действием капиллярных сил подвижный растворитель поднимается вверх, захватывая компоненты анализируемой смеси. Так как компоненты обладают различной растворимостью в этом растворителе, то и двигаться они будут с различной скоростью. При этом происходит разделение смеси на компоненты. Если смесь А и В (КА > КВ), то В будет выше В. Линия, до которой доходит подвижный растворитель — называют линий фронта. Rf = 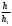 h — путь, пройденный растворителем от линии старта до линии фронта h — путь, пройденный растворителем от линии старта до линии фронтаh1 — путь, пройденный веществом от линии старта до середины пятна. б) Нисходящая бумажная хроматография. В этом методе растворитель находится в верхней части камеры, линия старта находится в верхней части камеры, линия старта сверху. Растворитель движется вниз под действием силы тяжести, забирая с собой определяемое вещество, чем больше Кр вещества, тем ниже на бумаге будет находиться вещество. Распределительная хроматография на бумаге, особенно с применением органических реактивов, является макроаналитическим методом, широко применимым в тех случаях, когда обычные химические методы малопригодны. Например, для разделения близких по свойствам соединений — аминокислот, пептидов, углеводов и т.д. Хроматографию на бумаге используют для определения следов ФОВ в пищевых продуктах и на биологическом материале. Ионообменная хроматография Ионообменная хроматография основана на явлении обмена ионов находящихся в растворе и ионов, адсорбируемых твёрдым адсорбентом. Образование хроматограмм в этом случае происходит вследствие неодинаковой способности к обмену различных ионов хроматографируемого раствора. В ионообменной хроматографии, также как и в адсорбционной, можно применять фронтальный, вытеснительный и проявительный (элюентный) метод анализа. При фронтальном анализе исследуемую смесь непрерывно подают в верхнюю часть колонки и следят за появлением отдельных компонентов в вытекающем растворе, но полного разделения компонентов в этом методе не происходит и метод не пригоден для препаративного разделения и количественного определения веществ. При вытеснительном методе анализа для вытеснения применяют растворы веществ, ионы которых сорбируются лучше, чем ионы компонентов хроматографической смеси, поэтому они вытесняют из сорбента ранее сорбированные ионы разделяемых веществ. В проявительном (элюентном) методе промывание проводят чистым растворителем. Во всех видах ионообменной хроматографии имеет место многократное повторение процессов ионного обмена. В зависимости от того происходит ли обменная сорбция положительно заряженных ионов (катионов) или отрицательно заряженных ионов (анионов) — ионообменники делятся на катиониты и аниониты. Существуют иониты, обладающие амфотерными свойствами.. а) Катионный обмен: RH + NaCl ↔ RNa + HCl б) Анионный обмен: ROH + NaCl → RCl + NaOH R — радикал, образующий элементарную ячейку ионита. Качественная характеристика ионообмена зависит от природы ионита, хроматографируемого иона, растворителя, от условий опыта (tº, рН и др.). Рассмотрим ионообменное равновесие на примере обмена на ионите двух одновалентных ионов А+ и В+. RA + B+ ↔ RB + A+ Согласно закона действия масс: Кр. = 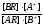 или или 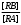 = Кр. = Кр.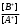 Или 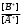 = Кр. = Кр.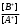 , где Кр. — константа ионного обмена , где Кр. — константа ионного обмена[B+], [A+] — концентрации ионов А и В в растворе _ _ [B+], [A+] — концентрация ионов В+ и А+ в твёрдой фазе Аналогично для обмена двухвалентного иона на одновалентный В2+ + 2RA → R2B + 2A+ 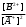 = Кр. = Кр.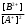 Константа равновесия (ионного обмена) позволяет количественно характеризовать сравнительную способность ионита к обмену. Если Кравн. < 1 ион, находящийся в растворе, имеет большое сродство к иониту, чем ион, пришедший в раствор с твёрдой фазой — на ионите. Обмен из раствора в этом случае будет протекать достаточно полно. Если Кравн. > 1 ион раствора имеет меньшее сродство к иониту, чем ион, входящий в состав ионита, обмен в данном случае незначительный. в) Сорбенты, применяемые в ионообменной хроматографии. Вещества, применяемые в качестве ионообменных сорбентов, подразделяются на два основных класса: неорганические и органические сорбенты, которые могут быть естественного и искусственного происхождения. Ионообменные сорбенты должны отвечать следующим требованиям: Обладать максимально возможной поглотительной способностью; Обладать избирательной сорбцией по отношению к веществам разделяемой смеси; Быть однородными, иметь степень дисперсности, достаточную для обеспечения необходимой скорости адсорбции и равновесного прохождения раствора через колонку с требуемой скоростью; Иметь ограниченную набухаемость, не растворяться в хроматографируемом растворе и той среде, в которой они используются, обладать механической прочностью; Производство сорбентов должно быть экономически выгодным и основываться на применении отечественного сырья. г) Минеральные иониты. Сорбенты минерального происхождения — слабокислотные китиониты или слабоосновные аниониты. Наиболее распространены — оксид алюминия, природные алюмосиликаты, фосфат циркония, применяемые как катиониты. В качестве анионитов — оксид Al, гидроксид Zr и др. Органические иониты — являются продуктами химической переработки угля и лигнина, их называют ионообменными смолами. д) Органические иониты. Катиониты содержат в своих формулах сульфогруппы — SO3H, фосфогруппы РО(ОН)2, карбоксильные — СООН — (фенолформальдегидные, полистирольные катиониты). Органические аниониты — полиамины, т.к. содержат NH2R+, NHR2+ и т.д. Аминоформальдегидные, полиаминовые, полистирольные аниониты. Использованные иониты можно вернуть в исходную форму, пропуская через него соответствующий раствор, этот процесс называется регенерацией. Оксид алюминия проявляет амфотерные свойства и может играть роль как катионита, так и анионита. Al2O3 — катионит Al + NaOH + CO2 → Al2O3 На поверхности Al2O3 адсорбируется NaAlO2, образуя соединение (Al2O3)mNaAlO2, появляются подвижные ионы Na+ [(Al2O3)mNaAlO2-]Na+ + Me+An → [(Al2O3)mAlO2-]Me + NaAn     AlO2- Na AlO2 Или (Al2O3)m + MeAn2 → (Al2O3)m Me + 2NaAn AlO2- Na AlO2 Al2O3 — анион (перед использованием промывают азотной кислотой, в результате чего на поверхности Al2O3 появляется подвижный анион — NO3). [(Al2O3)mAlO2]Na + 2HNO3 → [(Al2O3)mAlO+]NO3 + NaNO3 + H2O [(Al2O3)mAlO+]NO3 + MeAn → [Al2O3)nAlO+]An + MeNO3 По способности поглощать ионы для каждого ионита существуют адсорбционные ряды по способности замещать друг друга (для Al2O3): H+ > As3+ > Sb3+ > Bi3+ = Fe2+ + Hg2+ = UO2 > Pb2+ > Cu2+ > Zn2+ > Co2+ = Ni2+ = Cd2+ > Mn2+ Т.е. на Al2O3 легче адсорбируется Н+, хуже Mn2+. Реакции на органическом ионите (ионнообменной смоле) происходят по схеме: 2R – SO3H + CuSO4 → (RSO3)2 |
