Роберт Вильгельм Бунзен
 Скачать 2.24 Mb. Скачать 2.24 Mb.
|
|
Варианты заданий для домашней контрольной работы
ЛАБОРАТОРНАЯ РАБОТА №1.
Экспериментальное определение тепловых эффектов процессов проводят в калориметрах. Простейший калориметр состоит из сосуда Дьюара и изолирующей системы (рис. 1). Рис. 1. Схема калориметра 1 - металлический стакан или сосуд Дьюара; 2 - воздушная оболочка; 3 – полставка; 4 – крышка; 5 – мешалка; 6 - термометр Бекмана; 7 – ампула с испытуемым веществом. В калориметрах определяют вызванное данным процессом изменение температуры ( ∆Т) и по этой величине находят интегральную теплоту процесса растворения исследуемой соли ( ∆Нm) ∆Нm = К* ∆Т, (1) где К - постоянная калориметра, количество тепла, необходимое для нагревания калориметра на один градус (кДж *К-1). Постоянную калориметра находят обычно опытным путём по известной теплоте растворения соли: , (2) где q- навеска соли, г. ∆Нm - известная теплота растворения соли, кДж*моль-1 (по справочнику) М - молярная масса соли, г.моль-1 ΔT - изменение температуры, К. Изменение температуры в калориметре определяют с помощью термометра Бекмана. Необходимые реактивы и оборудование: калориметр, термометр Бекмана, мешалка, секундомер, весы, разновес, фарфоровая ступка, цилиндр на 500мл, хлорид калия, нитрат калия, нитрат аммония, хлорид аммония, гидрокарбонат натрия. Последовательность выполнения работы: (1) Определение константы калориметра по известной теплоте растворения-соли.
- Почему столбик ртути в термометре должен установиться в середине шкалы?
- Почему температура в калориметре падает при растворении нитрата калия? - Будет ли наблюдаться подобный эффект при растворении других солей?
- Почему для определения истинного изменения температуры в калориметре надо записывать ход температуры, а не только начальное и конечное значение её? Рис.2 Графический метод определения истинного изменения температуры в ходе опыта Точную величину изменения температуры в опыте определяют графически. На миллиметровую бумагу наносят наблюдаемые в опыте значения температуры в координатах температура - время. В хорошо проведённом опыте изменения температуры до начала реакции и после ее окончания изображаются прямыми линиями. Наклон этих прямых относительно оси абсцисс бывает различным в зависимости от разности температур между калориметром и окружающей его средой. Отрезок АВ показывает изменение температуры в предварительном периоде, ВС – в главном периоде, СД - в заключительном периоде. Для определения ∆Т прямые АВ и СД экстраполируют. Время главного периода EF делят пополам и из полученной точки К восстанавливают перпендикуляр до пересечения с обеими экстраполированными прямыми. Отрезок перпендикуляра между этими прямыми MN, выраженный в градусах, даёт истинное изменение температуры (∆T). При графическом определении ∆Т на миллиметровой бумаге на оси абсцисс откладывают время в масштабе 1 мин = 0,5 см, на оси ординат - температуру, выбор масштаба которой зависит от величины ∆T. При ∆Т<1 градуса, 1 градус = 10 см, а при ∆Т> 1 градуса, 1 градус = 5 см.
(2) Определение интегральной теплоты растворения соли.
Таблица 1
Особые условия выполнения работы:
Устройство и настройка термометра Бекмана 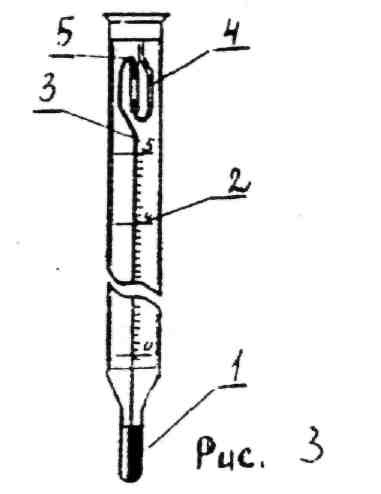 Метастатический термометр Бекмана служит для определения не больших изменений температуры (рис 3). Термометр имеет два резервуара:1 нижний - основной и верхний 4 - запасной, соединённые капилляром 3. Термометр имеет шкалу 2 длиной 30 см. разделённую на 5-6°. Цена деления 0,01° с помощью лупы можно делать отсчёт с точностью до 0,002-0,003°. Наличие запасного резервуара позволяет менять количество ртути в нижнем резервуаре. Благодаря этому термометр можно использовать в широком диапазоне температур (от -35 до +250°). Перед работой термометр должен быть настроен так, чтобы при температурах опыта уровень ртути в капилляре находился в пределах шкалы термометра. Для выполнения работы по термохимии термометр Бекмана должен быть установлен так, чтобы при комнатной температуре столбик ртути в капилляре оканчивался в середине шкалы. Для проверки настройки термометра его нижний резервуар погружают з воду комнатной температуры и выдерживают 2-3 минуты. Если столбик ртути останавливается между 2-3 делениями - термометр настроен. Если термометр не настроен, нужно соединить ртуть обоих резервуаров, для чего термометр переворачивают вниз верхним резервуаром и осторожно постукивают рукой по нижнему резервуару, чтобы ртуть перетекала из нижнего резервуара в верхний. Когда ртуть заполнит весь капилляр и соединится с ртутью верхнего резервуара, термометр нужно очень осторожно (чтобы не нарушить соединение) вернуть в исходное состояние, погрузить нижний резервуар в сосуд с водой комнатной температуры и выдержать 5 минут. После этого термометр достают из воды и. держа его правой рукой за среднюю часть, коротким, несильным ударом верхней части термометра, добиваются разрыва столбика ртути в месте соединения 5 капилляра с запасным резервуаром 4. Затем вновь проверяют настройку термометра. Если ртуть на этот раз окажется выше делений шкалы, необходимо нагреть нижний резервуар и скопившуюся в точке 5 капельку ртути сбрасывают в резервуар 4. Эти операции иногда приходится повторять несколько раз. чтобы добиться желаемого положения ртути на шкале термометра. ТЕРМОДИНАМИКА ФАЗОВЫХ ПРЕВРАЩЕНИЙ Растворы жидкостей в жидкостях имеют большое практическое значение для фармации, медицины и биологии. Но не всегда компоненты таких систем полностью растворимы друг в друге. Многие лекарственные формы представляют собой смеси жидкостей с различной растворимостью. Изучение диаграмм состояния таких систем позволяет выбирать составы, при которых смеси не растворяются при заданных условиях. Растворимость жидкостей в смесях зависит от температуры, поэтому некоторые виды анализов лекарственного сырья основаны на использовании критической температуры растворения. На этом же, свойстве базируется метод выделения одного из компонентов смеси путем увеличения его концентрации в растворе. В некоторых случаях такой способ разделения смесей может быть более простым, чем фракционная перегонка. Для фармации также большой интерес представляют 3-х компонентные системы, состоящие из двух несмешивающихся растворителей и третьего вещества, которое растворяется в каждом из них. Такие системы образуются в процессе экстрагирования. Оно является одной из многих технологических операций при получении антибиотиков, галеновых препаратов, а также при анализе лекарст венных форм. Целью экстракции является повышение концентрации какого-либо вещества или удаление нежелательной составной части. Экстракция широко применяется в фармации для выделения из растительного сырья эфирных масел, алкалоидов, витаминов и других лекарственных веществ. Часто экстракцию производят из твердого материала, например, из сырья растительного или животного происхождения. В медицине изучение 3-х компонентных систем (органическое вещество - вода - лекарственный препарат) позволяет прогнозировать возможность проникновения этого препарата через биологические мембраны. В фармацевтической практике используются лекарственные формы, состоящие из нескольких твердых фаз (например, порошки). Диаграммы состояния таких систем (диаграммы плавкости) позволяют определить число и химическую природу фаз, границы их существования, характер взаимодействия компонентов и т.д. Пользуясь ими, можно предусмотреть и установить физическую и химическую "несовместимость". Под таким термином в фармации подразумевают процесс, изменяющий первоначальные химические , физические и фармацевтические свойства лекарственных препаратов и приводящий к ухудшению их качества (отсыревание порошков, взаимодействие между компонентами с образованием новых соединений). Изучение диаграмм плавкости помогает созданию лекарственных препаратов с заданными физическими свойствами. ТЕРМОДИНАМИКА ФАЗОВЫХ РАВНОВЕСИЙ Проработав тему, студенты должны уметь:
ОСНОВНЫЕ ПОНЯТИЯ Фаза - часть гетерогенной системы, ограниченная поверхностью раздела. Каждая фаза гомогенна, но не непрерывна, т.е. может состоять из отдельных кристаллов. По числу фаз системы делятся на одно, двух, трех, ... и многофазные. Каждая система состоит из одного или нескольких составляющих веществ. Химические вещества, которые могут быть выделены из системы и существовать вне ее самостоятельно называются составляющими веществами системы. Например, в водном растворе КС, составляющими веществами являются KCL, Н2О, а не ионы К+,,CL-, Н+, ОН-. Вещества, наименьшее число которых необходимо и достаточно для образования всех возможных фаз данной системы, находящейся в равновесии, называются компонентами, т.е. компоненты - это независимые составляющие вещества системы. Если в системе между составляющими веществами нет химического взаимодействия, то число компонентов равно числу составляющих веществ системы. При химическом взаимодействии в системе число компонентов находится как разность между числом составляющих веществ системы и числом уравнений, связывающих концентрации этих веществ. К = N сост. вещ. - N уравнен. По числу компонентов различают одно, двух, трех и многокомпонентные системы. В зависимости от способа образования равновесной системы и условий ее существования при одном и том же числе составляющих веществ системы число компонентов может быть разным. Например, равновесная, газообразная система, содержащая N2, Н2, NH3 может быть получена двумя путями: N2+3H2=2NH3 (a) 2NH3 = N2 +3H2 (б) Для реакции (а), если N2 и Н2 взяты в произвольных соотношениях, равновесные концентрации связаны между собой только одним уравнением: |
