Роберт Вильгельм Бунзен
 Скачать 2.24 Mb. Скачать 2.24 Mb.
|
|
Сванте Август Аррениус Сванте Аррениус успешно продолжил электрохимические исследования Фарадея, Берцелиуса и других химиков и разработал теорию электролитической диссоциации, которая в значительной степени способствовала формированию физической химии как науки. 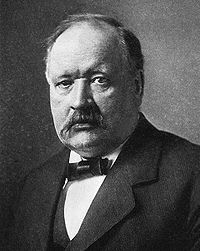 С.А. Аррениус родился 19 февраля 1859 г. Уже во время обучения в школе Аррениус проявил способность к естественным наукам, особенно к математике и физике. Поступив в Уппсальский университет, он избрал физику основной специальностью, а математику – дополнительной. В 1881 г. Аррениус перешел в Стокгольмскую Академию наук. Там он, продолжая физическое образование, занялся изучением электропроводности сильно разбавленных водных растворов. Аррениус понимал, что существенного прогресса химии можно достигнуть, только разработав методы определения молекулярных масс веществ, которые не переходят в газообразное состояние без разложения. Он предложил, что определение электропроводности растворов солей может помочь найти этот путь, и провел исследования. Свою работу в этом направлении Аррениус предложил Королевской Шведской Академии наук, а затем представил как докторскую диссертацию. В этой работе уже содержались основные положения теории электролитической диссоциации. Столь привычные в наши дни представления, что соли кислоты и основания в водном растворе находятся в большей или меньшей степени в виде свободно движущихся ионов, по мнению химиков того времени, ниспровергали все ранее существовавшие взгляды. Поэтому вначале почти все ученые принимали теорию Аррениуса весьма сдержанно, многие в значительной мере скептически, некоторые даже считали ее бессмыслицей. В диссертации, написанной в виде тезисов Аррениус ввел в химию понятие о коэффициенте активности (степени диссоциации). Там же были приведены отношения важные для ионной теории, в соответствии с которыми природа продукта реакции не зависит от того, в каком состоянии ионы А,В,С и D находятся в исходных веществах – электролитах AB и CD или AD и CB.В этой же теории Аррениус дал основы расчета степени гидролиза на основе закона действующих масс. Получив от Академии наук стипендию для обучения за рубежом, Аррениус смого продолжить свои физико-химические исследования в лабораториях выдающихся европейских ученых. В лаборатории Оствальда, где уделил основное внимание исследованиям электропроводных растворов. Оствальд решительно поддержал взгляды Аррениуса. На него произвели очень большое впечатление способы и методы, при помощи которых Аррениус изучал связь между кислотами и основаниями и даже частично решил эту проблему. В 1886-1887 гг. Аррениус исследовал в лаборатории Кольрауша внутреннее трение разбавленных растворов и влияние света на электропроводность галогеноидов. Последняя работа доставила большой экспериментальный материал для создания теории, объясняющей механизм процесса перемещения электронов. Большое значение для дальнейшего развития теории диссоциации имела известная работа Вант-Гоффа «Химическое равновесие в системах газов и разбавленных растворов (1885г.), в которой было установлено, что реальное понижение температуры плавления, давления пара и осмотического давления солей, кислот и оснований меньше, чем рассчитанное теоретически по закону Рауля. Эти несоответствия подтверждали положения теории диссоциации, согласно которым электролит в водных растворах распадается на свободные перемещающиеся ионы. Теорию электролитической диссоциации впоследствии была усовершенствована благодаря работам прежде всего Н. Бьеррума, П. Дебая и Э.Хеккеля. Они развили высказанные ранее И. Ван Лааром представления, что необычное поведение сильных электролитов можно объяснить действием кулоновских сил. За разработку теории электрохимической диссоциации Аррениус в 1903 г. был удостоен Нобелевской премии. Другим значительным вкладом Аррениуса в развитие естествознания было подробное физико-химическое рассмотрение теории токсинов и анти токсинов. В результате стало возможным выяснить, определяются ли противоположные действия токсинов и антитоксинов их химической природой или они имеют физическое происхождение. Основные результаты этих работ Аррениус изложил в двух книгах: «Иммунохимия» (1907 г.), и « Количественные законы химии» (1915 г.) При изучении этих областей знания Аррениус не ограничился лишь проведением Экспериментальных работ, он стремился раскрыть законы природы, лежащие в основе явления и сформулировать их математически. В 1905 г. Аррениус был приглашен на должность руководителя физико-химического отдела Нобелевского института Стокгольмской Академии наук. Эту работу Аррениус оставил летом 1927 г. по состоянию здоровья. В этом же году 12 сентября он скончался. Якоб Генрих Вант-Гофф  Первую Нобелевскую премию по химии получил в 1901 г. Якоб Генрих Вант-Гофф за открытие закона химической динамики и осмотического давления. Этой высокой наградой была отмечена важность молодой области науки – физической химии. Уже в первых работах Вант-Гофф привел веские доказательства положения: только применение физических и математических методов может обеспечить процесс фундаментальных и прикладных исследованиях по химии. Вант-Гофф стал основателем стереохимии. Вант-Гофф родился 30 августа 1852 г. в Роттердаме в семье врача. Уже в начальной школе учителя заметили у юного Вант-Гоффа любовь к музыке и поэзии. В дальнейшем он проявил замечательные способности к точным естественным наукам. По окончании школы в 1869 г. будущий ученый поступил в политехникум в Дельфте. В годы учения Вант-Гофф особенно заинтересовался дифференциальным и интегральным исчислениями, которые в то время привлекали пристальное внимание многих. В политехникуме Дельфа Вант-Гофф по уровню знаний значительно превосходил сокурсников и потому в 1871 г. без вступительного экзамена был принят в Лейденский университет. Позже в этом университете Вант-Гофф выдержал кандидатский экзамен. Помимо интереса к математике в нем опять вспыхнула «старая любовь к химии», и Вант-Гофф продолжил свое химическое образование в наиболее известных тогда центрах этой науки – в лабораториях Кекуле в Бонне и Вюрца в Париже. В декабре 1874 г. Вант-Гофф защитил докторскую диссертацию в университете Утрехта. Вант-Гофф ввел в науку положения, позволившие с новых позиций рассматривать строение химических соединений. Взгляды Кекуле – автора теории строения бензола- нашли отражение в предложенной Вант-Гоффом модели: четыре валентности атома углерода направлены к вершинам тетраэдра, в центре которого находится этот атом. Используя такую модель, Вант-Гофф предположил за счет связи атомов или атомных групп с углеродом тетраэдр может быть несимметричным, и высказал представление об асимметричном атоме углерода. «В случае, когда четыре сродства атома углерода насыщены четырьмя различными одновалентными группами, можно получить два и только два различных тетраэдра, которые представляют собой зеркальное отражение один другого и мысленно никак не могут быть совмещены, т.е. мы имеем дело с двумя структурами в пространстве. Замечательным достижением Вант-Гоффа явилось установление связи между наличием в соединении асимметрического атома углерода и оптической изомерии веществ. Вант-Гофф также объяснил другой вид изомерии, которые Вислиценус назвал «геометрической изомерией». Такова, например, изомерия кислот фумаровой (транс-изомер) и малеиновой (цис-изомер). Их структурные формулы одинаковы, а свойства различны. Для объяснения этого явления Вант-Гофф вновь использовал тетраэдрическую модель атома углерода, связав тем самым пространственное строение и химические свойства веществ. Так было вновь доказано важное значение мысленных моделей в химии. С 1877 по 189 гг. Вант-Гофф был профессором химии, минералогии и геологии в незадолго до того основанном Амстердамском Университете. В 1884 г. Вант-Гофф в книге «Очерки по химической динамике» изложил свои взгляды по этому вопросу. Голландский физикохимик разработал учение о скорости реакций и тем самым создал основания химической кинетики. Он определял скорость реакции как закономерное, но далеко не всегда равномерное изменение концентрации реагирующих веществ в единицу времени. Ему удалось эту закономерностьсформулировать в общем математическом виде. Установление зависимости скорости реакции от числа взаимодействующих молекул, а также тесно связанные с этим новые представления Вант-Гоффа о природе химического равновесия существенно способствовали значительному прогрессу теоретической химии. При этом было выяснено, что химическое равновесие, рассматриваемое Вант-Гоффом как результат двух противоположных направленных реакций, идущих с одинаковой скоростью, зависит от температуры. Представления о химическом равновесии Вант-Гофф связал с уже известными в то время двумя началами термодинамики.Важнейшим результатом этой работы был вывод Вант-Гоффом математической формулы, в которой отражена взаимосвязь температуры и теплоты реакции с константой равновесия. Эта закономерность сейчас известна как выведенное Вант-Гоффом уравнение изохоры реакции. В разработке учения о химическом равновесии на термодинамической основе значительную роль сыграли исследования Ле Шаталье, Горстмана и Гиббса. Одним из наиболее значительных открытий этого времени было установление природы движущей силыреакции химического сродства. Это понятие не было точно определено. Томсен в 1854 г. и Бертло в 1868 г. пытались сделать это, но успеха не добились. Вант-Гофф в 1885 г. высказал мысль, что мерой сродства может служить работа реакции, и вывел для нее математическое выражение. В него, однако, не входила константа равновесия из закона действия масс, сформулированного в общем виде в 1867 г. Гульдбергом и Ваге на основе представления о вероятности столкновения друг с другом реагирующих молекул. В 1885 г. Вант- Гоффу удалось вывести этот закон термодинамически, что сразу увеличило возможность его практического применения. Последним крупным вкладом Вант-Гоффа в теоретическую химию во время Амстердамского периода его деятельности было открытие аналогии осмотического и газового давления. На основании сформулированных Раулем эмпирических закономерностей о повышении точки кипения и понижении точки замерзания растворов, Вант-Гофф в 1885 г. разработал осмотическую теорию растворов. Он показал аналогию поведения растворенных веществ и газов и установил, что уравнение состояния идеальных газов PV=nRT при его использовании для описания осмотического давления в растворах имеет вид PV=inRT (i – коэффициент, характеризующий отклонение поведения некоторых веществ.) Осмотическое давление растворов было впервые измерено в 1877 г. ботаником Преффером, который пользовался искусственно приготовленными перепонками. Вант-Гофф смог понять, что это явление характерно вообще для химических процессов. Вант-Гофф установил, что растворенные молекулы производят осмотическое давление, равное тому давлению, которое оказывали бы те же молекулы, если бы они в газообразном состоянии заняли объем равный объему раствора. Это фундаментальное открытие показало единство законов физики и химии. Вант-Гофф оказал также большое влияние на дальнейшее развитие теории диссоциации, изучив природу зависимости между понижением температуры замерзания растворителя, давлением пара раствора и осмотическим давлением солей, кислот и оснований. Совместно с Вильгельмом Оствальдом Вант Гофф стал издавать с 1887 г. Журнал физической химии. В марте 1896 г.Вант-Гофф был избран действительным ченом Прусской Академии Наук и почетным профессором Берлинского университета. Давняя тяжелая болезнь Вант-Гоффа помешала ему глубже изучить синтетическое действие ферментов в живом растительном организме. Сделанный ученым в 1890 г. прогноз «химик дойдет своими синтезами до клетки, которая как органическая материя сейчас изучается биологами» блестяще подтвердился в наши дни. Именно эта задача встала перед специалистами в новой области исследований, которую разрабатывают совместно химики и биологи. Ученый пользовавшийся всеобщим уважением, член пятидесяти двух научных обществ и академий, первый лауреат Нобелевской премии по химии (1901 г.), кавалер медалей Довге, Гемгольца и других, прусского ордена «За заслуги в науках и искусствах», почетный доктор многих высших учебных заведений, Вант-Гофф оставил после себя ряд основополагающих теорий, которые и в наши дни имеют непреходящее значение для химии. Представления, идеи и взгляды Вант-Гоффа сыграли большую роль в разработке основ современной минералогии, а также для развития биологии. В историю науки Вант-Гофф вошел как один из основателей стереохимии, учения о химическом равновесии и химической кинетики, осмотической теории растворов и химической геологии. Умер Вант-Гофф 1 марта 1911 г. в Берлине. Иоханн Николаус Брёнстед и Михаил Ильич Усанович В истории химии понятия кислота и основания прошли долгий путь развития. Первое общепринятое определение кислот и оснований стало возможным лишь на основе теории электролитической диссоциации Аррениуса. Математическую трактовку свой ств кислот и оснований дал Сёренсен в 1909 г., введя величину рН. В установлении более широкого понятия принимает участие такие ученые как англичанин Лаури и датчане Бренстед и Бьеррум.  Брёнстед родился 22февраля 1879 г. в Варде (Дания). В 1897 г. стал студентом в Копенгагене. В 1899 г. Брёнстедсдал экзамен на звание инженера, спустя три года стал магистром, а в 1908 г. доктором наук. Брёнстед был профессором химии Копенгагенского университета и физикохимической лаборатории. В 1930 г. он стал директором политехнического отделения физико-химической лаборатории. В 1930 г. он стал физико-химического института Высшей технической школы в Копенгагене. В 1912 г. Брёнстед принимал участие в написании «Учебника физической химии», в 1916 г. были опубликованы его «Основы неорганической химии». На основании своих обширных исследований свойств растворов солей Брёнстед, в 1923 г. пришел к новому определению понятия кислоты. Исходя из результатов измерения физико-химических свойств растворов и опираясь на теорию Аррениуса, а также на закон действия масс, он достиг углубленного общего понимания характера кислот, отщепляющих протон, т.е. кислот в классическом смысле. С 1926 г. по 1928 г. Брёнстед читал лекции в высших учебных заведениях США. В то же время он продолжал разрабатывать теорию кислот и теорию каталитических процессов. Особое внимание Брёнстед уделил изучению реакций, катализируемых кислотами и основаниями. Наряду с этим Брёнстед продолжал начатые ранее физико-химические исследования термодинамических свойств растворов. В дальнейшем он расширил свои работы проведением интенсивных исследований по коллоидной химии, изучая влияние растворителя на некоторые реакции и, наконец, занимаясь физико-химическими исследования свойств ВМС. Брёнстед скончался в Копенгагене 17 декабря 1947 г. в возрасте 68 лет. Уже при жизни Брёнсте заслужил уважение и восхищение ученых за созданную им теорию кислот и оснований. Брёнстед определял кислоты и основания в зависимости от роли, которую играет ион водорода в системе кислота-основание6 Кислота ↔основание + протон В том же году, что и Брёнстед, и Лаури, Г.Н. Льюис сформулировал свои мысли о расширении области применения кислот и оснований. В обосновании своей теории Льюис исходил из электронной структуры кислот и оснований и из функции электронной пары при образовании координационной ковалентной связи. По Льюису поведение кислот и оснований характеризуется четырьмя критериями, подающимися экспериментальной проверке:
С учетом всего этого Льюис, сводя свойства веществ к их электронной структуре, пришел к следующим определениям понятий кислоты и основания: Кислоты – частицы, присоединяющие электронную пару при образовании ковалентной связи; основания – частицы, отдающие пару электронов при образовании ковалентной связи. Дальнейшим развитием теории Брёнстеда можно считать определение понятия «кислота», предложенное Усановичем. Это определение гораздо шире того, которое дал Брёнстед и освобождает химическую мысль от ограничений, неизбежно вносимых теорией водородных кислот. Многочисленные экспериментальные исследования электропроводности привели Усановича к очень важному заключению, что предпосылкой появления электропроводности является реакция между кислотой и основанием, приводящая к образованию электролита, т.е. соли. В качестве кислот в этих случаях выступают и такие вещества, как трихлорид мышьяка, трихлорид сурьмы и т.д. Следовательно, необходимо новое определение понятий кислота и основание. В 1928 г. Усанович опубликовал изложение своих теоретических воззрений на кислоты и основания. Основное положение этой теории состоит в отказе от водорода как универсального носителя кислотных свойств соединений. По Усановичу, кислотами являются все вещества, которые могут реагировать с основаниями, образуя соли. Очень многие из этих веществ не содержат в своем составе водорода. В частности, к кислотам должны быть причислены все катионы. Амфотерность трактуется следующим образом: вообще все полярные вещества амфотерны. Способность веществ реагировать как кислота или как основание в зависимости от природы соответствующего сореагента доказывает относительный характер химических свойств веществ. Реакции между веществами, обладающими противоположными (кислотными или основными) свойствами, приводят к ослаблению, но не к полному исчезновению этих свойств. На этом основании Усанович сделал неизбежный вывод, что как кислотность, так и основность – свойства, присущие в той или иной степени каждому веществу, а вовсе не связанные с принадлежностью к определенному классу соединений. Изложенные соображения убеждают в том, что при рассмотрении вопроса о кислотах и основаниях идет речь о химических функциях, а не о классах веществ. Понятия о кислоте и основании находятся в такой же взаимосвязи, как понятия «окислитель» и «восстановитель». Реакции комплексообразования также рассматриваются как кислотно-основное взаимодействие. В работах по изучению растворов основным методом исследования является физико-химический анализ. Он изучал электропроводность, вязкость, их температурные коэффициенты, показатель преломления и др. физические свойства растворов (давление пара, температура плавления и кипения); кроме того он анализировал закономерности, связывающие свойства растворов с их составом. Михаил Ильич Усанович родился 16 июня 1894 г. в семье врача в городе Житомире на Украине. В 1912 г. окончил с золотой медалью гимназию. До 1917г. учился на физико-математическом факультет Киевского университета, ученик Верна. В 1930 г. Усанович стал профессором. С 1935 г. – зав.кафедрой физической химии Среднеазиатского университета и директором химического института при университете.В 1946 г. был избран чл.-корр., а в 1962 г. действительным членом Академии наук Казахской ССР. Награжден орденами и медалями СССР, отмечен академическими отличиями (в числе которых почетный знак Высшей школы в Потсдаме). Николай Николаевич Семенов Н.Н. Семенов родился 15 апреля 1896 г. в Саратове. В 1917 г. окончил физико-математический факультет Петроградского университета. Семенов – ученик и сотрудник выдающегося советского физика А.Ф.Иоффе.  В основанном Иоффе Ленинградском физико-техническом институте Семенов работал с 1920 по 1931гг., когда был назначен директором Ленинградского института химической физики. В 1944 г. Институт химической АНСССР был переведен в Москву, и его директор Н.Н. Семенов стал профессором Московского государственного университета им М.В.Ломоносова. Семенов – лауреат Нобелевской премии (1956 г.), присужденной ему и английскому ученому Сирилу Норманну Хиншелвуду за исследования механизмов химических реакций. Семенов был третьим русским (после И.П. Павлова в 1904 г. и И.И.Мечникова в 1908 г.) и первым советским ученым, удостоенным этого высокого международного научного отличия. То, что через 55 лет после награждения первой Нобелевской премией по химии Вант-Гоффа эта высокая награда была присуждена за работы по изучению кинетики химических реакций, особенно подчеркивает заслуги Н.Н.Семенова. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА УЧЕБНО-ЦЕЛЕВЫЕ ЗАДАЧИ – НАУЧИТЬ СТУДЕНТОВ:
ЗНАЧИМОСТЬ ТЕМЫ Живые организмы обмениваются с внешней средой массой и энергией. Программа, по которой живые организмы преобразовывают свою энергию, закодирована в данном организме в виде генетической информации. Основным видом «топлива» для организма являются углеводы. Жиры играют роль резервного топлива, своеобразных «бензобаков». В чрезвычайных ситуациях (голод, стрессы) организм начинает сжигать уже не топливо, а свой основной строительный материал - аминокислоты белков. Дефицит белков приводит к дефициту незаменимых для организма аминокислот и возникновению различных заболеваний. Одним из основных термодинамических условий существования живой клетки является сохранение ряда постоянных характеристик внутренних сред организма: температуры, давления, концентрации веществ. Изменение концентрации веществ во внутренних средах организма может явиться причиной его заболевания, а иногда даже и гибели. Так, например, снижение содержания глюкозы в крови до 5 г/л или, наоборот, ее повышение до 30 г/л может привести к смерти. Снижение содержания глюкозы в крови вызывает чувство голода. После достижения необходимой концентрации глюкозы возникает чувство насыщения. Таким образом, аппетит здорового человека является регулятором снабжения его организма энергией. Однако, если этот регулятор нарушен, например, в результате болезни, эмоциональных стрессов или просто постоянных перееданий, то в крови может появиться значительный избыток глюкозы. Избыток глюкозы с помощью гормона инсулина превращается в жир, который откладывается в жировые ткани. При стрессовых ситуациях организм черпает энергию из двух источников: из «депо» глюкозы, находящегося в печени, и из «жировых депо». Второй путь предпочтительнее, так как он короче. Избыток жирных кислот, появляющийся в крови, снижает устойчивость организма к инфекциям, способствует развитию атеросклероза, сахарного диабета и др. Учитывая, что длительные стрессы способствуют возникновению гипертонической болезни и ее многочисленных осложнений, можно сделать вывод, что нарушение энергетического обмена является причиной ряда трудноизлечимых заболеваний человека. О людях, страдающих сердечно-сосудистыми заболеваниями, сахарным диабетом, можно сказать, что они как бы сгорают в пламени жиров. Термохимический анализ процессов окисления различных продуктов в живых организмах необходим не только для понимания механизмов преобразования различных веществ в энергию. Сравнение энергетики здоровых и больных клеток позволяет разработать раннюю диагностику различных заболеваний и контроль за их развитием. Проводятся исследования, направленные на поиск взаимосвязей между нарушением энергетического обмена в клетках и процессами неконтролируемого роста, приводящим в ряде случаев к появлению злокачественных опухолей. С позицией термодинамики живые организмы обладают меньшей по сравнению с окружающей средой энтропией, так как характеризуются высокой степенью у порядочности. Следовательно, в соответствии со вторым началом термодинамики являются неустойчивыми. Стремление всех систем к максимальному значению энтропии должно приводить к разрушению организмов, т.е. к выравниванию неравновесных по отношению к внешней среде значений температуры и концентраций веществ внутри живой клетки организма. Организм борется с увеличением энтропии двумя путями: Усваивает белки, жиры, углеводы - обладающие меньшей по сравнению с низкомолекулярными соединениями энтропией; а выделяет в окружающую среду продукты распада и окисления ВМС: воду, углекислый газ, мочевину, т.е. низкомолекулярные вещества, обладающие значительно большей энтропией, чем высокомолекулярные. Таким образом, живым организмам в течение некоторого времени, который составляет срок их жизни, удается сохранить высокую организованность системы, обладающую минимальной по сравнению с внешней средой энтропией. Исследование изменений термодинамических параметров в больном и здоровом организме показало, что возникновение и протекание заболеваний сопровождается увеличением энтропии системы. Увеличение энтропии отмечено также при развитии регенерации и эмбриогенеза. С развитием термодинамики стало возможным количественно рассчитать превращение энергии в биохимических реакциях и предсказать их направление. ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Система - тело или группа тел, мысленно выделенных из окружающей среды. Системы подразделяют на следующие виды: 1 фаза 2 фаза Открытая - система, которая может обмениваться с окружающей средой энергией и веществом (открытая колба с раствором, из которой может испаряться растворитель и которая может нагреваться и охлаждаться окружающей средой). Закрытой - называют систему, з которой отсутствует обмен веществом с окружающей средой, но она может обмениваться с ней энергией и работой (плотно закрытая колба с раствором. из которой не может испариться растворитель, но она может нагреваться и охлаждаться окружающей средой). Изолированной - называется система, не обменивающаяся веществом и энергией с внешней средой (раствор, помещенный в закрытый сосуд, стенки которого изготовлены из идеального теплоизоляционного материала). Гомогенная - система, в которой каждый параметр ее во всех частях системы имеет одно и то же значение или непрерывно изменяется от точки к точке. Гомогенная система состоит из одной фазы. Гетерогенная - состоит из нескольких макроскопических частей фаз), отделенных одна от другой видимыми поверхностями раздела (лед-вода вода-бензол). Фаза - гомогенная часть системы, отделенная от других частей системы поверхностью раздела. Состояние системы характеризуется совокупностью всех химических и физических свойств.
Свойства, которые зависят от массы и которые выравниваются при контакте систем, называют интенсивными (температура, давление, плотность, концентрация, химический потенциал). Свойства, которые не зависят от массы, называют экстенсивными (объем, масса, теплоемкость, внутренняя энергия, энтальпия, энтропия). В термодинамике рассматривают те свойства, которые могут быть выражены через функции температуры, давления и концентрации веществ системы. Такие свойства называются термодинамическими (теплоемкость, внутренняя энергия, энтропия). Термодинамические свойства системы взаимосвязаны между собой. Для полного описания состояния системы достаточно бывает знать некоторое наименьшее число термодинамических свойств, которые называются параметрами состояния системы. Обычно в качестве параметров выбирают такие свойства системы, которые наиболее легко определяются экспериментально (Р, V, Т, с). Свойства системы, которые не поддаются непосредственному измерению (внутренняя энергия, энтальпия), рассматривают как функции основных параметров состояния (функции состояния). При переходе системы из одного состояния в другое изменяются ее свойства. Изменение свойств не зависит от пути перехода, а определяется лишь начальным и конечным состоянием системы, т.е. значениями термодинамических параметров в этих двух состояниях.
Если, наблюдая за какой-то определенной системой, установим, что в ней изменяется во времени хотя бы одно из термодинамических свойств, то это значит, что в системе протекает термодинамический процесс. Если при протекании процесса наблюдается изменение химического состава системы, то процесс называют химической реакцией. Все процессы в природе можно разделить на самопроизвольные (естественные) и несамопроизвольные. Самопроизвольные - такие процессы, которые не требуют затраты энергии из внешней среды (переход теплоты от более нагретого тела к менее нагретому, растворение соли в воде). Несамопроизвольные процессы требуют для своего протекания затраты энергии (разделение смеси газов на составляющие компоненты). В результате самопроизвольного процесса в изолированной системе устанавливается равновесное состояние. Под равновесным состоянием понимают такое состояние системы, которое сохраняется неизменным во времени, и это состояние не поддерживается каким-либо внешним процессом по отношению к системе. Равновесным термодинамическим процессом называют процесс, который протекает бесконечно медленно и через непрерывный ряд состояний, бесконечно близких к разновесным состояниям. Процесс, при котором система проходит через неравновесные состояния, называется неравновесным. Неравновесный процесс в изолированной системе будет протекать до тех пор, пока в ней не наступит равновесное состояние. Система, совершившая равновесный процесс, может вернуться в исходное положение, пройдя в обратном процессе те же равновесные состояния, которые она проходила в прямом процессе. Это свойство равновесного процесса называется его обратимостью. Поэтому, обратимым называют равновесный процесс, который может возвратиться в первоначальное состояние без каких-либо энергетических изменений в окружающей среде или в самой системе под влиянием бесконечно малой силы. Если система или окружающая среда не могут возвратиться в первоначальное состояние, т.е. в них останутся изменения, то процесс называют необратимым. Говорить об обратимых и необратимых процессах можно лишь для изолированных систем. Для неизолированных систем применяют термины «равновесная» и «неравновесная». Термодинамический процесс вызывает энергетические изменения в системе, которые выражаются через изменение определенных величин: внутренней энергии, энтальпии, теплоты, работы. ВНУТРЕННЯЯ ЭНЕРГИЯ Любая термодинамическая система состоит из атомов и молекул, находящихся в непрерывном движении. Количественной характеристикой движения является энергия. Внутренняя энергия (U) характеризует общий запас энергии системы. Она включает все виды движения и взаимодействия частиц, составляющих систему: кинетическую энергию молекулярного движения, межмолекулярную энергию притяжения и отталкивания частиц, внутримолекулярную или химическую энергию, энергию электронного возбуждения, внутриядерную и лучистую энергию. Величина внутренней энергии зависит от природы вещества, его массы и параметров состояния системы. Определение полного запаса внутренней энергии вещества невозможно, т.к. нельзя перевести систему в состояние, лишенное внутренней энергии. Поэтому в термодинамике рассматривают изменение внутренней энергии (∆U), которое представляет собой разность величин внутренней энергии системы в конечном и начальном состояниях: ∆U = Ukoh. – Uнач. Бесконечно малое изменение внутренней энергии обозначают через du т.к. внутренняя энергия является функцией состояния и ее изменение не зависит от пути процесса, а определяется только начальным и конечным состоянием системы, то du будет полным дифференциалом. Величины ∆U и du считают положительными, если внутренняя энергия при протекании процесса возрастает, а отрицательными если убывает. ТЕПЛОТА И РАБОТА Передача энергии от системы к окружающей среде и наоборот осуществляется в виде теплоты (Q) и работы (А).
Форма передачи энергии от одной части системы к другой вследствие неупорядоченного движения молекул, зависящая лишь от температуры частей системы и не связанная с перекосом вещества в системе называется теплотой. Теплота связана с процессом, а не с состоянием системы, т.е. теплота является функцией состояния она зависит от пути процесса поэтому бесконечно малое количество теплоты обозначается δQ и не является полным дифференциалом. Теплота, подводимая к системе, считается положительной, а отданная ею - отрицательной. Работа процесса - это энергия, передаваемая одним телом другому при их взаимодействии, не зависящая от температуры этих тел и не связанная с переносом вещества от одного тела к другому. Работа, как и теплота, связана с процессом и не является свойством системы, т.е. функцией состояния. Paбoту, совершаемую системой против внешних сил. принято считать положительной, а совершаемую над системой - отрицательной. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ Первый закон имеет несколько формулировок:
Математическое выражение I закона: Q = ∆U + A, (1) где Q - количество сообщенной системе теплоты; ∆U - изменение внутренней энергии; А - суммарная работа, совершаемая системой. Для бесконечно малых элементарных процессов уравнение (1) имеет вид: δQ = du – δА = du - pdV + δА, где pdV - работа расширения; δА - сумма всех остальных видов элементарных работ (магнитная, электрическая и др.). Величину δА называют полезной работой. В химической термодинамике принимают во внимание только работу расширения, а работу δА считают равной 0. Поэтому δА = pdV, тогда δQ= du + pdV (2) Из уравнений (1.2) следует, что количество, теплоты подведенное к системе или отведенное от нее идет на изменение внутренней энергии и на работу, совершаемую системой или совершаемую над системой. ПРИМЕНЕНИЕ I ЗАКОНА К ПРОСТЕЙШИМ ПРОЦЕССАМ
δQv = du, Qv = нач ʃкон du = ∆U Qv = ∆U (3) Следовательно, при V=const вся теплота, подведенная к системе, расходуется на увеличение ее внутренней энергии. Из уравнения (3) следует, что теплота Qv является функцией состояния, т.е. не зависит от пути процесса.
Из уравнения Менделеева-Клапейрона PV – nRT А = рV2 – pV1 = nRT2 – nRT1 = nR(T2 – T1), где работа расширения сопровождается увеличением газа и повышением температуры. δQp = dU – δA = dU – pdV = d(U + pV) = dH (U + pV) - энтальпия системы δQp = dH; Qp = ∆H (4) Количество теплоты изобарного процесса является мерой изменения энтальпии. Так как H = U + pV является функцией состояния, то и Qр является функцией состояния. Если участники реакции находятся в конденсированном состоянии, то ∆V ≈ 0 Qp ≈ ∆U, Qp ≈ Qv, ∆H ≈ ∆U, Если же в химической реакции участвуют газы, то изменение объема будет связано с изменением числа молей газообразных участников реакции, поэтому р∆V = ∆nRT, где ∆n – разность между числом молей газообразных продуктов реакции и исходных веществ. Таким образом, для химической реакции с участием газов Qp – Qv = ∆nRT
Для идеального газа, а также для реального газа при невысоких давлениях внутренняя энергия является только функцией температуры. Поэтому при изотермических условиях U = const δQT = ∆A = pdV; QТ = А (5) Работа, совершаемая над системой, полностью превращается в тепло, которое выделяется системой в окружающее пространство, а подводимое к системе тепло полностью расходуется на производство работы расширения.
δQ = 0; δA = –dU; A = –∆U (6) Работа при адиабатном процессе совершается за счет убыли внутренней энергии. ТЕПЛОВЫЕ ЭФФЕКТЫ. ЗАКОН ГЕССА | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
