Роберт Вильгельм Бунзен
 Скачать 2.24 Mb. Скачать 2.24 Mb.
|
|
Это и есть математическое выражение второго закона Рауля: понижение температуры замерзания или повышение температуры кипения растворов прямо пропорционально его моляльной концентрации. Коэффициент К в уравнении (7) носит название криоскопической постоянной, показывает молярное понижение температуры замерзания раствора, является индивидуальной характеристикой растворителя (КН2О=1,86º) и имеет ту же размерность, что и Е (Кº·кг·моль-1) Метод исследования, основанный на измерении понижения температуры замерзания растворов, называется криоскопическим. Он также, как и эбуллиоскопический позволяет вычислить молярную массу растворенного вещества 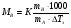 На рис.3 изображен прибор, предназначенный для измерения температуры замерзания растворов. 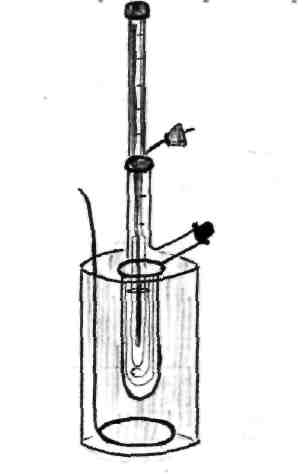 ОСМОС И ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ. Весьма важным в биологическом отношении свойством растворов является осмос. В природе часто растворы отделяются от растворителя мембранами, проницаемыми лишь дл я частиц растворителя. В этом случае растворенное вещество диффундировать в растворитель не может, и будет наблюдаться только переход растворителя в в раствор, т.е. растворитель будет перемещаться в обоих направлениях, но все же в раствор его будет переходить немного больше, чем в обратном направлении. Механизм осмоса легко представить на основе изотермической перегонки. Пусть полупроницаемая мембрана, имеющая микропоры, разделяет растворитель и раствор с концентрацией Св (рис.4) 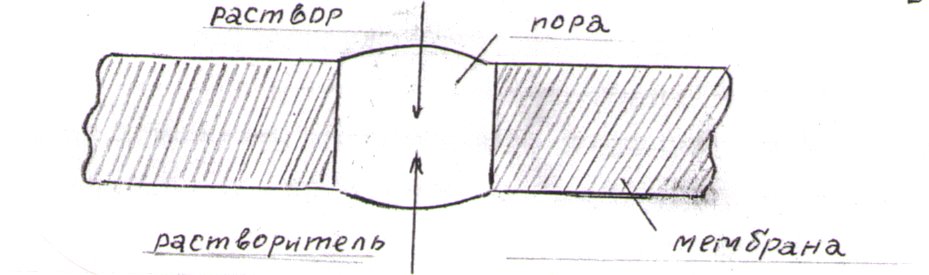 рис.4 В пору, ограниченную с одной стороны растворителем, а с другой раствором, идет испарение. Вследствие повышения по закону Рауля упругости насыщенного пара со стороны растворителя из парообразной фазы концентрируется, переходя в раствор. В результате осмоса увеличивается объем раствора, и его концентрация постепенно снижается; проникающий через мембрану в раствор растворитель увеличивает столб жидкости h и, следовательно, повышает гидростатическое давление (см. рис.5). Одновременно будет возрастать число молекул растворителя, перемещающихся через мембрану в обратном направлении, т.е. из раствора в растворитель. постепенно гидростатическое давление и разбавление раствора достигнут величин, при которых количество молекул растворителя, перемещающихся в обоих направлениях, уравняется и наступит осмотическое равновесие. Развившееся в результате осмоса избыточное гидростатичекое давление, измеряемое столбом раствора высотой h, при котором устанавливается осмотическое равновесие, называют осмотическим давлением. 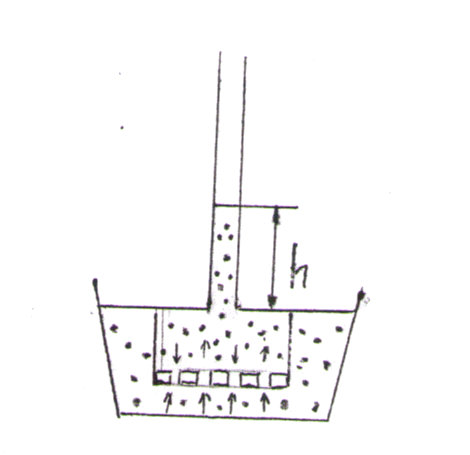 рис. 5 рис. 5Полупроницаемыми для многих растворов являются мембраны из коллодия, целлофана, железистосинеродистой меди и др. ЗАКОНЫ ОСМОТИЧЕСКОГО ДАВЛЕНИЯ. Изучение законов осмотического давления выявило их полную аналогию с газовыми законами. Для разбавленных растворов неэлектролитов их можно сформулировать так: при постоянной температуре осмотическое давление прямо пропорционально молярной концентрации растворенного вещества (аналогия с законом Бойля-Мариотта): 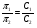 при постоянной молярной концентрации осмотическое давление прямо пропорционально абсолютной температуре (аналогия с законом Гей-Люссака): 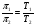 Из двух этих законов следует, что при одинаковых молярных концентрациях и температуре растворы разных неэлектролитов создают одинаковое осмотическое давление, т.е. эквимолярные растворы неэлектролитов изотоничны (аналогия с законом Авогадро). Вант-Гоффом был предложен объединенный закон для осмотического давления в растворах (аналогично объединенного газовому закону Менделеева-Клайперона): Осмотическое давление разбавленных растворов неэлектролитов прямо пропорционально молярной концентрации, коэффициенту пропорциональности и абсолютной температуре: так как с=n/V, где n – число молей неэлектролита, а V – объем раствора, то 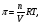 или или 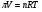 БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ОСМОТИЧЕСКОГО ДАВЛЕНИЯ Осмос имеет большое значение для растительных и животных организмов, способствуя достаточному оводнению клеток и межклеточных структур. Возникающее при этом осмотическое давление обусловливает тургор клеток. Каждая живая клетка имеет оболочку или поверхностный слой протоплазмы, обладающие свойством полупроницаемости. Помещая животные или растительные клетки в дистиллированную воду, можно наблюдать перемещение воды внутрь клеток, что ведет к их набуханию, а затем к разрыву оболочек и вытеканию клеточного содержимого. Подобное разрушение клеток путем разрыва их оболочек (или поверхностных слоев протоплазмы) называют лизисом, а в случае эритроцитов – гемолизом. В крепких растворах солей отмечается, наоборот, сморщивание клеток (плазмолиз), обусловленное потерей воды, перемещающейся из них в более концентрированный внешний раствор. Растворы с осмотическим давлением, равным давлению раствора, взятого за стандарт, называются изотоническими (изоспо-гречески равный). Растворы с осмотическим давлением более высоким, чем в стандарте, называются – гипертоническими, с меньшим давлением – гипотоническими. Осмотические давление биологических жидкостей в различных организмах неодинаково: так, осмотическое давление крови у лягушек несколько ниже, чем у человека, а у некоторых морских животных, обитающих в воде со значительным содержанием солей, оно выше. У растений, а также у многих морских животных и акуловых рыб осмотическое давление тканевых жидкостей в определенной степени меняется в зависимости от осмотического давления внешней среды. Более высокоорганизованные животные имеют постоянное осмотическое давление крови, независящее от внешней среды. Постоянство этого показателя называют изоосмией. Нарушение изоосмии оказывается губительным для организма гораздо раньше, чем наступает плазмолиз или лизис клеток. Понижение осмотического давления введением больших избытков воды или в результате интенсивной потери солей, например с потом, вызывает рвоту, судороги, затемнение сознания и т.п., вплоть до гибели организма. Повышение же осмотического давления путем введения больших количеств воды. Вода скапливается в тех тканях, в которых откладывается избыточное количество солей, что вызывает их отеки (в первую очередь подкожной клетчатки); в то же время обезвоживание слизистых оболочек обусловливает чувство жажды, нарушает нормальную деятельность нервной системы и других жизненно важных органов. В организм человека и животных можно вводить в больших количествах только изотонические растворы. Такие растворы вводят больным после тяжелых операций для возмещения потерь жидкости с кровью. При хирургических операциях извлеченные из брюшной полости петли кишок предохраняют от высыхания, обкладывая их марлевыми салфетками, смоченными физиологическим раствором. В клинической практике применяются гипертонические растворы. небольшое количество их вводят внутривенно, например при глаукоме, характеризующейся повышенным внутриглазным давлением, чтобы «оттянуть» избыточное количество влаги из передней камеры глаза. В хирургии широко применяют гипертонические повязки, представляющие собой марлевые полоски, смоченные в гипертонических растворах NaCl и введенные в гнойные раны; согласно законам осмоса ток раневой жидкости направляется по марле наружу, что способствует постоянному очищению раны от гноя, микроорганизмов, продуктов распада и пр. Используемые в качестве слабительных средств плохо всасывающиеся в желудочно-кишечном тракте соли MgSO4 и Na2SO4 применяют также в виде гипертонических растворов. Это вызывает переход больших количеств воды из слизистой оболочки в просвет кишечника, что способствует послабляющему действию сульфатов. Создание изоосмической (изотонической) среды совершенно необходимо при экспериментальных исследованиях на выделенных из организма органах и тканях. КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ ЭЛЕКТРОЛИТОВ. Растворам электролитов присущи все основные свойства растворов неэлектролитов. Однако, в растворах электролитов отсутствует та пропорциональность между молярной концентрацией и осмотическим давлением, повышением температуры кипения и т.п., которая была установлена для растворов неэлектролитов. В растворах электролитов осмотическое давление и температура кипения выше, а температура замерзания ниже, чем следовало бы ожидать исходя из молярной концентрации. Причина этих отклонений заключается в диссоциации электролитов, в результате чего в растворах оказывается большее число кинетически активных частиц (сумма молекул и ионов), чем в эквимолярных растворах неэлектролитов. Чтобы законы, применяемые для электролитов, можно было использовать и для растворов неэлектролитов, Вант-Гофф ввел поправку – коэффициент i. Коэффициент Вант-Гоффа показывает, во сколько раз истинная концентрация кинетически активных частиц и, следовательно, осмотическое даление, понижение температуры замерзания, понижение давления пара, повышение температуры кипения в растворе электролита больше, чем в эквимоляльном растворе неэлектролита: 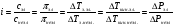 Величина связана со степенью диссоциации электролита следующим соотношением: 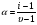 υ – количество ионов, на которое диссоциирует одна молекула электролита. Используя коэффициент i, можно применять закон Рауля, его следствия и законы осмотического давления к растворам электролитов: 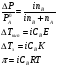 При одинаковой температуре растворы электролитов, содержащие равные количества частиц (молекул и ионов) в единице объема растворителя, изотоничны. Из двух растворов электролитов с одинаковой молярной концентрацией осмотическое давление будет выше в растворе электролита с более высокой степенью диссоциации. При одинаковой степени диссоциации в растворе электролита, диссоциирующего на большее число ионов, осмотическое давление будет выше. Изучение коллигативных свойств разбавленных растворов электролитов и неэлектролитов привело к формированию физической теории растворов. При подготовке к занятию необходимо, используя конспект лекций, а также указанные учебные пособия, подготовить следующие вопросы:
УКАЗАНИЯ К ВЫПОЛНЕНИЮ РАБОТЫ.
ЗАДАНИЕ №1 ОПРЕДЕЛЕНИЕ ПОНИЖЕНИЯ ТЕМПЕРАТУРЫ ЗАМЕРЗАНИЯ РАСТВОРОВ. Сущность метода необходимо сформулировать самостоятельно после ознакомления с теорией вопроса и ходом выполнения работы (если будут затруднения, то сущность метода можно будет сформулировать после выполнения задания). Ход работы: (О.О.Д. и техника их выполнения) Перед началом работы необходимо проверить на рабочем месте наличие следующих приборов и реактивов.
Для проведения работы необходимо приготовить 2 стакана 2.1. С тающим льдом для настройки термометра Бекмаа
Перед проведением работы проверить калибровку термометра, для этого: 3.1. Термометр Бекмана настраивается на температуру замерзания чистого растворителя. Так как в работе используют водные растворы, то термометр Бекмана должен быть настроен на температуру замерзания воды. 3.2. Для проверки термометра Бекмана надо погрузить его в стакан с тающим льдом. Если мениск ртути будет находиться в пределах шкалы от 0 до 5 С, то термометр настроен. Удобно для работы, когда мениск ртути находится в верхней части шкалы от 3 до 5 С. Убедившись в настройке термометра Бекмана и определив примерный нуль на шкале, приступить к более точному определению температуры замерзания чистого растворителя. Для этого: 4.1. В чистый криометр наливают столько дистиллированной воды, чтобы при погружении в нее термометра Бекмана нижний резервуар ртути находился в воде на глубине 1-2 см. 4.2. Закрепить термометр Бекмана и проверить работу мешалки, которая должна свободно перемещаться. 4.3. Поместить криометр с термометром Бекмана в охлаждающую смесь на 30-4- сек. и вести перемешивание воды мешалкой. 4.4. Достать криометр из охлаждающей смеси и перемешивать на воздухе тоже примерно 30-40 сек. Эту операцию (охлаждение – нагрев) повторять до тех пор пока мениск ртути не покажет значения примерно зафиксированного нуля, отмеченного при проверке настройки термометра Бекмана. По достижении этой температуры, криометр не вынимать из охлаждающей смеси, перемешивание продолжать. для кристаллизации нужен запас энергии, поэтому сначала идет переохлаждение воды и мениск ртути термометра Бекмана опускается ниже примерного нуля, а когда начинается кристаллизация, то ртуть идет вверх за счет выделившийся скрытой теплоты кристаллизации. Максимально достигнутые значения соответствуют температуре замерзания чистого растворителя ( в данном случае воды). Результаты с точностью од 0,01 с занести в таблицу №1. 4.5.Извлечь криометр из охладительной смеси при этом кристаллы расплавятся. 4.6. повторить кристаллизацию еще дважды. Из трех результатов взять среднее значение температуры замерзания чистого растворителя. Приступить к определению температуры замерзания растворов. Для этого:
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ ПО ТЕХНИКЕ ВЫПОЛНЕНИЯ РАБОТЫ
| ||||||||||||||||||||||||
