Роберт Вильгельм Бунзен
 Скачать 2.24 Mb. Скачать 2.24 Mb.
|
|
ПОНЯТИЕ О СКОРОСТИ ХИМИЧЕСКОГО ПРОЦЕССА Скорость химической реакции определяется числом молекул, реагирующих в единицу времени в единице объема. Так как это число эквивалентно изменению количества вещества (исходного или продукта) , то можно записать: 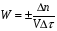 Однако, для реакции N2 + 3H2→ 2NH3 убыль водорода превышает убыль азота втрое ,поэтому точнее следует говорить не о скорости химического процесса вообще, а о скорости превращения какого либо компонента или о скорости по некоторому компоненту: 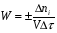 Изучение различных реакций показывает, что скорость превращения может меняться в ходе реакции, т.е.скорость является функцией времени: W = f (τ). Поэтому вместо средней величины W применяют более точную характеристику быстроты химического превращения – истинную скорость (W ист.) 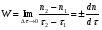 Такой подход к определению скорости справедлив как для гомогенных, так и для гетерогенных реакций. Однако быстроту гомогенных превращений удобнее характеризовать величиной: 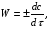 где 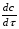 - производная концентрации по времени. Единицы измерения скорости реакции (W) в CИ 1моль/(л ∙с). В биохимической практике мг/(100мл ∙с). - производная концентрации по времени. Единицы измерения скорости реакции (W) в CИ 1моль/(л ∙с). В биохимической практике мг/(100мл ∙с).В химической кинетике широко используется графический метод изображения функциональных зависимостей. Кривая, отражающая изменение какого-либо вещества во времени в ходе химического превращения, называется кинетической кривой. 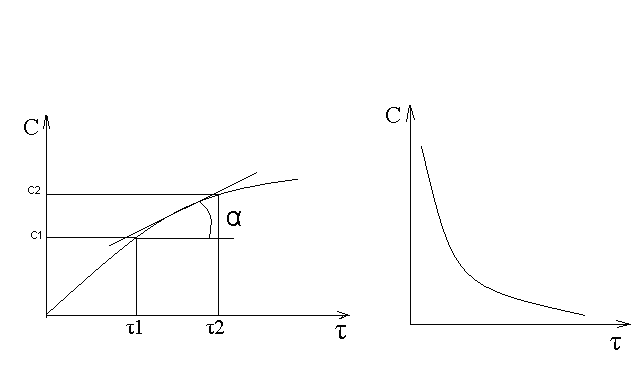 Рис.1 Кинетическая кривая для продуктов реакции. Рис.2 кинетическая кривая для реагентов Получив кинетическую кривую для какого-либо компонента, можно легко определить скорость его накопления или расходования графическим дифференцированием кинетической кривой. Например, среднюю скорость накопления продукта в интервале времени  и и  можно выразить как: можно выразить как: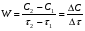 Чтобы выражение для скорости было всегда положительным при убывающей концентрации реагента, необходимо правую часть уравнения записывать с отрицательным знаком: 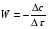 Величина скорости в каждый момент времени определяется как: 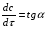 Скорость химической реакции зависит от целого ряда факторов: природы реагирующих веществ, их фазового состояния, текущих концентраций исходных и конечных веществ, температуры и др. Последовательность перечисления факторов соответствует степени их важности. ОСНОВНОЙ ЗАКОН ХИМИЧЕСКОЙ КИНЕТИКИ Количественно связь между скоростью реакции и концентрациями реагирующих веществ определяется законом действующих масс: При постоянной температуре, давлении, реакционной среде скорость химической реакции прямо пропорциональна действующим массам – молярным концентрациям реагирующих веществ, взятым в степени соответствующих стехиометрических коэффициентов. Этот основной постулат химической кинетики вытекает из физически очевидного предположения о том, что реагируют те молекулы, которые сталкиваются. Число столкновений зависит от концентрации молекул, поэтому и скорость химической реакции должна определятся теми же факторами .Применение этого принципа приводит к общему выражению для скорости реакции, протекающей по уравнению. аА + вВ → продукты. 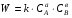 ,где ,где k- константа скорости, она зависит от природы реагирующих веществ и температуры. Размерность константы скорости зависит от порядка реакции и выражается в следующих единицах: 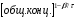 ; β-общий порядок; ; β-общий порядок; 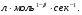 Показатели степени а и в называют порядком реакции по веществу А и В. Сумма порядков а+в называют общим порядком реакции. Это стехиометрический порядок. Кроме стехиометрического порядка имеет место кинетический порядок, который определяется только экспериментально. Поэтому для выше приведенной реакции следует записать: 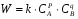 ; ; 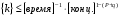 Для большинства реакций кинетические порядки не совпадают со стехиометрическими. Порядок реакции может быть любым числом: целым, дробным, положительным и отрицательным. Возможны реакции и нулевого порядка, когда скорость реакции не зависит от концентрации. Порядок реакции зависит от механизма реакции, поэтому факторы, влияющие на механизм процесса (конц, темпер.), могут влиять на величину порядка реакции. Важной характеристикой реакции является ее молекулярность. Для простой реакции молекулярность- это число частиц, которые согласно установленному механизму( а не по написанному уравнению) участвуют в одном элементарном акте. Реакции бывают: - мономолекулярными J2→J+J - бимолекулярными CH3Br +KOH→CH3OH + KBr - тримолекулярными 2NO + O2→2NO2 Участие в элементарном акте более трех частиц крайне маловероятно. Кинетический порядок элементарной реакции равен ее молекулярности. Поэтому предоставленные в качестве примера реакции соответственно будут реакциями первого, второго и третьего порядка. Для сложных реакций, протекающих в несколько стадий, нет смысла говорить о молекулярности в целом, т. к. это понятие применимо только к отдельным стадиям. КИНЕТИЧЕСКИЕ УРАВНЕНИЯ РЕАКЦИЙ Рассмотрим кинетические закономерности необратимых реакций. Реакция характеризуется кинетическим уравнением, которое позволяет рассчитать константу скорости в любой момент времени от ее начала и период полупревращения. Реакции нулевого порядка. Реакций нулевого порядка очень мало, большая их часть является гетерогенными реакциями. Нулевой порядок реакции указывает на независимость скорости реакции от концентрации реагентов. Такая закономерность возможна когда: - концентрация реагента поддерживается постоянной (насыщенный раствор). - когда реакция протекает не совсем обычным путем (фотохимические, каталитические). Для реакции А→ продукты выражение скорости как функции концентрации имеет вид: 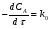 Разделив переменные получим, 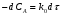 Запишем интеграл, взяв пределы концентрации в интервале времени (0 и 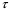 ): ):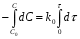 Проинтегрировав, получим: 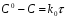 ; ; 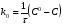 , ,Где к0 - константа скорости реакции нулевого порядка, моль/(л 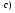 Важной количественной характеристикой протекания реакций во времени является время полупревращения 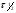 реагента. реагента.Эта величина определяется промежутком времени, в течение которого начальная концентрация 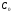 уменьшается в ходе реакции в два раза. уменьшается в ходе реакции в два раза.Если уравнение кинетики реакции известно, время полупревращения нетрудно выразить через константу скорости. Для этого в уравнении кинетики подставляют значения 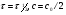 . В результате из уравнения кинетики реакции нулевого порядка получают: . В результате из уравнения кинетики реакции нулевого порядка получают: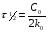 РЕАКЦИИ ПЕРВОГО ПОРЯДКА В реакции первого порядка скорость пропорциональна концентрации одного реагента. Для такой реакции, как А → продукты выражение скорости как функции концентрации имеет вид: 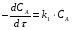 Далее схема рассуждений аналогична предыдущей: разделим переменные, запишем интеграл, проинтегрируем и получим выражение для константы скорости реакции первого порядка, 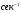 . .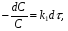 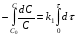 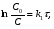 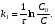 Период полупревращения не зависит от начальной концентрации и равен: 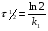 РЕАКЦИИ ВТОРОГО ПОРЯДКА Они бывают двух типов: в одном случае реагируют друг с другом две молекулы одного и того же вещества, в другом - две молекулы разных веществ. Для такой реакции как 2А→ продукты выражение скорости имеет вид: 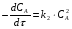 Далее, рассуждая по известной нам схеме получим: 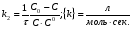 Для реакции А + В → продукты выражения скорости будет иметь вид: 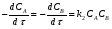 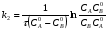 ; ; 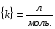 СЛОЖНЫЕ РЕАКЦИИ Если реакция сложная, то для изучения зависимости ее скорости от концентрации реагентов необходимо знать кинетический механизм, т.е. элементарные стадии через которые осуществляется изучаемое превращение. По кинетическому механизму все сложные реакции подразделяются на следующие типы:
Последовательными называются сложные реакции, в которых продукт первой стадии вступает в реакцию второй стадии, продукт второй стадии вступает в третью и т. д. пока не образуется продукт реакции. 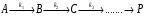 Рассмотрим простейшую последовательную реакцию, состоящую из двух мономолекулярных стадий: 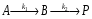 Кинетика этой реакции списывается системой из трех дифференциальных уравнений, которые составляются для скорости простых реакций, на основе закона действующих масс: 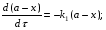 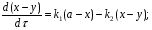 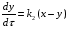 , где , гдеа - концентрация вещества А при τ =0; (a-x)- концентрация вещества А к моменту времени τ; (x-y)- концентрация вещества В к моменту времени τ; y- концентрация вещества P к моменту времени. Если реакция протекает с образованием промежуточных продуктов, концентрации которых вблизи максимума изменяются незначительно, то можно считать, что они стационарны. Из этого следует: 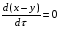 Интегрирование системы уравнений с учетом принципа стационарных концентраций дает следующее решение: 1. При 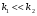 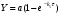 . Реакция первого порядка, скорость определяется первой стадией. . Реакция первого порядка, скорость определяется первой стадией.2. При 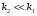 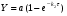 .Реакция также первого порядка, скорость определяется второй стадией. .Реакция также первого порядка, скорость определяется второй стадией.Кинетические кривые отражают наиболее характерные особенности последовательных реакций. Концентрация исходного вещества (А) монотонно убывает. Концентрация промежуточного вещества (В) в начале возрастает, достигает максимума, затем падает. Концентрация конечного продукта (P) монотонно возрастает со временем. 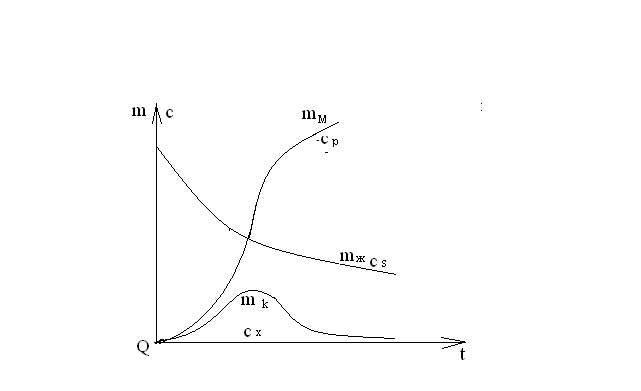 Рис.3 Кинетические кривые для последовательной реакции. В точке максимума выполняется соотношение: 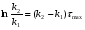 Величина 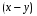 max. зависит от max. зависит от 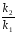 , но не зависит от абсолютных значений констант. При этом, чем больше , но не зависит от абсолютных значений констант. При этом, чем больше 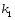 тем больше образуется тем больше образуется 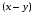 max. и тем ближе к началу координат лежит максимум. max. и тем ближе к началу координат лежит максимум.Обычный путь лекарственного вещества в организме можно рассматривать как последовательность двух процессов: всасывание из желудка в кровь (характеризуется константой всасывания квс) и выведение из крови в мочу (характеризуется константой выведения квв): 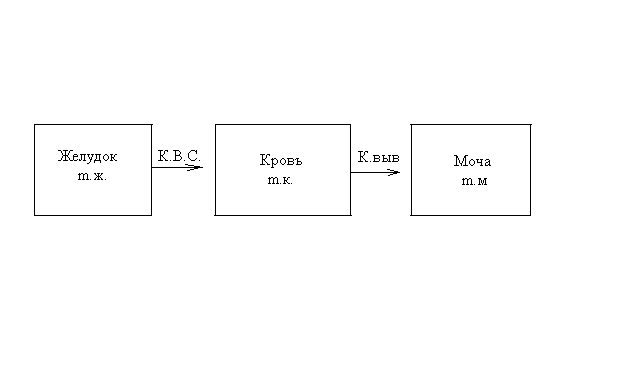 Кинетика изменения массы лекарства в желудке Кинетика изменения массы лекарства в желудке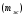 , крови , крови 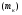 моче моче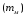 описывается уравнениями и кривыми, аналогичными для выше рассмотренной реакции: А → В → Р описывается уравнениями и кривыми, аналогичными для выше рассмотренной реакции: А → В → РПараллельные реакции. Реакции называются таковыми, если в каждой из них принимает участие одно и тоже исходное вещество, которое одновременно по различным направлениям превращается в разные продукты. Возможность таких реакций определяется термодинамической вероятностью (∆G<0), но относительные количества продуктов реакции определяются всецело соотношением скоростей, а не соотношением их термодинамической устойчивости. При значительном различии скоростей параллельных реакций главной называют ту, которая имеет большую скорость. При небольшом различии в скоростях реакций главной считают ту, которая приводит к образованию нужных продуктов. Рассмотрим наиболее простой случай, когда обе реакции являются реакциями первого порядка: 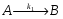 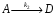 В этом случае 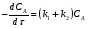 , где , где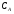 - текущая концентрация вещества А. - текущая концентрация вещества А.Разделяя переменные и интегрируя получаем: 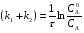 Для определения каждой константы в отдельности учтем, что концентрации веществ, прореагировавших по первой и второй реакциям, пропорциональны константам, соответствующих скоростей 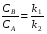 Таким образом, определив в какой либо момент времени соотношение продуктов реакций, можно найти отношение констант, а следовательно и каждую константу в отдельности. Зависимость изменения концентраций от времени для продуктов параллельных реакций показана на рис.4 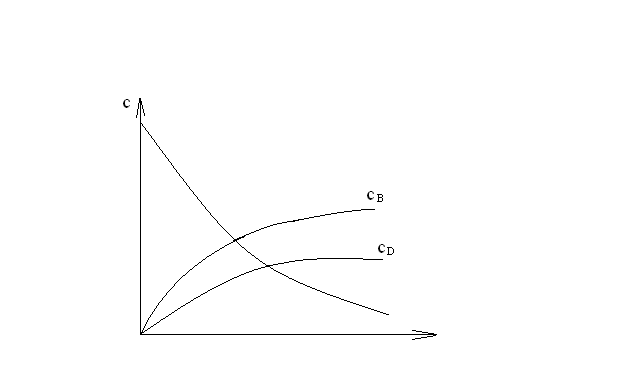 τ τРис.4 Обратимые (двусторонние) реакции. Понятие обратимая реакция следует отличать от термодинамического понятия обратимый процесс, который характеризуется бесконечно малым различием скоростей прямого и обратного процессов и, следовательно, бесконечно малой скоростью результирующего процесса. Двухсторонняя химическая реакция обратима в термодинамическом смысле только в непосредственной близости к состоянию химического равновесия. В состоянии же, далеком от равновесия, когда скорости прямого и обратного процессов существенно различны и суммарная скорость реакции значительно отличается от нуля, она термодинамически не обратима. Поэтому область применения понятия двусторонняя реакция шире, чем термодинамическое понятие обратимая реакция. Более подробно кинетические особенности обратимой реакции рассмотрим на примере: к1 А ↔ В к2  Предположим, что в системе присутствует, только вещество А. Тогда выражение для скорости реакции через закон действующих масс принимает вид: 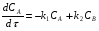 , где , где 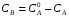 После преобразования приходим к следующему выражению: 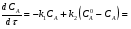 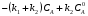 В состоянии равновесия: 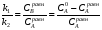 Из этого равенства находим 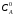 : : 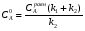 Подставим найденное значение 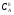 в выражение для скорости обратимой реакции: в выражение для скорости обратимой реакции: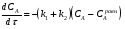 Разделим переменные: - 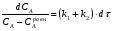 После интегрирования получим: 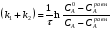 Кинетические кривые обратимых процессов представлены на рис.5 и 6. 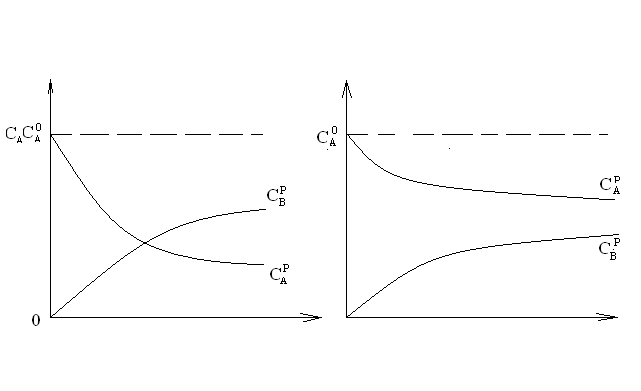 Рис.5 Рис.6 Рис.5. Кинетическая кривая реакции А↔В с большой константой равновесия. Рис.6. Кинетическая кривая для обратимой реакции А↔В с малой константой равновесия. Сопряженные реакции. Так называются две реакции, одна из которых будучи самопроизвольной, вызывает протекание в этой же системе второй химической реакции, неосуществимой в отсутствие первой. Явление, лежащее в основе сопряженных реакций, называется химической индукцией. Особенностью сопряженных реакций является то, что обе реакции должны быть сложными, т.к. элементарная реакция не может быть индуцирована другой реакцией, и протекают они через общие активные промежуточные вещества. Большинство биохимических процессов в организме осуществляется в результате сопряжения с процессом метаболического окисления глюкозы. Поэтому говорят, что глюкоза является источником, обеспечивающим жизнедеятельность организма. Одним из основных результатов окисления глюкозы в организме является сопряженный с этим процессом синтез аденозинтрифосфата (АТФ) из аденозиндифосфата (АДФ) и фосфата (Ф): АДФ+Ф=АТФ+ 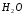 ; ; 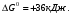 Синтезированная АТФ участвует затем в многообразных сопряженных реакциях метаболизма, обеспечивая протекание термодинамических невыгодных процессов. |
