Роберт Вильгельм Бунзен
 Скачать 2.24 Mb. Скачать 2.24 Mb.
|
|
Фотохимические реакции. Это особый класс сложных реакций, идущих под воздействием света. Все фотохимические процессы подчиняются закону Гроттуса: Химическое превращение вещества может быть вызвано только тем светом, который этим веществом поглощается. Отраженные веществом лучи, а также прошедшие сквозь него, не вызывают никаких химических превращений. Количественно фотохимический процесс выражается уравнением: m= к W τ, где m - масса прореагировавшего вещества; W- мощность света; τ- время; к- коэффициент пропорциональности, который соответствует массе вещества, приходящейся на единицу поглощенной световой энергии. Это уравнение справедливо только для первичных фотохимических реакций. Рассмотрим механизм фотохимической реакции: 1-я стадия- образование фотовозбужденных молекул А + hν→A  , где , гдеА- молекула в исходном состоянии; А  - молекула реагента, поглотившая квант света с энергией - молекула реагента, поглотившая квант света с энергией 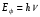 . .Возбужденные молекулы распадаются или вступают в реакции с другими реагентами, образуя радикалы или ионы Х1 и Х2: A  + В→X1+X2 + В→X1+X2Эта реакция называется первичной. Активные частицы (ионы или радикалы) вступают во вторичные реакции, в которых образуются конечные продукты: X1+B →С X2+B →D Между количеством лучистой энергии, поглощенной частицами вещества и количеством, фотохимически прореагировавших частиц, существует соотношение, выражающее закон фотохимической эквивалентности Эйнштейна: Число частиц, подвергшихся первичному фотохимическому превращению равно числу поглощенных ими квантов света. Для суждения о том, применим ли к данной фотохимической реакции закон эквивалентности Эйнштейна, пользуются понятием о квантовом выходе реакции: Квантовым выходом γ называется отношение числа N частиц, претерпевших химическое превращение, к числу поглощенных квантов: 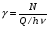 Q- энергия поглощенного излучения. Квантовый выход не для всех фотохимических реакций равен единице. Он может быть больше или меньше единицы. Значение больше единицы объясняется тем, что вслед за собственно фотохимической реакцией происходят вторичные реакции, в результате чего на один поглощенный фотон приходится не одна, а несколько молекул продукта реакции. Например: 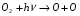 - первичная реакция. - первичная реакция.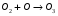 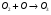 Один квант вызывает превращение трех молекул кислорода. Причиной значения γ < 1 является наличие примесей, которые поглощают фотоны. В некоторых случаях пониженный квантовый выход объясняется обратимостью химической реакции. К фотохимическим реакциям относятся фотосинтез, зрительный процесс, образование загара кожи. Цепные реакции. При образовании хлороводорода квантовый выход очень велик и составляет 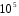 , в связи с этим М.Боденштейн предложил цепной механизм подобных реакций, при котором фотохимическая реакция только начинает цепь и в дальнейшем не играет никакой роли. Например, , в связи с этим М.Боденштейн предложил цепной механизм подобных реакций, при котором фотохимическая реакция только начинает цепь и в дальнейшем не играет никакой роли. Например,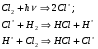 и т.д. Зарождение цепи реакций происходит не только под влиянием света, но и под действием радиоактивного излучения, введение свободных атомов. Например, введение паров Na инициирует смесь H2 и Cl2 Na + Cl  →NaCl+Cl →NaCl+Cl Из сказанного следует, что первая стадия цепных реакций может быть вызвана самыми различными способами. Вторая стадия- рост цепи- может носить простой и разветвленный характер. Взаимодействие H2 и Cl2 является примером простой цепной реакции. В реакциях с разветвленной цепью на каждый исчезающий активный центр, возникает несколько новых. Схематично это можно представить следующим образом:  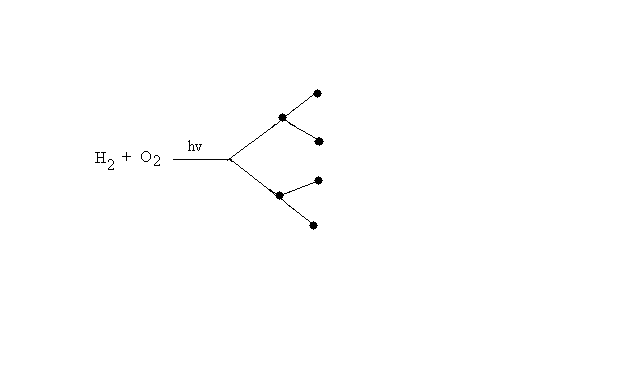 Многие реакции, протекающие в организме под действием ферментов, носят цепной характер. Рассмотрим перекисное окисление липидов. 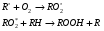 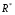 - органический радикал; - органический радикал;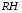 - липид; - липид;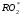 - пероксидный радикал; - пероксидный радикал;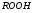 - органический пероксид. - органический пероксид.Третья стадия представляет собой процесс гибели активных частиц. Явление обрыва цепи было рассмотрено в опытах Н.Н.Семенова. Причины обрыва цепи : - добавление инертного газа; - взаимодействие активных частиц со стенками сосудов; - образование неустойчивых соединений типа HO2, соответствующего тетраокисям металлов NaO2, KO2; Отличительные черты цепных реакций. - большой квантовый выход; - высокая чувствительность к примесям; - зависимость скорости от формы и размеров реакционных сосудов; Основы количественной теории цепных реакций. Введем необходимые обозначения: n 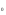 - число центров, возникающих за одну секунду во всем объеме реакционного сосуда; - число центров, возникающих за одну секунду во всем объеме реакционного сосуда;τ- время жизни активного центра; α- вероятность жизни центра; β- вероятность гибели центра; t- время, за которое появляется «n» центров; Очевидно, что, ά + β= 1. Скорость увеличения числа n определяется уравнением: 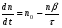 После интегрирования получаем: n= 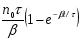  Графическая зависимость n=f(t) представлена на рис.7 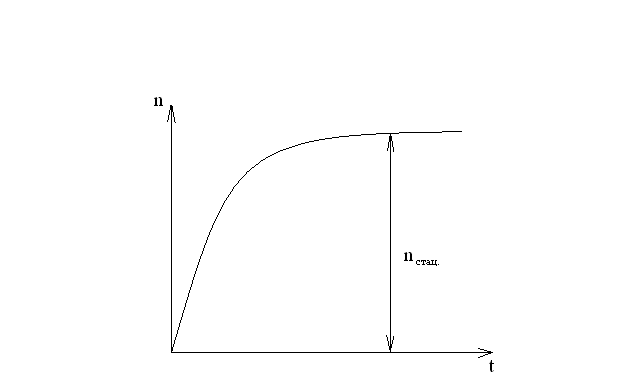 Рис.7 При 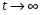 возникает стационарное состояние, при котором: возникает стационарное состояние, при котором:nстац.= n   При стационарном состоянии число возникающих центров равно числу гибнущих центров. При этом скорость процесса определяется соотношением: 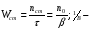 длинна цепи. длинна цепи.В случае разветвленных цепей активный центр, входя в реакцию, воссоздается в виде двух, трех или более новых центров, поэтому необходимо учитывать вероятность разветвления (δ). Скорость увеличения числа возникающих центров (n) с учетом разветвления цепи, определяется соотношением: 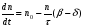 Интегрируя, получаем: n= 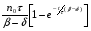 Проанализируем это уравнение для частных случаев. При β > δ (t→ 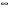 ) процесс принимает стационарный характер со скоростью: ) процесс принимает стационарный характер со скоростью: W 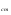 = =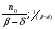 имеет смысл длинны цепи. имеет смысл длинны цепи.При δ > β скорость неограниченно увеличивается со временем; изменим знаки: n= 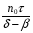 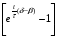 Отсюда следует, что при t→  число центров n→ число центров n→ , т.е. с течением времени оно неограниченно увеличиваются по экспоненте и реакция принимает взрывной характер (рис.8). , т.е. с течением времени оно неограниченно увеличиваются по экспоненте и реакция принимает взрывной характер (рис.8).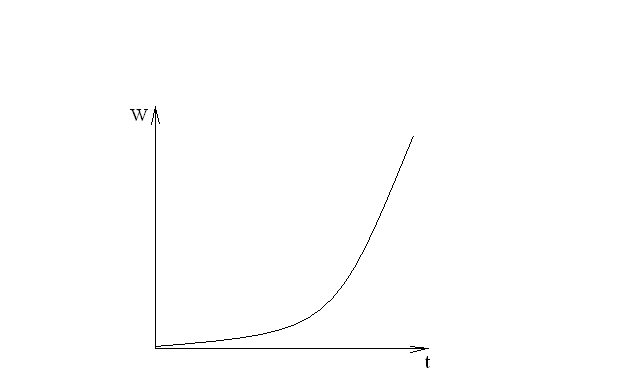 Рис.8 Рис.8Из рисунка видно, что в начале процесс не развивается. Это индукционный период. Количество продуктов очень мало. Граница перехода стационарного течения реакции к взрыву определяется δ = β. Величина β может быть изменена условиями реакции, например уменьшением давления. ГЕТЕРОГЕННЫЕ РЕАКЦИИ Они протекают в системе, состоящей из нескольких фаз(Г-Т;Г-Ж;Ж-Т) В этом случае реакция протекает на поверхности двух фаз. Как правило, любая гетерогенная реакция состоит по меньшей мере из трех стадий: 1. Перенос реагирующих веществ к поверхности раздела фаз. 2. Собственно химическая реакция 3. Отвод продуктов реакции из зоны, где эта реакция протекает. Опыт показывает, что суммарная скорость гетерогенного процесса определяется скоростью наиболее медленной стадией. Если же скорости отдельных стадий сравнимы между собой, суммарная скорость гетерогенной реакции необязательно должна быть равна скорости самой медленной стадии т. к. все стадии взаимно связаны между собой. Стадии, протекающие, более быстро могут оказывать влияние и на скорость самой медленной из них. Скорость гетерогенной реакции прямопропорциональна степени дисперсности реагирующих веществ. Также скорость гетерогенных реакций находится в прямой зависимости от скорости диффузии, т.е. от скорости с которой молекулы газа или растворенного вещества поступают к зоне реакции. Рассмотрим один из простейших случаев, когда скорость реакции на поверхности равна скорости диффузии. Скорость диффузионного потока определяется первым законом Фика: 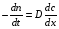 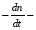 количество вещества проходящее через данное сечение, знак минус берется, потому что диффузия проходит против градиента концентрации; количество вещества проходящее через данное сечение, знак минус берется, потому что диффузия проходит против градиента концентрации;D- коэффициент диффузии; 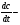 градиент концентрации по оси X. градиент концентрации по оси X.Обозначим концентрацию реагирующего вещества через 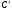 , тогда скорость реакции на поверхности будет: W= , тогда скорость реакции на поверхности будет: W=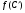 или -D или -D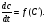 Заменим выражение: 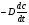 более простым приближенным β rС: более простым приближенным β rС: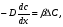 где гдеβ- константа скорости диффузии, пропорциональная коэффициенту диффузии, площадь сечения / время. rС- конечная разность концентраций rС=С- 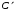  Скорость химической реакции протекающей на поверхности и имеющей первый порядок, будет W= 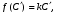 ,где ,гдек- кинетическая константа скорости. Если скорость диффузии равна скорости химической реакции, то получим: β(С- 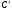 )=к )=к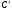 Откуда 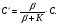 Для скорости реакции имеем: 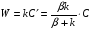 Т.о., мы выразили скорость реакции на поверхности через концентрацию вещества в объеме. Это выражение справедливо для реакции первого порядка. Обозначая отношение 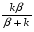 через к* , получим через к* , получим 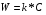 k*- связана с истинной константой химической реакции на поверхности и скоростью диффузии соотношением: 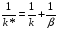 Если скорость химической реакции значительно больше скорости диффузии, т.е. k>> β, то 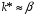 и W=βC. и W=βC.Следовательно, общая скорость реакции определяется скоростью диффузии. Можно сказать, что гетерогенная химическая реакция протекает в диффузионной области. Если скорость химической реакции значительно меньше скорости диффузии (к << β), то k* ≈ kи W=кС. Общая скорость реакции вновь определяется скоростью наиболее медленной стадии, т. е. скоростью химической реакции. Это кинетическая область гетерогенной реакции. Когда к и β сравнимы друг с другом, наблюдается переходная область. ТЕМПЕРАТУРНАЯ ЗАВИСИМОСТЬ КОНСТАНТЫ СКОРОСТИ РЕАКЦИИ. Наглядные представления о зависимости скорости химической реакции от температуры дает правило Вант – Гоффа, согласно которому при повышении температуры на 10 градусов скорость химической реакции увеличивается в 2-4 раза. Это правило первоначально было установлено для реакций, протекающих в растворах при невысоких температурах, и связано с понятием температурного коэффициента скорости реакции γ, определяемого соотношением: 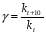 Количественная зависимость константы скорости реакции от температуры была впервые предложена Вант - Гоффом в 1827г., который, основываясь на изменении константы равновесия с температурой, указал, что подобные соотношение должно сохраняться и для константы скорости реакции. Эта идея была развита Аррениусом, который успешно применил ее к рассмотрению большого числа реакций, поэтому следующее уравнение называют уравнением Аррениуса: 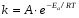 , где , где Еа – аррениусовская, т.е. экспериментальная энергия активации. А – предэкспоненциальный множитель Величины Еа и А важнейшие характеристики химической реакции. Вант – Гофф, используя уравнение, объяснил, почему наблюдающаяся зависимость имеет такой вид. Напишем уравнение изохоры реакции, которое показывает зависимость константы равновесия от температуры при 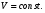 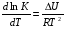 , где , гдеК – константа равновесия: 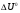 - тепловой эффект реакции при V=const. - тепловой эффект реакции при V=const.Как известно для обратимой реакции: k1 А+В ↔С+D, k2 идущей в газообразной фазе или в разбавленном растворе константа равновесия равна: 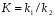 Запишем тепловой эффект как разность: 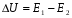 , тогда уравнение изохоры примет вид: , тогда уравнение изохоры примет вид: 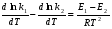 Последнее соотношение можно разбить на два уравнения: 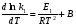 и и 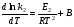 , где , где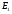 и и 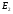 имеют размерность энергии. имеют размерность энергии. В - вличина, имеющая одинаковое значение для прямой и обратной реакции, В=О на основании опытных данных. Тогда для каждой из реакций можно записать: 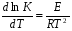 Так как все взаимодействия идут через стадию образования активных частиц, характеризующихся определенным значением энергии, постоянным для каждой реакции, можно заменить в уравнении Е на величину Еа и перейти к интегральной форме: 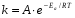 Для объяснения физического смысла величины 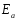 Аррениус предположил, что в реакцию способны вступать не все частицы, а лишь те из них, которые находятся в активированном состоянии. Аррениус предположил, что в реакцию способны вступать не все частицы, а лишь те из них, которые находятся в активированном состоянии.Молекулы в активированном состоянии возбуждении за счет избытка энергии и не устойчивы, а в нормальном - стабильны. Между нормальными и активированными молекулами существует равновесие. Доля частиц в возбужденном состоянии относительно мала. Число же частиц в нормальном состоянии практически равно общему числу частиц. Поскольку процесс активации эндотермический, то константа равновесия для этого процесса растет с увеличением температуры. Поэтому возрастает концентрация частиц в активированном состоянии и скорость реакции. Энергию 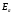 можно определить как тепловой эффект процесса активации. можно определить как тепловой эффект процесса активации.Энергия активации – это та энергия, которую должны накопить нормальные молекулы, чтобы иметь возможность прореагировать. МЕТОДЫ РАСЧЕТА ЭНЕРГИИ АКТИВАЦИИ И ПРЕДЭКСПОНЕНЦИАЛЬНОГО МНОЖИТЕЛЯ А. Для расчета энергии активации 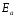 по экспериментальным данным используют уравнение Аррениуса в логарифмическом виде: по экспериментальным данным используют уравнение Аррениуса в логарифмическом виде: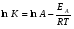 Следовательно, lnK линейно зависит от обратной абсолютной температуры (рис.9). ![]]]]]](19496_html_54383047.png) Рис.9 Значение 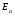 находят по тангенсу угла наклона: находят по тангенсу угла наклона: 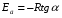 Предэкспоненциальный множитель (А) определяется отрезком, отсекаемым продолжением прямой на оси ординат при 1/Т=0. Энергию активации можно определить путем измерения скорости реакции при двух различных температурах: 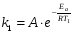 и и 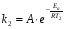 Делая ряд преобразований, получаем: 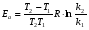 Есть и третий вариант определения 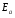 . Для этого необходимо опытным путем установить количество активных молекул и воспользоваться уравнением Аррениуса в следующем виде: . Для этого необходимо опытным путем установить количество активных молекул и воспользоваться уравнением Аррениуса в следующем виде:Z 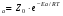 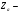 количество активных молекул; количество активных молекул;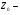 общее число молекул. общее число молекул.Чаще пользуются вторым методом. |
