Роберт Вильгельм Бунзен
 Скачать 2.24 Mb. Скачать 2.24 Mb.
|
|
Задача №4 Написать химическую реакцию, протекающую в данном гальваническом элементе в стандартных условиях: Pt/H+,MnO4- ,Mn2+ //Co3+,Co2+ /Pt. Решение: В таблице стандартных потенциалов находим потенциалы электродных реакций: MnO4- +8H+ + 5ē → Mn2+ +4H2O φ° = 1,51B, Co3+ + ē → Co2+ φ° = 1,81B. Следовательно на левом электроде будет происходить окисление Mn2+, а на правом – восстановление Co3+ . Тогда протекающая в элементе реакция запишется следующим образом: 5 Co3+ + Mn2+ +4H2O = 5Co2+ +8H+ + MnO4- Задание 4. Написать химическую реакцию, протекающую в указанном гальваническом элементе и рассчитать его ЭДС в стандартных условиях.
Задача 5. Рассчитать активность ионов кобальта, если при температуре 298К ЭДС гальванического элемента Co/CoSO4//H+/H2,Pt составляет 0,25В. Решение: В гальваническом элементе протекает реакция: 2H+ + Co → H2 +Co2+. Кобальтовый электрод является отрицательным, а водородный – положительным. Тогда ЭДС гальванического элемента: E = φ°+ - φ- φ - = φ°+ - E φ°+ = 0 φ- = -E φ(Co2+/Co) = -E = -0,25B RT φ(Co2+/Co) = φ°(Co2+/Co) + ln(aCo2+) zF Решая данное уравнение относительно aCo2+,получаем: aCo2+ = 8,268 Задание№5 Рассчитать активности ионов металла в растворе, если известны потенциалы электродов.
Задача 6: Рассчитать произведение растворимости хлорида меди при Т = 298 К, если стандартный потенциал электрода Cl-/CuCl/Cu φ0Cl-/CuCl/Cu = 0,137В, а стандартный потенциал медного электрода φ0Cu2+/Cu =0,521 В. Решение: На электроде протекает реакция: CuCl + ē → Cu + Cl- Стандартный потенциал электрода второго рода: RT φ = φ0 Cu+/Cu + ln(aCu2+) zF ПР = aCu+ · aCl-, aCu+ = ПР/ aCl-, RT RT φ = φ0 Cu+/Cu + ln·ПР - ·ln(aCl-), zF zF или RT φ = φ0Сl-/CuCl/Cu - ·ln(aCl-), zF RT φ0Сl-/CuCl/Cu = φ0Сu+/Cu + ·lnПР. zF Из последнего соотношения выражаем значение ПР и подставляем числовые значения: lnПР = -14,94, ПР = 3,19 · 10-7 Задание 6. Рассчитать ПР соединений, если известны потенциалы электродов второго рода.
Приложение Таблица 1 Стандартные электродные потенциалы в водных растворах при 250С
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ. Лабораторная работа №1. Измерение ЭДС гальванических элементов. Цель работы:
Прежде чем приступить к выполнению работы по определению ЭДС гальванических элементов, необходимо сдать допуск и получить задание у преподавателя, а именно: ЭДС каких элементов следует измерить. Например, требуется измерить ЭДС цинк –медного элемента при различных концентрациях ZnSO4 (c1) и CuSO4 (c2) Порядок выполнения работы. Записать элемент в строку. Для этого по таблице стандартных потенциалов (см. приложение) определить знаки электродов в гальваническом элементе: e0Zn2+|Zn = -0,763B; e0Cu2+|Cu = 0,337B. Так как цинковый электрод отрицательный, а медный – положительный, то в соответствии с Международной конвенцией гальванический элемент следует записать следующим образом: Zn|ZnSO4||CuSO4|Cu C1 C2 Приготовить электроды. Для этого медную и цинковую пластинки зачистить мелкой наждачной бумагой. При зачистке электродов употреблять индивидуальную наждачную бумагу. Промыть электроды дистиллированной водой, затем соответствующим для металла раствором электролита. Погрузить электроды в специальные сосуды с соответствующими растворами требуемой концентрации. Обмыть концы электролитического мостика дистиллированной водой и ввести в электродные сосуды специальные патрубки (рис.1). 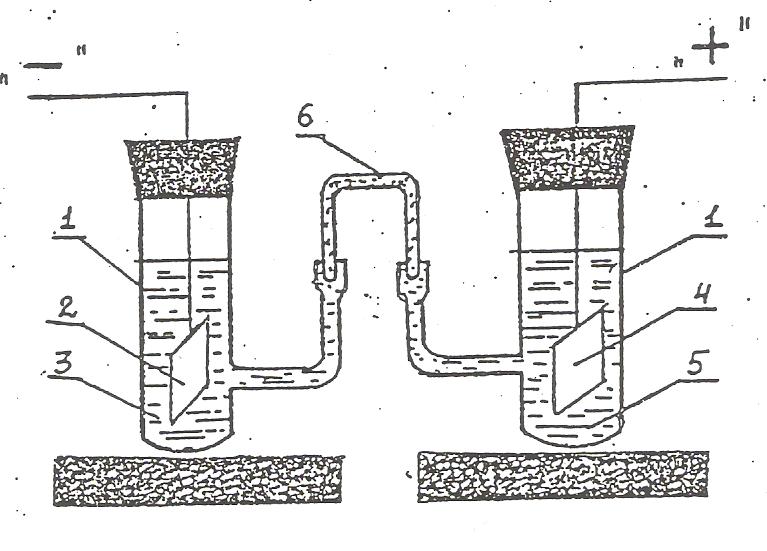 Рис.1 Схема гальванического элемента.
Подключить зажимы от цифрового вольтметра к соответствующим электродам и измерить ЭДС. Если на цифровом табло высветится отрицательное значение ЭДС, необходимо зажимы у электродов поменять местами. Занести измеренное значение ЭДС в таблицу 1. Рассчитать теоретическое значение ЭДС воспользовавшись уравнением Нернста.
или, подставив значения R( 8,31 Дж/моль·К ) и коэффициент пересчёта от натурального к десятичному логарифму (2,3), уравнением.
При небольших концентрациях (с ≈ 0,001 моль/л) можно считать, что aZn2+(Cu2+) ≈ c Zn2+(Cu2+) Если концентрация велика – больше 0,01 моль/л, необходимо рассчитать среднюю ионную активность электролита a+ = γ+· c+ ,где γ+ - средний ионный коэффициент активности (см. приложение). c+ - cредняя ионная концентрация, она связана с молярной соотношением c+ = c(ν+ν+ · ν-ν-)1/ν ,где ν+,ν- - число катионов, анионов, на которое распадается молекула электролита; ν - общее число ионов. Для сульфата меди и цинка ν+ = ν__ = 1 Значит, с+ = с и а+ = γ+ · с Подобным образом измеряют и рассчитывают ЭДС других элементов. Полученные данные заносят в таблицу 1. Таблица 1.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
