Роберт Вильгельм Бунзен
 Скачать 2.24 Mb. Скачать 2.24 Mb.
|
|
резкое снижение и даже отсутствие кислотности в желудочном содержимом (при некоторых болезнях желудка, различных стрессах, в том числе перегревании, психическом переутомлении); характер пищи; особенно «неблагоприятна» в этом отношении белковая пища, являющаяся мощным буфером; привычка запивать пищу водой, особенно минеральными щелочными водами (типа «Боржоми»), которые «разводят» желудочный сок и даже нейтрализуют его. Наиболее благоприятны для длительного выживания и размножения холерных вибрионов водоемы с высокой степенью фекального загрязнения, воды которых более щелочные. Имеют значения и структуры почв водоемов. Болезнетворное действие холерных микробов состоит в нарушении активного переноса ионов Na+ в клетках слизистой оболочки кишечника. Вследствие этого резко замедляется или выключается реадсорбция натрия (из полости кишки в кровь), нарушается изотония и происходят стремительные потери ионов Na+, К+, НСОз -, Сl- Вслед за этим в просвет кишечника устремляется вода - до 1 л. в час. Самые тяжелые и опасные для жизни явления при холере обусловлены развитием некомпенсированного метаболического ацидоза и обезвоживания. Больные погибают, когда сдвиги водно-электролитного и кислотно-щелочного равновесия достигают несовместимых с жизнью степеней, которые невозможно преодолеть современными лекарствами. Все перечисленное об условиях, способствующих развитию холеры, в большой степени справедливо и для других острых кишечных инфекций, в частности дизентерии. Чтобы изучение названной темы не было однобоким, необходимо сделать акцент на значении буферных систем для аналитической практики. Некоторые реакции протекают в строго определенном диапазоне рН, который и обеспечивают буферные системы. Способность буферных систем стойко удерживать на определенном уровне концентрацию ионов водорода является ограниченной и оценивается буферной емкостью. Величину, характеризующую способность буферного раствора противодействовать смещению реакции среды при добавлении кислот или щелочей, называют буферной емкостью раствора. Буферная емкость В измеряется количеством кислоты или щелочи (моль-или моль эквивалента), добавление которого к 1л. буферного раствора изменяет рН на единицу. Математически буферная емкость определяется следующим образом: 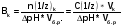 - буферная емкость по кислоте - буферная емкость по кислоте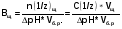 - буферная емкость по щелочи - буферная емкость по щелочи Vk, Vщ - объемы добавленной кислоты или щелочи; n(l/z)k, n(l/z)щ - количество моль-эквивалента кислоты или щелочи; С(1/z)k, C(l/z)щ - молярные концентрации эквивалента кислоты или щелочи; Vб.р. - объем буферного раствора; (ΔрН) - разность рН по модулю. Наибольшей буферной емкостью обладают концентрированные буферные растворы. Из буферных растворов с равной концентрацией наибольшей емкостью обладают те, которые составлены из равного количества компонентов, т.е. соотношение С(кислота) / С(соли) должно быть равно единице. Изменение рН ацетатной буферной смеси в зависимости от соотношения кислоты соли при добавлении НСl или NaOH показаны в таблице 4. Таблица 4.
ЗАДАЧИ И ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ Задача №1. Вычислите концентрацию ионов гидроксила (OH- ) в моче при pH=6 Решение: pOH+pH=14 Отсюда pOH=-lg a(OH- ) 8=-lg a(OH-) -8 a(OH-) = антилогарифм(-8)=10 Задание 1 Вычислите концентрацию ионов гидроксила в биологических объектах при указанных значениях pH
Задача №2. Рассчитайте pH ацетатной буферной смеси, состоящей из 100 мл 0,1моль/л CH3COOH и 200 мл 0,2 моль/л CH3COONa, pKCH3COOH=4,76. Решение: Для расчётов воспользуемся уравнением Гендерсона-Гассельбаха: С(1/zCH3COONa)*V(CH3COONa) pH=pKCH3COOH + lg ; C(1/zCH3COOH)*V(CH3COOH) pH=4,76+lg 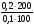 =4,76+lg4=4,76+0,6021=5,3621 =4,76+lg4=4,76+0,6021=5,3621Задание 2. Рассчитайте pH буферных смесей при заданных условиях и определите в каких пределах изменяется их pH.
Задача №3. Вычислите соотношение концентрации CH3COONa и CH3COOH в буферном растворе с pH, равным 5,8. Решение: В соответствии с уравнением Гендерсона-Гассельбаха: pH=pK(к)+lg 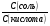 . .Отсюда lg 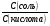 =pH-pK(к)=5,8-4,8=1,0 =pH-pK(к)=5,8-4,8=1,0Тогда 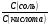 =антилогарифм(1,0)=10 =антилогарифм(1,0)=10Задание 3. Рассчитайте соотношение концентраций компонентов буферных систем для указанных значений pH.
Задача №4. К 100 мл крови для изменения pH от 7,36 до 7,0 надо добавить 36 мл 0,005 м раствора HCl. Математически буферная ёмкость определяется следующим образом. Буферная ёмкость по кислоте (моль/л): Вк.= 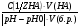 ; ;Буферная ёмкость по щёлочи(моль/л): Вщ.= 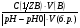 ; ;V(HA),V(B)-объёмы добавленных кислоты HA или щёлочи B соответственно л; C(1/zHA), C(1/zB)-молярные концентрации соответственно эквивалента кислоты и щёлочи. V(б.р.)-объём буферного раствора, л. pH0, pH-значение pH буферного раствора до и после добавления кислоты или щёлочи. Задание 4. Рассчитайте буферную ёмкость по кислоте Вк буферных систем крови.
Рассчитайте буферную ёмкость по щёлочи Вщ буферных систем крови.
Для проверки своих результатов воспользуйтесь литературными данными.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ Цель работы:
Работа №1. ПРИГОТОВЛЕНИЕ БУФЕРНЫХ РАСТВОРОВ ОПЫТ №1. Приготовить 20мл 0,1 М ацетатного буфера с заданным значением pH (задание даёт преподаватель) из 0,1 М раствора CH3COONa. Константа диссоциации уксусной кислоты при данной ионной силе равна 3×10-5 ОПЫТ №2. Приготовить 20 мл 0,02 М фосфатного буфера с заданным значением pH из 0,02 М раствора Na2HPO4 и 0,02 М раствора NaH2PO4. Kд (H2PO4-) -при данной ионной силе равна 1,6×10-7. Проверить pH приготовленных буферных растворов при помощи индикаторной бумаги или при помощи pH-метра. В отчете должен быть проведён подробный расчёт соотношения объёмов компонентов данной буферной смеси и описан метод определения pH. Буферные растворы полученные в данной работе не выливать, а проделать с ними  работу №2. работу №2.Работа №2 СВОЙСТВА БУФЕРНЫХ РАСТВОРОВ. ОПЫТ №1. Влияние разбавления на pH буферных растворов. В один стакан налить 10 мл, в другой -1 мл одного из буферных растворов(например, ацетатного), приготовленного в работе №1.Раствор в первом стакане развести в 2 раза, а во втором – в 100 раз. При помощи индикатора определить pH разведенных буферных растворов и сравнить с исходным значением pH. Для этого следует налить в пробирки по 2 мл исходного и разведенного буферных растворов и добавить по 2 капли соответствующего индикатора. Сравнить цвет индикатора в исходном буферном растворе и в разведенных растворах. В отчёте следует привести данные о наблюдаемых явлениях. Дать им объяснения. Опыт №2. Зависимость буферной емкости ацетатных буферных смесей от буферного соотношения. К пяти ацетатным буферным системам с различными соотношениями соли и кислоты добавляют одинаковое количество сильного основания или сильной кислоты, измеряют pH и вычисляют их буферную ёмкость. В пять стаканчиков налить 20 мл приготовленных буферных смесей с буферным соотношением: 100; 10; 1; 0,1; 0,01. Измерить pH исходных буферных систем при помощи pH-метра (после каждого измерения pH электроды должны быть тщательно вымыты). Измеренное значение pH исходных смесей несколько отличается от рассчитанного, так как в этих системах  aH+ aH+  cH+. cH+.Во все буферные смеси добавить по 2 мл 0,1M NaOH, тщательно перемешать и снова измерить pH. Налить в стаканчики такое же количество буферных систем и при перемешивании добавить в каждый по 2 мл 0,1M HCl. Измерить pH систем после добавления кислоты. Рассчитать в каждом отдельном случае буферную ёмкость по кислоте и основанию: Bk=  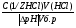 : :Bщ= 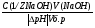 Полученные данные занести в таблицу 1 по образцу: Таблица №1
Построить на основании полученных данных график зависимости буферной ёмкости по кислоте и основанию от соотношения количества соли и кислоты в буферной смеси. На ось абсцисс нанести логарифм соотношения соль/кислота, а на ось ординат –B. Ось ординат удобно проводить в пересечении с точкой абсциссы, где lg 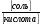 =0 и pH=pK. =0 и pH=pK.Кривые, относящиеся к буферной ёмкости по кислоте и основанию, начертить в цвете. В отчете объяснить ход кривых зависимости буферной ёмкости по кислоте и основанию от соотношения количества соли и кислоты в системе и объяснить, почему ход кривых различный. РАБОТА №3. ОПРЕДЕЛЕНИЕ БУФЕРНОЙ ЁМКОСТИ. Опыт №1. Определение буферной ёмкости объемным методом. В одну колбочку наливают 10 мл ацетатного буферного раствора с pH равным 5, в другую 10 мл 0,00001M раствора HCl, pH которого равен 5, и прибавляют по 3 капли индикатора метилового красного. Затем растворы осторожно титруют 0,1 М раствором NaOH (или KOH) до момента появления лимонно-желтой окраски(pH=6,3), и вычисляют буферную ёмкость по известной нам формуле (см. выше). Работа №4. Колориметрический (буферный) метод определения pH. Данный метод определения pH основан на сравнении окраски индикатора в растворе с неизвестным и известным значением pH. Для колориметрического метода определения pH требуется ряд растворов с известным значением pH (эталоны). В качестве эталонов приготавливают буферные смеси с разными количественными соотношениями соли и кислоты; pH буферных смесей рассчитывают по формуле: C(1/Zсоли)×Vсоли pH=pK+ lg C(1/Zкислоты)×Vкислоты В качестве эталонов можно приготовить буферные смеси с различными значениями pH(табл.2). Таблица 2.
Ряд эталонов (в пяти пробирках) готовятся из растворов одинаковой концентрации, объёмные соотношения которых указанны в таблице 3 Таблица 3.
При объёмных соотношениях, указанных в таблице 3, pH ацетатной буферной системы меняется от 4 до 6, фосфатной - от 6 до 8. Получив раствор с неизвестным значением pH, прежде всего следует решить какую из смесей необходимо выбрать в качестве эталона. Для этого по индикаторной бумаге нужно определить приблизительное значение pH. Если, например, оказывается, что pH исследуемого раствора около 5, то для более точного определения pH готовят буферный ряд из ацетатной буферной смеси. Если же pH исследуемого раствора около 7, то готовят эталоны из фосфатной смеси. После расчета pH и приготовления всех пяти эталонов выбирают индикатор, область перехода которого должна приблизительно совпадать с pH исследуемого раствора (см. табл. 4) Таблица 4.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 pH
pH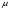 =0,1
=0,1