Роберт Вильгельм Бунзен
 Скачать 2.24 Mb. Скачать 2.24 Mb.
|
|
МЕХАНИЗМ ДЕЙСТВИЯ БУФЕРНЫХ СИСТЕМ Если в организм вводится условно сильная кислота, например, соляная, то при попадании ее в кровь будет происходить реакция нейтрализации с участием бикарбонатов металлов: NaHCО3 + НСl = NaCI + Н2СО3 (1) Как видно из уравнения (1) сильная кислота (НСl) заменяется эквивалентным количеством слабой кислоты (Н2СО3). В соответствии с законом Оствальда повышение концентрации угольной кислоты понижает, и так небольшую (0,011%), степень ее диссоциации. В результате этого концентрация поступающих в кровь извне, ионов Н+ не достигает значительных величин. При введении в организм другого «агрессора», например, сильного основания (NaOH), концентрация водородных ионов и рН изменится также незначительно. Щелочь при этом будет реагировать с другим компонентом буфера (Н2СО3) по реакции нейтрализации: Н 2СО 3 + NaOH = NaHCО3 + Н2О (2) В результате этого добавленная щелочь заменяется эквивалентным количеством слабоосновной соли, в меньшей степени влияющей на реакцию среды. Анионы HCО3-,образующиеся при диссоциации этой соли, будут оказывать некоторое угнетающее действие на диссоциацию угольной кислоты. В процессе этой реакции расходуется угольная кислота, и можно было ожидать значительное снижение содержания ионов Н+. Однако, активная кислотность смеси почти не изменяется, т к вместо прореагировавших ионов кислоты (Н + и НСО3-) за счет потенциальной кислотности образуются новые ионы Н + и НСО3-. Для врача наиболее ценным являются сведения о количественной характеристике всех буферных систем и особенно бикарбонатной. Расчетное уравнение рН крови по бикарбонатному буферу можно получить из уравнения Гендерсона - Гассельбаха, вывод которого представлен ниже. рН буферных систем Согласно закону действующих масс константа диссоциации угольной кислоты будет: 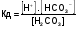 (2) (2)откуда 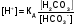 (3) (3)Слабая диссоциация угольной кислоты еще в большей степени подавляется при добавлении хорошо диссоциирующей соли (NaHCO3). Практически концентрация недиссоциированных молекул H2CO3 может быть принята равной общей концентрации кислоты. Так как, соль полностью диссоциирует, можно принять общую концентрацию аниона равной концентрации соли в буферном растворе. Исходя из этого уравнение (3) можно представить в следующем виде: 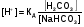 (4) (4)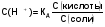 (4) (4)Логарифмируя уравнение (4) с обратным знаком, получаем основное расчетное уравнение теории буферных растворов - уравнение Гендерсона - Гассельбаха: рН = -lgК – lg 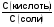 или илирН = рК -lg 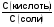 Для основного буфера, каким является, например, аммиачный, соответственно будет: рН = рК -lg 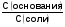 рН = 14 - рК + lg 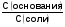 Из приведенных уравнений видно, что рН буферных смесей зависит от константы диссоциации кислоты или основания и от соотношения концентраций компонентов буферных смесей. Анализ этого уравнения показывает, что рН крови 7,4 по бикарбонатному буферу возможно при соотношении бикарбонатов (NaHCО3) и угольной кислоты (Н2СО3) равном 20. Такое соотношение и соблюдается в крови человека. Так как расчетное значение рН крови по бикарбонатному буферу (7,39) совпадает с экспериментальным (7,4), то, следовательно, величина рН крови может определяться, в основном, бикарбонатной буферной системой. Влияние изменения объема буферных систем на рН. Объем жидкостей в организме не является строго постоянным. Употребление сухой пищи, потение, потеря жидкости при некоторых заболеваниях (понос) сопровождается уменьшением объема внутренних жидкостей. Наоборот, усиленное употребление жидкостей (любители чая, пива), сочных плодов (арбуз, дыня) сопровождаются увеличением объема. Однако, буферные системы организма сохраняют при этих колебаниях объема жидкостей величину рН на неизменном уровне, так как при увеличении или уменьшении разведения концентрация обоих компонентов изменяется одинаково и их соотношение, от которого зависит рН, остается прежним. КИСЛОТНО-ЩЕЛОЧНОЕ РАВНОВЕСИЕ КРОВИ Характерной особенностью буферных систем крови является меньшая способность противостоять сдвигу реакции в щелочную сторону, чем для сдвига ее в кислую сторону. Известно, что для сдвига реакции крови в щелочную сторону необходимо прибавить в кровь в 40-70 раз больше NaOH, чем к Н2О. В то время, как для сдвига реакции крови в кислую сторону необходимо прибавить в 327 раз больше НСl, чем к тому же объему Н2O. Этот факт указывает, что в крови имеется некоторое количество щелочных солей слабых кислот, которые вступая во взаимодействие с НСl, затрудняют сдвиг реакции в кислую сторону. Сумма солей щелочных металлов слабых кислот, содержащихся в крови, определяет ее щелочной резерв. Величину щелочного резерва крови характеризуют тем количеством миллилитров СО2, которое может быть связано 100мл крови при давлении СО2, равном 40 мм рт. ст., т.е. примерно, соответствующее обычному давлению углекислого газа в альвеолярном воздухе. Так как в крови имеется определенное и довольно постоянное отношение между щелочными и кислотными эквивалентами, то в биохимии и физиологии говорят о кислотно-щелочном равновесии. Но несмотря на достаточно четкое действие буферных систем при сохранении щелочного резерва и рН крови, этим системам присущи определенные недостатки. Так, буферные системы безупречно действуют лишь до тех пор, пока количество их компонентов превышает количество образуемых в организме или поступающих извне кисло- или щелочнореагирующих продуктов. Другой недостаток заключается в том, что продукты реакции нейтрализации, образующиеся за счет действия буферных систем, сами по себе обладают хотя и слабыми, но все же кислотными или основными свойствами. Поэтому по мере их накопления в организме соответственно будут меняться и рН среды крови и других жидкостей. Процесс накапливания в крови кислореагирующих продуктов или изменение рН крови в сторону уменьшения носит название ацидоза, наоборот, накапливание в крови продуктов щелочного характера или смещение рН в сторону увеличения от нормы (7,4) носит название алкалоза. В поддержании рН крови и ее щелочного резерва в организме, кроме буферных систем, активное участие принимают и некоторые внутренние органы. РОЛЬ ВНУТРЕННИХ ОРГАНОВ В ПОДДЕРЖАНИИ КИСЛОТНО-ЩЕЛОЧНОГО РЕЗЕРВА. Чтобы показать комплексное взаимодействие физико-химических и физиологических систем в регулировании рН крови и поддержании кислотно-щелочного равновесия, приводиться простейшая схема роли легких и почек в этом важном для организма процессе. ЛЕГКИЕ. При воздействии кислот, как было сказано выше, в организме в результате функции бикарбонатной буферной системы накапливается угольная кислота, являясь нестойкой, она разрушается и превращается в свободный углекислый газ СО2 и воду. Углекислый газ физиологически является раздражителем дыхательного центра, накопление СО2 вызывает усиленное дыхание, что приводит к так называемой гипервентиляции и углекислый газ выводится из организма через легкие. Накопление в организме щелочнореагирующих веществ приводит к уменьшению содержания угольной кислоты, стимуляция дыхательного центра уменьшается, что приводит к задержанию углекислого газа в организме и восполнению запасов угольной кислоты, расходуемой при нейтрализации щелочнореагирующих продуктов. Так схематически выглядит механизм регуляции кислотно-щелочного равновесия с помощью легких в норме. ПОЧКИ. Моча здорового человека имеет слабокислую реакцию. Кислая реакция мочи обусловлена преобладанием в ней однозамещенных фосфорнокислых солей над двузамещенными. В норме рН мочи колеблется от 4,7 до 6,5. Крайние пределы рН мочи при нарушении кислотно-щелочного равновесия колеблются от 4,5 до 8,5. Зависит рН мочи также и от состава пищи. При преобладании в пище мясных продуктов рН мочи сдвигается в кислую сторону, так как в мясе содержится много кислых эквивалентов - соединений серы и фосфора, которые выделяются с мочой в виде сульфатов и фосфатов. При преобладании в моче растительных продуктов рН мочи сдвигается в сторону более высоких значений, что связано с повышенным содержанием в растительной пище солей органических кислот, анионы которых окисляются в тканях, а щелочные эквиваленты выделяются с мочой. Для характеристики активной реакции мочи пользуются величиной буферной емкости мочи в единицах титрационной кислотности или щелочности. Титрационной_ кислотностью называется количество 0,1н раствора NaOH, необходимого для титрования по фенолфталеину суточного количества мочи. Для здорового человека эта величина составляет 200-400 мл. Можно буферную емкость выражать в г-экв. сильной кислоты или сильного основания, которые необходимо добавить к 1л мочи, чтобы сместить рН на единицу. Для здорового человека в пересчете на суточное количество мочи эта величина равна 20-40 мг-экв. Полный механизм действия почек изучается студентами на старших курсах, здесь же рассматриваются только некоторые физико-химические аспекты этого вопроса. Поступивший в почки углекислый газ под воздействием фермента - карбоангидразы - превращается в угольную кислоту: СО2 + Н2О фермент Н2СО3 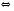 Н + + НСО3 - Н + + НСО3 -Возникающие по этой же схеме ионы водорода вступают во взаимодействие с компонентом (гидрофосфат-ионом), работающей в почках фосфатной буферной системы: НРО4-2 + Н + 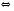 Н2РО4-1 Н2РО4-1И в виде однозамещенного фосфата натрия удаляются с мочой из организма. Моча при этом становится заметно кислой. В случаях, когда реакция сдвигается в щелочную сторону, работает одновременно бикарбонатная и фосфатная буферные системы: ОН- + Н2РО4- 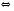 НРО4-2 +Н2О НРО4-2 +Н2ООН- + Н2СО3 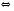 НСО3- + Н2О НСО3- + Н2ОВ результате чего происходит выделение с мочой значительных количеств бикарбонатов (NаНСО3) и гидрофосфатов (Na2HPО4) Моча в этом случае обладает щелочными свойствами и имеет повешенное значение рН. При сильно выраженных ацидозах, когда буферные системы не обеспечивают нейтрализацию повышенных концентраций ионов водорода, в действие вступает физиологическая функция почек. В почках начинается выработка дополнительного основания, а именно аммиака, который выступает в роли нейтрализующего агента кислых продуктов, накапливающихся в организме. В этом случае в моче обнаруживается повышенная концентрация аммонийных солей. Несомненно, что в поддержании кислотно-щелочного равновесия, кроме легких и почек, большую роль играют такие органы, как печень, желудочно-кишечный тракт, и др. В процессе обмена веществ образуются большие количества кислых продуктов. Так в организме человека в спокойном состоянии ежесуточно образуется 20-30л 1н сильной кислоты. Кроме рассмотренных буферных систем, в сохранении постоянства реакции среды организма участвует белковая и гемоглобиновая буферные системы Белковая буферная система состоит из протеина(Pt) и его соли, образованной сильным основанием. Компоненты этой системы могут быть выражены как PtСООН - слабодиссоциированная белок-кислота и ее соль PtCOONa: PtCOOH 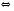 PtCOO - + Н + PtCOO - + Н +PtСOОNa 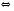 PtCOO - +Nа + PtCOO - +Nа +При увеличении концентрации ионов водорода соль белка будет реагировать с кислотами, образуя слабодиссоциируемую белок-кислоту и нейтральную соль. PtCOONa + HCl 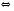 = PtCOOН + NaСl = PtCOOН + NaСlПри взаимодействии же со щелочами в реакцию вступает белок-кислота и вместо сильного основания образуется слабоосновная соль PtCOOН+ NaОН 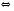 PtCOONa + H2O PtCOONa + H2OТаким образом, белковый буфер действует аналогично буферным смесям, рассмотренным ранее. Однако, белок обладает также свойством амфотерности, так как в состав молекул белка входят некоторые кислые и основные группировки. Поэтому даже отдельная белковая молекула проявляет буферное действие, связывая кислоты и щелочи с образованием солей:
Т.е. при добавлении сильной кислоты образуется слабокислая соль белка. При добавлении щелочи образуется слабоосновная соль по уравнению:
Благодаря белкам все клетки и ткани организма обладают определенным буферным действием. В связи с этим попадающее, например, на кожу человека небольшое количество кислоты или щелочи довольно быстро оказываются нейтрализованными. Буферные свойства гемоглобина по своему механизму действия идентичны белковым буферным системам: кислые продукты обмена веществ взаимодействуют с калиевой солью гемоглобина с образованием эквивалентного количества их калиевых солей и свободного гемоглобина, обладающего свойствами слабой органической кислоты. Кроме того, система оксигемоглобин-гемоглобин участвует еще в одном своеобразном механизме поддержания постоянства рН крови. Как известно, венозная кровь содержит большие количества углекислоты в виде бикарбонатов, а также CO2, связанный с гемоглобином. Через легкие углекислота выделяется в воздух; однако сдвига рН крови в щелочную сторону не происходит, так как образующийся оксигемоглобин является более сильной кислотой, чем гемоглобин. В тканях, в артериальной крови под влиянием низкого парциального давления кислорода оксигемоглобин диссоциирует и кислород диффундирует в ткани. Образующийся при этом гемоглобин, однако, не обуславливает изменение рН крови в щелочную сторону, так как в кровь из тканей поступает углекислота. ИЗМЕНЕНИЕ КИСЛОТНО-ЩЕЛОЧНОГО РАВНОВЕСИЯ ПРИ РАЗЛИЧНЫХ ЗАБОЛЕВАНИЯХ. При различных заболеваниях наблюдается сдвиг рН биологических сред. Как показывают исследования, отклонения рН в первую очередь отражаются на активности ферментов, нарушая нормальный ритм реакции в клетке. В последнее время выявлены нарушения кислотно-щелочного равновесия при различных сердечно-сосудистых заболеваниях. Показано, что при ишемической болезни сердца закономерным является возникновение ацидоза. Сдвиги рН в кислую область возникают у больных с обширной зоной повреждения сердца - крупноочаговым инфарктом миокарда. Одновременно наблюдается снижение концентрации ионов калия в плазме и эритроцитах. Перемещение ионов H+ в клетку приводит к снижению рН внутри клетки. Следовательно, при инфаркте миокарда с выраженным метаболическим ацидозом следует ожидать сдвига в щелочную область рН во внеклеточном пространстве, что наблюдается на практике. Для увеличения эффективности лечения необходимо возместить дефицит ионов К+ в миокарде и одновременно нейтрализовать ионы Н+ в плазме и в межклеточном пространстве. Это достигается введением растворов калия внутривенно. Сахарный диабет является тяжелым и распространенным заболеванием современного человечества. Нарушение кислотно-щелочного равновесия при сахарном диабете происходит из-за чрезмерного накопления ионов в межклеточной жидкости. Ионы К+ в клетке замещаются ионами Na+ и Н+.У больных, страдающих тяжелой формой сахарного диабета, наблюдается сдвиг рН в кислую область (ацидоз). У больных с легкой формой сахарного диабета отклонения рН от нормы, как правило, не наблюдается. Изучение кислотно-щелочного равновесия при диабете позволило установить некоторые закономерности между течением этого заболевания и изменением рН крови. Что в свою очередь позволяет проводить направленное лечение для устранения этих нарушений. Изменение кислотно-щелочного состояния широко изучается при заболеваниях органов пищеварения. При болезнях желудка часто возникают нарушения в кислотно-щелочном равновесии, главным образом по механизму ацидоза. Исследования смещения кислотно-щелочного равновесия при заболеваниях печени (цирроз печени и т.д.) показали на смещение рН в щелочную область (рН от 7,3 до 7,6) Кислотно-щелочное равновесие внутренних сред организма определяет в ряде случаев восприимчивость организмов к инфекционным заболеваниям. Особенно показателен в этом отношении пример с холерой. Возбудители холеры - холерные вибрионы - относяться к группе «щелочнолюбивых» микробов (галофилов). Оптимум рН для их размножения 7,6-9,2. Кислоты, даже при разведении 1 : 10 000, губительны для вибрионов, иными словами, холерный вибрион обладает исключительной чувствительностью к кислотам. Как известно, заражение холерой происходит обычно при употреблении воды, содержащей холерные вибрионы, Человек с кислотообразующей функцией желудка практически не может заразится холерой, даже находясь в очаге инфекции. Развитию холеры способствуют следующие факторы: |
