РАСПРЕДЕЛЕНИЕ РАСТВОРЯЕМОГО ВЕЩЕСТВА МЕЖДУ ДВУМЯ ЖИДКИМИ ФАЗАМИ. ЭКСТРАКЦИЯ.
Если к системе из двух взаимно нерастворимых или ограниченно растворимых жидкостей добавлять третью жидкость, способную в них растворяться, то добавляемая жидкость будет распределятся между обеими жидкими фазами в соответствии с законом распределения Нернста-Шилова:
третий компонент, добавляемый к системе, состоящий из двух взаимно нерастворимых или ограниченно растворимых жидкостей, распределяется между обеими жидкими слоями в определенном, постоянном при данной температуре отношении:
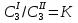 , ,
где К - коэффициент распределения.
При распределении третьего вещества между двумя несмешивающимися жидкостями возможен случай, когда степень диссоциации распределяющегося вещества в разных растворителях отличается. В этих случаях закон распределения имеет вид:
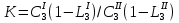 ; ;
LI, LII - степень диссоциации или ассоциации распределяемого вещества в I и II фазах.
Коэффициент распределения, таким образом, зависит от температуры, природы всех веществ, входящих в систему, и от степени диссоциации или ассоциации третьего компонента, но не зависит от концентрации распределяемого вещества. Закон распределения широко используется при экстрагировании вещества из раствора.
Экстракцией называют процесс извлечения вещества, растворенного в одном растворителе, другим растворителем (экстрагентом), который не смешивается с первым и лучше растворяет извлекаемое вещество.
Экстракцию широко применяют в фармации для извлечения из растительного сырья эфирных масел, алколоидов и других физиологически активных веществ. Экстракция бывает однократной и. дробной. При однократной - экстрагент добавляется в один прием, при дробной - добавление экстрагента проводится порциями в несколько приемов, причем, чем больше число последовательных стадий извлечения, тем больше полнота извлечения при одном и том же количестве взятого экстрагента. После n экстрагирований в исходном растворе остается mnkп растворенного вещества:
mo - начальное количество экстрагируемого вещества;
V, - объем раствора в котором находится экстрагируемое вещество;
V2 - объем растворителя, употребляемый на одно экстрагирование;
n - общее количество операций экстрагирования.
Для оценки степени извлечения сравнивают массу извлеченного вещества от теоретически возможной
mэ - экспериментально найденная масса извлеченного вещества при экстракции.
ВОПРОСЫ ДЛЯ ПОДГОТОВКИ К ЗАНЯТИЯМ ПО ТЕМЕ: "ТЕРМОДИНАМИКА ФАЗОВЫХ РАВНОВЕСИЙ".
Основные понятия и определения: фаза, составляющие вещества, компоненты, число компонентов и число степеней свободы.
Правило фаз Гиббса. Прогнозирование фазовых переходов при изменении условий.
Диаграммы состояния однокомпонентных систем (вода, сера, углекислый газ).
Уравнение Клапейрона-Клаузиуса. Связь с принципом ЛеШателье.
Термический анализ. Вид кривых охлаждения и построение диаграммы плавкости 2-х компонентной системы с простой эвтетикой.
Анализ диаграмм плавкости:
а) с простой эвтетикой;
б) с образованием химических соединений;
в) с неограниченной растворимостью в твердом состоянии.
Применение правил фаз Гиббса и рычага к диаграммам плавкости. Определение состава лекарственной смеси по диаграмме плавкости.
Анализ диаграмм растворимости ограниченно растворимых жидкостей:
а) с верхней критической температурой растворения;
б) с нижней критической температурой растворения;
в) с замкнутой областью расслоения.
9. Трехкомпонентные системы. Способы изображения состава.
Закон распределения веществ между двумя несмешивающимися жидкостями. Коэффициент распределения.
Теоретические основы экстрагирования. Применение экстрагирования в медицине.
ПРИМЕРЫ РЕШЕНИЯ ТИПОВЫХ ЗАДАЧ.
Карбид кальция получают по уравнению:
СаО(т) + ЗС → СаС2(т) + С02(г)
При 1600°С СаС2 и СаО взаимно растворяются, образуя расплав. Определить фазовый состав и число степеней свободы этой системы до 1600°С и выше этой температуры.
Решение:
До 1600°С система состоит из четырех составляющих веществ. В состоянии равновесия эти вещества связаны одним уравнением Кр=Рсо2, то число компонентов равно 3. Число фаз равно 4. Число степеней свободы С=К-Ф+2=3-4+2=1.
При температуре выше 1600°С СаС2 и СаО образуют расплав, в этих условиях будет 3 фазы и С = 3-3+2 = 2.
При какой температуре кипит вода в автоклаве при давлении 2 атм? Теплота испарения воды 40,7 кДж/моль.
Решение:
По уравнению Клапейрона-Клаузиуса
lg P2/P1=∆H/2,3 R *(1/T1-1/T2);
lg 2/1 = 40700/2,3*8,31 (1/37,3 - 1/Т2);
Т2=390,8 К или 117,8°С
Построить диаграмму плавкости системы парафин- метилстеарат с одной эвтектикой по следующим данным: tпл.парафина = 34°С, tплметилстеората=45°С, tE=25°С, состав эвтектики: 60% парафина.
а) определить, что представляет собой система из 10% метилстеарата и 90% парафина, какое вещество кристаллизуется первым?
б) при какой температуре закончится кристаллизация системы? Чему равен состав последних ее капель ?
в) построить кривую охлаждения сплава (а).
г) каков фазовый качественный и количественный состав сплава состава (в), если общая масса системы 3 кг.
Решение:
1) Построим диаграмму состояния системы (П-парафин, М-метилметилстеарат).
2) Расставим фазы на диаграмме;
3) В жидкой области отмечаем сплав (а) состава
10%М + 90%П, проследим ход его кристаллизации: при понижении температуры расплав охлаждается до линии ликвидус. При температуре соответствующей точке a1, выпадут первые кристаллы компонента П, при дальнейшем понижении температуры до а2 из сплава будет кристаллизоваться П, остающаяся жидкость при этом обогащается компонентом М и ее состав изменяется по линии ликвидус к точке Е.
4) В точке а2 заканчивается кристаллизация сплава (а), состав последующих капель жидкости соответствует составу точки Е (эвтектики), т.е. 60% П + 40% М, в точке а2 происходит нонвариантный процесс
ЖЕ -> П + М
Ниже ta2 сплав будет твердым и содержать 2 фазы - кристаллы П и М.
5) Построим кривую охлаждения сплава (а) в соответствии с вышеизложенными рассуждениями. В точке a1 наблюдается излом кривой охлаждения, т.к.скорость охлаждения сплава в связи с кристаллизацией замедляется, а в точке а2 происходит нонвариантный процесс кристаллизации эвтектики, поэтому температура остается постоянной.
6) Сплав состава (в) находится в 2х фазном поле, содержащем кристаллы М и жидкость. Количественно определить их соотношение можно с помощью правила рычага.
mж / mM = bk / bl;
Измерим длину отрезков bk и bl на диаграмме: bk=l,l см: bl= 1 см. Учитывая, что вся масса сплава равна 3 кг, решаем уравнение: mж/(3-mж)=1,1 /1; mж=1,57кг, mм=1,43кг.
В 1 литре культуральной жидкости содержится 0,3 г пенициллина. Для экстракции берут 500 мл амилацетата. В каком случае извлечение будет более полным, если экстрагировать:
а) 1 раз 500мл амилацетата;
б) 5 раз порциями по 100 мл амилацетата. Величина К=С1Орг / С2Вод=25.
Решение:
Для решения воспользуемся формулой
'mn = m0(V1 / К*V2+V1)n
m0, mn- количество пенициллина в культуральной жидкости соответственно до и после экстрагирования;
n - число экстракций.
a)m = m0*(V1 / R*V2+V1) = 0,3*( 1 / 25*0,5+1) = 2,2*10-2 (Г)
б)m= m0*(V1 / K*V2/n+V1)n = 0,3*(1 / 25*0,5/5+1 )5 = 7,3*10-4 (Г)
Извлечение в случае "б" будет более полным, т.к. в культуральной жидкости останется меньшее количество пенициллина.
При распределении янтарной кислоты между водой и эфиром были получены следующие данные: концентрация кислоты (моль/дм3) в водном растворе 0,121 и 0,07, в эфире соответственно 0,22 и 0,0128.
Показать, что для янтарной кислоты и данных растворителей справедлив закон распределения в его простейшей форме.
Решение:
Кд=С1 вод / С2 орг;
1)К1д=0,121 /0,022=5,5;
2) К2д=0,07 / 0,0128=5,47; К1д
К2д.
Следовательно для данной системы закон распределения справедлив в простейшей его форме.
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ.
1.Определите число степеней свободы для системы, в которой происходит следующая реакция:
Na2S04 + 2 KCI= K2S04 + 2 NaCl,
в системе присутствуют пары воды и кристаллы КС1.
Ответ: С=2.
2. Вычислите теплоту испарения диэтилового эфира, если при нормальной температуре кипения (307,9 К) dр/dт=3,53*103 Па/К.
Ответ: 2,74* 104 Дж/моль.
3. Найдите молярную теплоту плавления дифениламина, если плавление сопровождается увеличением объема, равным 95,8 см3 /кг.
Изменение температуры плавления при изменении давлении в точке плавления (54°С) равно 0,027 град/Па. Молярная масса дифениламина равна 169,2г/моль.
4. Вычислите теплоту испарения лекарственного вещества в интервале температур 88 - 112 К, если давление при этих температурах 8*103 и 101* 103Па.
Ответ: 8,64 кДж/моль.
5. Вычислите молярную теплоту испарения жидкости, если при давлении 760 мм.рт.ст. она кипит при 69°С, а при 571 мм.рт.ст. - при 60 С.
Ответ:________.
6. По приведенной диаграмме:
а) определите состав химического соединения и расставьте фазы на фазовых полях.
б) определите составы и температуры плавления эвтектических сплавов.
в) нарисуйте кривую охлаждения смеси, содержащей 50% В и сделайте вывод о фазовых превращениях, происходящих в системе, укажите их температуры.
г) для сплава состава точки 3 рассчитайте количества равновесных фаз, учитывая, что масса всего сплава равна 1 кг.
д) определите состав жидкой фазы сплава в точке 3.
7. По приведенной диаграмме:
а) расставьте фазы на фазовых полях;
б) из отмеченных на диаграмме точек выберите критическую точку и точку, находящуюся в гомогенной области;
в) определите вариантность системы, в точках (1,4,5).
г) для точки 5 определите общий состав смеси и равновесных фаз, а так же их количество, если масса смеси равна 0,5 кг.
8. Сколько нужно провести экстракций, чтобы извлечь, йод на 99% из 4дм3 водного раствора концентрацией 0,1 г/дм3, если йод экстрагируется порциями сероуглерода по 100 мл. Величина Кд=59.
Ответ: 2 экстракции.
9. Сколько воды потребуется для извлечения уксусной кислоты из 500 мл 0,1М ее раствора в амиловом спирте, если ее концентрация в водном растворе должна быть доведена до 0,05 моль/л? Коэффициент распределения уксусной кислоты между амиловым спиртом и водой равен 0,914.
10. В бензоле пикриновая кислота находится в виде одинарных молекул С6Н2(NO2)3ОН и не диссоциирует на ионы. Равновесные концентрации С в водном и бензольном слое (моль/л):
Водный слой (с× 103)
|
2.08
|
3.27
|
7.01
|
10.1
|
Бензольный слой (с×103)
|
0.932
|
2.25.
|
10.1
|
19.9
|
Рассчитать К и показать, что, растворяясь в воде, пикриновая кислота диссоциирует на ионы.
Ответ:
ЛАБОРАТОРНАЯ РАБОТА 1:
ПОСТРОЕНИЕ ДИАГРАММЫ ПЛАВКОСТИ 2-Х КОМПОНЕНТНОЙ СИСТЕМЫ С ПРОСТОЙ ЭВТЕКТИКОЙ.
ЦЕЛЬ РАБОТЫ:
Снять кривые охлаждения чистых компонентов и их смесей.
По кривым охлаждения построить диаграмму плавкости системы в координатах температура - состав.
НЕОБХОДИМЫЕ РЕАКТИВЫ И ОБОРУДОВАНИЕ.
Изучаемые вещества (по выбору преподавателя), Сухие пробирки, пробки с отверстиями для мешалки и термометра, термометр на 150-200 С. водяная или масляная баня, мешалки.
ПОСЛЕДОВАТЕЛЬНОСТЬ ВЫПОЛНЕНИЯ РАБОТЫ.
В несколько пробирок насыпают чистые вещества и их смеси (число и состав смесей указывается преподавателем). Масса каждой смеси должна быть равна 5 г. Каждую пробирку закрывают пробкой, в отверстия которой вставлен термо�метр со шкалой на 150-200°С и мешалка, затем пробирки по одной помещают в водяную или масляную баню, нагретую до необходимой температуры. После того, как содержимое пробирки расплавится и несколько перегреется, пробирку со смесью переносят в другую, более широкую пробирку (воздушная рубашка), и через каждые 15-30 сек (по секундомеру) записывают показания термометра. Измерение ведут при непрерывном перемешивании охлаждаемого вещества. После появления первых кристаллов перемешивание прекращают.
Для чистых веществ наблюдение за температурой прекращают после темпе�ратурной остановки. Для смесей наблюдение прекращают после отвердевания эвтектики (во всех случаях рекомендуется после застывания всей массы произ�вести отсчет температуры еще 3-4 раза). Результаты измерения температуры записывают в таблицу.
Время от начала опыта, мин
|
Температура cмеси, 0С
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
|
|
|
|
|
|
|
На основании полученных данных строят кривые охлаждения, по которым определяют температуру начала кристаллизации, эвтектическую температуру. Эти результаты вместе с данными о составе, выраженными в весовых процентах записываются в таблицу.
Номер смеси
|
Состав смеси в %
|
Температура начала кристаллизации
|
Температура отвердевания эвтектики,°С
|
А
|
В
|
|
|
|
|
|
|
|
|
|
|
По полученным результатам строят диаграмму плоскости в координатах температура - состав.
ЛАБОРАТОРНАЯ РАБОТА № 2.
ИЗУЧЕНИЕ ВЗАИМНОЙ РАСТВОРИМОСТИ ФЕНОЛА И ВОДЫ.
ЦЕЛЬ РАБОТЫ:
Определить температуры осветления (гомогенизации системы) и помутнения (появления второй жидкой фазы) для ряда смесей фенол - вода.
Построить диаграмму взаимной растворимости в координатах температу�ра-состав.
Определить критическую температуру растворения.
НЕОБХОДИМЫЕ РЕАКТИВЫ И ОБОРУДОВАНИЕ:
Фенол кристаллический, дистиллированная вода, аптечные весы, термометр на 100С,водяная баня (колба с водой), набор ампул, электрическая плитка.
ПОСЛЕДОВАТЕЛЬНОСТЬ ВЫПОЛНЕНИЯ РАБОТЫ:
Готовят смеси фенола с водой следующих составов:
Фенол (%вес)
|
10
|
15
|
20
|
35
|
55
|
65
|
70
|
Вода (% вес)
|
90
|
85
|
80
|
65
|
45
|
35
|
30
|
Общее количество каждой смеси 4 грамма. Навески фенола, взятые на аптеч�ных весах, переносят в сухие пронумерованные ампулы, добавляют из бюретки воду и запаивают их или получают готовые у лаборанта.
Ампулы со смесями помешают поочередно в водяную баню с горячей (не до�водить до кипения) водой, в которую опущен термометр на 100 С и медленно нагревают со скоростью 5-6 град/10 мин., чтобы температура жидкости в ампу�лах соответствовала температуре бани.
2. При постоянном легком встряхивании пробирки, не извлекая ее из бани, визуально определить температуру, когда смесь становится гомогенной, прозрачной.
Определив температуру осветления, воду в бане медленно охладить при помешивании. (Для перемешивания воды в бане можно использовать каучуковую трубку, через которую вдувают воздух). Отметить температуру, при которой жидкость в ампуле снова мутнеет в результате появления первых капель новом фазы. Разница между температурами осветления и помутнения не должна пре�вышать 2-3°.
З. Опыт повторить 2-3 раза и рассчитать среднее значение, которое соответствует температуре взаимной растворимости обоих компонентов для данного состава. Результаты опыта занести в таблицу.
Номер ампулы
|
Состав смеси масс,%
|
Температура0, С
|
|
фенол
|
вода
|
осветленная
|
помутневшая
|
средняя
|
|
|
|
|
|
|
По полученным данным построить диаграмму растворимости на миллиметровой бумаге (1см - 10%, 1см - 5 ).По диаграмме определяют крити�ческую температуру растворения системы фенол-вода. |
 Скачать 2.24 Mb.
Скачать 2.24 Mb.
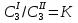 ,
,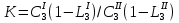 ;
;