Роберт Вильгельм Бунзен
 Скачать 2.24 Mb. Скачать 2.24 Mb.
|
|
Особые условия выполнения работы: 1.При работе с фенолом соблюдать осторожность, не допускать попадания его на кожу. При ожоге фенолом пораженное место промыть большим количе ством воды и смазать вазелином. 2.Смеси с фенолом в раковины не выливать, сливать в специальные банки, стоящие в вытяжном шкафу. ЛАБОРАТОРНАЯ РАБОТА № 3. ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА РАСПРЕДЕЛЕНИЯ УКСУСНОЙ КИСЛОТЫ МЕЖДУ ВОДОЙ И БЕНЗОЛОМ. ЦЕЛЬ РАБОТЫ:
НЕОБХОДИМЫЕ РЕАКТИВЫ И ОБОРУДОВАНИЕ: Бензол, растворы уксусной кислоты, гидроксида натрия, фенолфталеина, три склянки с притертыми пробками, бюретка, колбы для титрования, пипетки. ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ: Готовят по 25 мл 2М,1М,0,5М растворов уксусной кислоты. В три склянки с притертыми пробками наливают по 20 мл приготовленных растворов кислоты (по 5 мл оставляют для определения исходной концентрации приготовленных растворов) и добавляют в каждую по 20 мл бензола. Склянки со смесями сильно встряхивают в течение 10-15 минут и оставляют отстаиваться на 30 минут. Точную концентрацию исходных растворов кислоты определяют титрованием 0,1 М раствором NaOH с фенолфталеином. Для титрования берут по 1 мл рас твора кислоты, добавляют по 2-3 капли фенолфталеина и проводят два парал лельных определения. После экстрагирования определяют концентрацию уксусной кислоты, остав шейся в водном слое. Для этого отбирают пипеткой по 1 мл из нижнего водного слоя и титруют 0,1М раствором NaOH. При взятии пробы нужно следить, чтобы в пипетку не попал раствор из верхнего бензольного слоя: для этого закрывают пальцем верхнее отверстие пипетки, а среднюю часть пипетки нагревают рукой, помещают пипетку в нижний слой и производят отбор раствора. Титрование каждого раствора также проводят не менее 2 раз и для расчета берут средние значения. Данные записывают в таблицу.
Пример расчета: Пусть на титрование 1 мл исходного раствора кислоты пошло V1 мл 0,1М раствора NaOH, а 1 мл равновесного раствора - V2 мл. Так как объемы водного и бензольного слоев равны, то 1 мл бензольного раствора содержит количество кислоты, эквивалентное (V1-V2) мл щелочи. Равновесная концентрация водного раствора уксусной кислоты будет равна: C1= V2*0,l/1 (моль/дмЗ), Равновесная концентрация бензольного раствора кислоты: С = (V1-V2)0,l/1 (моль/дмЗ). Коэффициент распределения рассчитывают по формулам, учитывающим со стояние молекул третьего компонента в двух жидких фазах: а) К = С1/С2; б) К = С1/ √ С2; в) К=С12/С2. Коэффициент распределения обычно записывается как отношение концен трации третьего компонента в том растворителе, в котором он более растворим, к его концентрации в растворителе, в котором он растворим менее. а) распределяющееся вещество ни в одной из фаз не диссоциирует и не ассо циирует; б) распределяющееся вещество в первой фазе не ассоциирует, во второй фазе ассоциирует, образуя двойные молекулы; в) распределяющееся вещество диссоциирует в первой фазе на два иона, во второй фазе отсутствуют явления диссоциации и ассоциации; • Особые условия выполнения работы: 1. Тщательно производить отбор пробы из системы бензол-вода после экст рагирования, чтобы бензол не попал в водный слой... 2. Смеси, содержащие бензол, сливать в специальные банки в вытяжном шкафу. СВОЙСТВА РАЗБАВЛЕННЫХ РАСТВОРОВ ЭЛЕКТРОЛИТОВ И НЕЭЛЕКТРОЛИТОВ. Изучение темы «Осмотические свойства растворов» и криометрического метода анализа необходимо для объяснения механизма процессов гемолиза и плазмолиза, явления изоосмии, знание которых, в свою очередь, позволяет поддерживать жизнедеятельность организма и проводить экспериментальные исследования на выделенных из организма органах и тканях. Основные законы и понятия названной темы используются при изучении медико-биологических дисциплин и в практической деятельности врача при приготовлении гипотонических, гипертонических и изотонических растворов лекарственных веществ. Криометрический метод широко используется для определения молекулярной массы различных биологических жидкостей. Впервые молекулярная масса крови была определена этим методом. Криометрическим методом можно определить различные характеристики осмотических свойств растворов: осмотическую концентрацию, осмотическое давление и другие. Особенно важно то, что криометрический метод позволяет анализировать лекарственные препараты на суммарное содержание примесей и тем самым идентифицировать их как фармацевтически пригодные. Конечная цель работы:
Учебно-целевые задачи:
Физико-химические свойства растворов отличаются от чистых растворителей. В свою очередь, свойства разбавленных растворов, такие как осмотическое давление пара над растворителем, температура кипения, температура кристаллизации значительно отличаются от тех же свойств растворов более высокой концентрации. В разбавленных растворах относительная доля сольватированного растворителя невелика, образовании таких растворов сопровождается небольшими тепловыми эффектами, поэтому свойства их можно считать малозависящими от природы растворяемого вещества. Концентрированные растворы имеют свои закономерности, точно также как разный поход должен быть при изучении свойств растворов электролитов и неэлектролитов. Свойства растворов, которые не зависят от природы растворенного вещества, а определяются числом частиц в растворе называются коллигативными свойствами. К ним относят понижение давления насыщенного пара растворителя над раствором, повышение температуры кипения и понижение температуры замерзания раствора и явление осмоса. ПОНИЖЕНИЕ ДАВЛЕНИЯ НАСЫЩЕННОГО ПАРА РАСТВОРИТЕЛЯ НАД РАСТВОРОМ. Давление пара растворов ниже давления пара чистых растворителей при той же температуре. Понижение давления пара объясняется тем, что поверхность раствора частично занята сольватированными молекулами растворенного вещества, за счет чего уменьшается молярная доля самого растворителя, а следовательно и давление его насыщенного пара над раствором. Насыщенным называется пар, находящийся в равновесии с жидкостью или твердым телом. Согласно закону Рауля давление насыщенного пара растворителя над разбавленным раствором равно: РА=Р0АХА (1), где РА – давление насыщенного пара над раствором; Р0А – давление насыщенного пара над чистым растворителем; ХА – молярная доля растворителя в растворе. Для раствора, состоящего из двух компонентов А и В, сумма молярных долей равна ХА+ХВ=1 Следовательно, ХА=1-ХВ Подставив это выражение в (1), получают 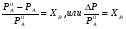 (2) (2)Выражение (2) называют второй формой закона Рауля: относительное понижение давления ( 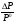 )насыщенного пара растворителя над разбавленным раствором нелетучего вещества равно молярной доле растворенного вещества. )насыщенного пара растворителя над разбавленным раствором нелетучего вещества равно молярной доле растворенного вещества.Молярная доля растворенного вещества определяется следующим соотношением: 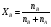 nB – число молей растворенного вещества, nA – число молей растворителя. При значительном разведении раствора, когда nA>>nB, можно пренебречь в знаменателе величиной nB и тогда 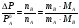 (2а) (2а)Уравнение (2а) можно использовать для определения молярной массы растворенного вещества. 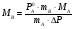 , где , гдеmA – масса растворителя mB – масса растворенного вещества MA – молярная масса растворителя MB – молярная масса растворенного вещества Растворы, подчиняющиеся закону Рауля, получили название идеальных растворов. Таких растворов очень мало, однако в разбавленных растворах отклонение от законов Рауля незначительны и ими можно пренебречь и считать такие растворы идеальными. Разность давления пара над раствором и растворителем невелика и неудобна для экспериментальных определений с большой точностью. Гораздо легче измерить другие величины, находящиеся в зависимости от понижения давления пара, как, например, изменение температуры кипения и замерзания раствора по сравнению с соответствующими величинами для чистого растворителя. ПОВЫШЕНИЕ ТЕМПЕРАТУРЫ КИПЕНИЯ РАСТВОРОВ. Кипение представляет собой фазовый переход, при котором происходит превращение жидкости в пар. Температурой кипения жидкости называют ту температуру, при которой давление насыщенного пара над данной жидкостью равна внешнему. При этой температуре и соответствующем ей давлении насыщенного пара устанавливается равновесие между жидкой и газообразной фазами: скорость испарения равна скорости обратного процесса – конденсации и обе эти фазы могут сосуществовать в течение длительного времени. 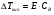 , где , гдеЕ – коэффициент пропорциональности, численно равный повышению температуры кипения раствора, содержащего 1 моль растворенного вещества в 1000г растворителя, при условии, что раствор этой концентрации обладает свойствами идеального. Такое повышение температуры кипения называется молярным или эбуллиоскопической постоянной. Величина Е зависит только от свойств растворителя и может быть найдена либо опытным путем, либо рассчитана по термодинамическому соотношению 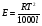 , где , где Т – температура кипения чистого растворителя по аб. шкале l – удельная теплота испарения растворителя R – универсальная газовая постоянная Св – концентрация раствора, выражаемая обычно в молях растворенного вещества на 1000 г растворителя. Если Мв – молярная масса растворенного вещества, mв – его масса (в г), а mА – масса растворителя в граммах, то Св будет определяться следующим соотношением 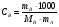 Рассмотрим зависимость давления пара растворителя над чистым растворителем (0А) и над разбавленными растворами разной концентрации нелетучего вещества (ВС и ДЕ) от температуры (рис.1) P 101,3 кПа А С Е 0 С' B Е'' D Ткип0 Т’кип T”кип Температуры, при которых изобара, равная атмосферному давлению (101,3 кПа), пересечет кривые 0А, ВС и ДЕ, будут температурами кипения соответствующих жидкостей при этом давлении. Для растворов эти температуры (Т’кип и T”кип) являются более высокими, чем для чистого растворителя (Ткип0) и разность между ними 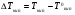 будет тем большей, чем выше концентрация раствора. Для бесконечно разбавленных растворов бесконечно малые участки кривых CC’, ЕЕ’ можно считать прямолинейным. Тогда из подобия треугольников АСС’, АЕЕ’ вытекает, что повышение температуры кипения пропорционально понижению давления насыщенного пара и, следовательно, повышение температуры кипения пропорционально концентрации. Определив опытным путем повышение температуры кипения раствора, можно вычислить молярную массу вещества 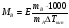 Этот метод определения молекулярных масс носит название эбуллиоскопического. ПОНИЖЕНИЕ ТЕМПЕРАТУРУ ЗАМЕРЗАНИЯ РАСТВОРОВ. Замерзание представляет собой фазовый переход, при котором происходит превращение жидкости в твердое вещество. Температурой замерзания 9кристаллизации) жидкости называют ту температуру, при которой давление насыщенного пара над жидкостью равно давлению насыщенного пара над выпадающими из нее кристаллами твердой фазы. При этой температуре и соответствующем ей давлении насыщенного пара скорость кристаллизации равна скорости плавления и обе эти фазы могут сосуществовать в течение длительного времени. Еще М.В. Ломоносов заметил, что разбавленный раствор замерзает при температуре более низкой, чем чистый растворитель. Так, морская вода замерзает не при 273 К, а при несколько более низкой температуре. Многочисленные эксперименты показали, что такое изменение температуры замерзания раствора можно рассматривать как общее правило. Процессы замерзания и кипения были детально изучены Раулем и представлены в виде закона, который в последствии был назван вторым законом Рауля. рассмотрим простейший вывод этого закона. На рис.2 показана диаграмма, выражающая зависимость давления насыщенног пара от температуры над чистым растворителем и над раствором. Р А С Е 0 рис. 2 B K D 273 Т T”з T’з Кривая 0А – зависимость давления насыщенного пара чистой воды от температуры. Кривая ВС, ДЕ – зависимость давления насыщенного пара воды над растворами с различными концентрациями растворенного вещества 0Д – выражает температурную зависимость давления насыщенного пара воды над льдом. Из рис.2 видно, что давление пара над раствором при 273 К ниже, чем над водой, но оно не равно давлению пара над льдом при той же температуре. Лишь при температуре ниже 273 К (Т’з) давление пара над раствором уменьшается настолько, что становится равным давлению пара над льдом. Этому соответствует точка В. При более высоких концентрациях раствора кривые, выражающие зависимость давления пара воды над раствором от температуры, располагаются ниже кривой ВС, но параллельно ей. Введем следующий обозначения: Р0А – давление пара над чистым растворителем при 273 К РА – давление пара над раствором при температуре его замерзания Т’з Далее из точки В параллельно оси абсцисс проведем линию до пересечения с перпендикуляром опущенным из точки 0. Пересечение этих прямых обозначим точкой К. Из прямоугольного треугольника ВОК определяем 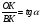 Из рисунка 2 видно, что 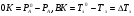 , где , где 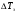 - понижение температуры замерзания раствора. - понижение температуры замерзания раствора.Подставляя эти значения в выше записанное уравнение, получим 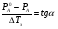 откуда 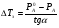 (3) (3)Из первого закона Рауля для сильно разбавленных растворов имеем 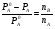 откуда 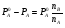 и и 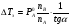 (4) (4)где nА, nВ, mА сохраняют ранее присвоенные обозначения (см. выше). Если через М0А обозначить молярную массу растворителя, то 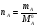 При подстановке этого выражения в уравнение (4) получим 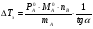 Умножим и разделим правую часть этого выражения на 1000, тогда 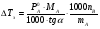 (5) (5)Объединим все постоянные величины в уравнении (5) в одну постоянную К ( 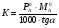 ), получим следующее выражение ), получим следующее выражение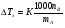 (6) (6)Выражение 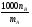 представляет собой моляльность раствора Св. представляет собой моляльность раствора Св.Подставив это выражение в уравнение (6), получим окончательное уравнение. 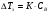 (7) (7) | |||||||||||||||||||||||||
