Роберт Вильгельм Бунзен
 Скачать 2.24 Mb. Скачать 2.24 Mb.
|
|
Лабораторная работа №2 ИЗМЕНЕНИЕ ПОТЕНЦИАЛОВ ОТДЕЛЬНЫХ ЭЛЕКТРОДОВ. Цель работы:
Порядок выполнения работы. В основе определения потенциалов электродов лежит измерение ЭДС гальванических элементов, состоящих из электродов, потенциалы которых нас интересуют, и электрода сравнения, например, хлорсеребряного (е0Cl-|AgCl|Ag = + 0,222B) . Для экспериментального определения электродных потенциалов составляют следующие гальванические элементы: Ag | AgCl | KCl || CuSO4 | Cu, С1 Zn | ZnSO4 || KCl | AgCl | Ag. С2 Хлорсеребряный электрод по отношению к медному является отрицательным, по отношению к цинковому – положительным. ЭДС составленных элементов (Ех) измеряют на установке, схема которой приведена на рис. 2. 1 – стеклянный сосуд с раствором и патрубком для соединения с другим электродом; 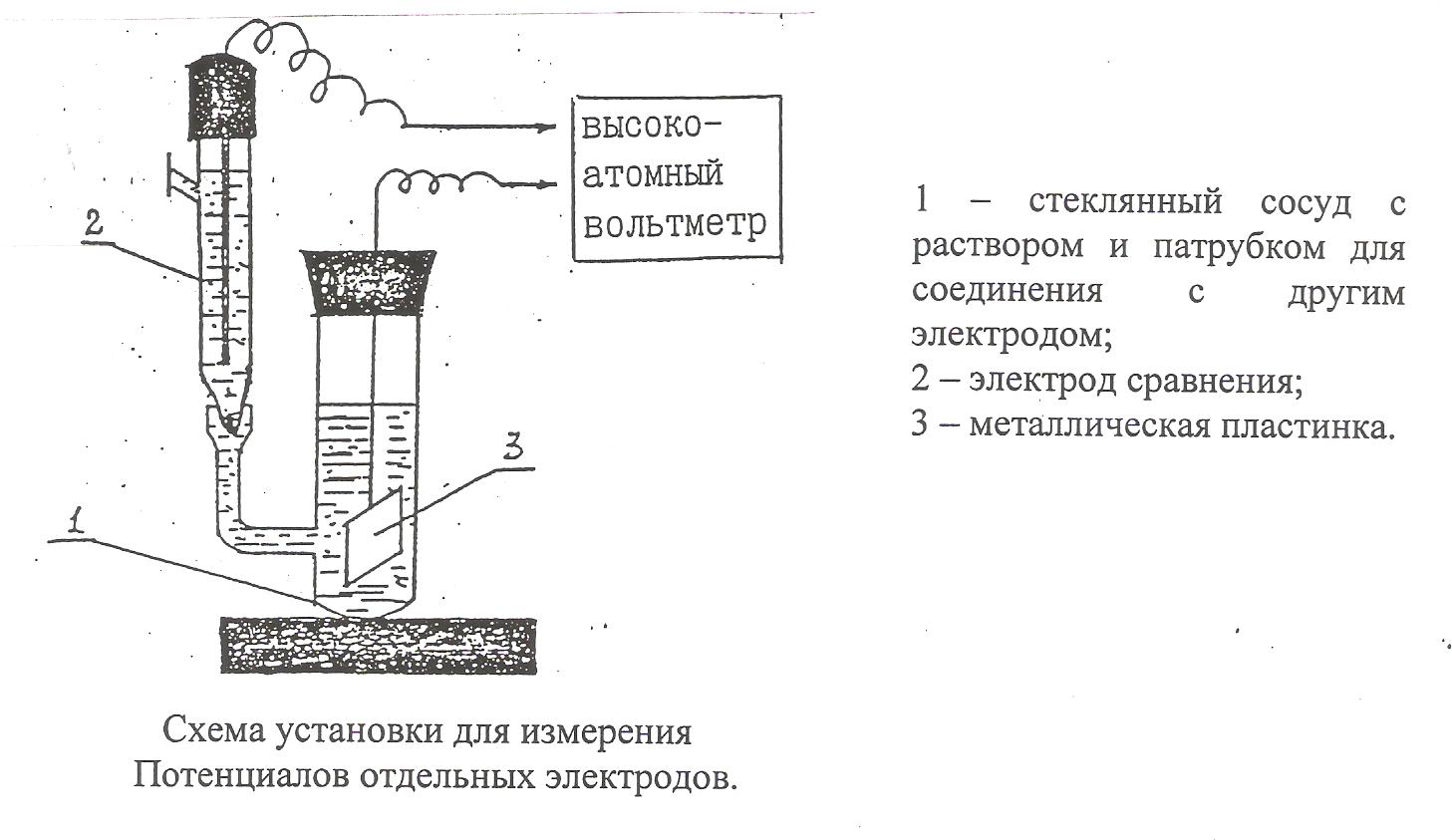 2 – электрод сравнения; 3 – металлическая пластинка. Схема установки для измерения Потенциалов отдельных электродов. Зная потенциал стандартного электрода Сl- | AgCl | Ag и измеренную ЭДС, вычисляют потенциал исследуемого электрода. Для цинк – хлорсеребряного элемента: Ех = eCl-|AgCl|Ag - eZn2+|Zn , Для хлорсеребряно – медного элемента: Ех = eCu2+|Cu - eCl-|AgCl|Ag . Откуда соответственно eZn2+|Zn = eCl-|AgCl |Ag – Ex , eCu2+|Cu = eCl-|AgCl |Ag + Ex . Для сопоставления потенциалы этих же электродов рассчитывают по уравнению Нернста: Т е = е0 + 2·10-4 · lnai z где аi – активность потенциалопределяющего катиона. Указанную последовательность определений выполняют, проводя опыты с растворами электролитов разных концентраций. Полученные результаты заносят в таблицу 2. Таблица 2.
Лабораторная работа № 3. ОПРЕДЕЛЕНИЕ КОНСТАНТЫ ДИССОЦИАЦИИ СЛАБОЙ КИСЛОТЫ ПОТЕНЦИОМЕТРИЧЕСКИМ ТИТРОВАНИЕМ Показатель константы диссоциации слабой кислоты находят по измерению рН раствора, в котором кислота на 50% нейтрализована основанием. Требуемое количество основания определяют при помощи потенциометрического титрования, сущность которого заключается в том, что конечную точку нейтрализации находят по резкому изменению потенциала индикаторного электрода. В качестве индикаторного электрода в данной работе берут стеклянный электрод. Электродом сравнения служит хлорсеребряный. Оборудование:потенциометр, мешалка, электролитическая ячейка. Реактивы: раствор уксусной кислоты, раствор гидроксида натрия 0,1 моль/л. Ход работы. В электролитическую ячейку наливают 20 мл раствора уксусной кислоты и титруют 0,1М раствором NaOH. Концентрация NaOH должна быть больше концентрации кислоты, чтобы не сильно разбавлять раствор кислоты. После добавления каждой порции щёлочи раствор помешивают и через 2-3 мин. при помощи потенциометра измеряют ЭДС. Измерения проводят по шкале «+мв». Сначала 2-3 раза добавляют 0,2 мл, а затем по 0,1 мл. NaOH до резкого скачка ЭДС. После скачка ЭДС приливают последовательно ещё 0,2; 0,3; 0,5 мл NaOH. Результаты титрования заносят в таблицу.
По полученным данным строят график. На ординате откладывают соотношение ∆Е/ΔV, а на абсциссе количество миллилитров, добавленной NaOH. Пик на кривой соответствует точке эквивалентности. Точку эквивалентности можно также найти, если после каждой порции NaOH измерить рН и построить график в координатах ΔрН/ΔV и V. Количество миллилитров NaOH, необходимое для полной нейтрализации данной порции кислоты, будет также соответствовать пику на кривой. Для определения константы диссоциации следует взять новую порцию такого же объема кислоты, нейтрализовать её половинным количеством NaOH и измерить рН полученного раствора. В отчёте должны быть приведены таблица результатов, график, расчёты константы диссоциации и исходной концентрации кислоты. Лабораторная работа №4. ПОТЕНЦИОМЕТРИЧЕСКОЕ ИЗМЕРЕНИЕ ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫХ ПОТЕНЦИАЛОВ. РЕДОКС – СИСТЕМЫ. Цель работы:
Для исследования редокс – системы и измерения её потенциала можно взять любую окислительно – восстановительную систему, титруемую в присутствии платиного индикаторного электрода, например, систему, состоящую из красной K3[Fe(CN)6] и жёлтой K4[Fe(CN)6] кровяных солей. В данной системе на определённом этапе устанавливается равновесие: [Fe(CN)6]3- +ē ↔ [Fe(CN)6]4- Пользуясь бюретками, налить в стаканчики на 50 мл 0,01М растворы указанных солей и 2М раствор хлористого калия в следующем соотношении:
В каждый из растворов погрузить электроды и произвести измерение ЭДС (в мв) , возникшую между платиновым и хлорсеребряным электродами. Используя полученные значения ЭДС, рассчитать редокс – потенциал данной системы для пяти составов электролита по формуле. е2 = Еr + ехл./с ,где еr – редокс – потенциал Еr – ЭДС редокс – хлорсеребряного электрода ехл./с - потенциал хлорсеребряного электрода , величина которого равна 0,201В при 250. Полученные данные занести в таблицу 3. Таблица 3.
Построить график зависимости редокс – потенциала от соотношения концентраций окисленной и восстановленной форм. Найти величину нормального редокс – потенциала данной системы по графику при условии С(окисл.) = С(восст.) Рассчитать величину редокс – потенциала для данной системы при всех пяти соотношениях, используя уравнение Петтерса: Т С(окисл.) еr = е0r + 2·10-4 · lg , где z С(восстан.) е0r - нормальный редокс – потенциал системы, равный 0,36 В. С(окисл.) – концентрация окисленной формы K3[Fe(CN)6]; С(восстан.) – концентрация восстановленной формы K4[Fe(CN)6] z – число электронов, которое приобретает одна молекула окисленной формы при переходе в восстановленную. По расчетным значениям также построить график зависимости в указанных координатах и сравнить две графические зависимости. КИНЕТИКА Учебно-целевые задачи:
ЗНАЧЕНИЕ ДЛЯ МЕДИЦИНЫ И ФАРМАЦИИ Достаточно привести цитату Д.В.С. Холдена, чтобы понять значимость изучаемого материала для медицины «Ключ к познанию ферментов лежит в изучении скоростей реакций, а не равновесий.» Действие лекарственных веществ обусловливается в значительной степени скоростью реакций ,проходящих в организме .При хранении лекарственных препаратов могут протекать различные реакции, скорость которых определяется сроком годности лекарств. Скорость химических процессов обычно увеличивается с ростом температуры, и это увеличение практически ничем не лимитируется, в то время как биологические процессы имеют температурные границы, за которыми наступает резкое уменьшение их скорости и даже полное прекращение - смерть. Знание законов кинетики позволяет управлять химическими процессами и продлевать жизнь. ВОПРОСЫ ДЛЯ ПОДГОТОВКИ К ЗАНЯТИЮ
(к1)  A → B (к2) A→C
(к1) А→В (к2) (к1> к2) А→С
22. Изобразите графически изменение концентрации со временем участников последовательной реакции (к1) (к2) А → В → С
ВВЕДЕНИЕ Учение о химических процессах состоит из двух частей: учения о состояниях - химическая термодинамика и учения переходах из одного состояния в другое – химическая кинетика. Первая отвечает на вопросы о принципиальной возможности протекания данной химической реакции в данных условиях и о конечном равновесном состоянии системы. Вторая – химическая кинетика – посвящена реализации этой принципиальной возможности. т.е. собственно протеканию процесса. Кинетика по способу реализации процесса делится на два раздела. В формальной кинетике сформулированы закономерности, позволяющие описывать химическую реакцию макроскопически на основе экспериментальных данных. Молекулярная кинетика изучает превращение на основе молекулярных данных о свойствах частиц. На первой стадии изучения реакции надо прежде всего определять скорость протекания изучаемой реакции. Далее изучить зависимость скорости реакции от концентрации реагирующих веществ, температуры и давления. Вещества вступающие в процесс химического превращения, называются исходными веществами или реагентами. Вещества, образующиеся в процессе химического превращения и не претерпевающие в ходе этого процесса дальнейших химических изменений, называются продуктами реакции. Вещества, образующиеся в одних стадиях процесса химического превращения и расходующиеся в других стадиях этого же процесса, называются промежуточными веществами, а реакции с участием промежуточных веществ называются промежуточными веществами. Химическая реакция, протекающая в пределах одной фазы, называется гомогенной химической реакцией. Химическая реакция ,протекающая на границе раздела фаз, называется гетерогенной химической реакцией. В гетерогенных реакциях роль промежуточных продуктов играют молекулы, химически адсорбированные на поверхности. Если реакция идет в одну стадию, то ее называют простой. Сложные реакции – это многостадийные процессы. Стадиями, в более широком смысле, могут быть не только химические, но также процессы диффузии, передачи энергии при столкновении молекул и др. Чаще реакции бывают сложными, и символизирующие их уравнения отражают лишь конечный итог химических превращений. |

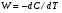 для реакции А→ В?
для реакции А→ В?