Роберт Вильгельм Бунзен
 Скачать 2.24 Mb. Скачать 2.24 Mb.
|
ЭЛЕКТРОХИМИЯ.Учебно-целевые задачи:Изучив этот раздел учебной программы, студент должен знать:
ЗНАЧЕНИЕ ЭЛЕКТРОХИМИЧЕСКИХ ЯВЛЕНИЙ ДЛЯ МЕДИЦИНЫ. Электрохимия представляет собой раздел физической химии, изучающий превращение химической энергии в электрическую, и наоборот. Электрохимические явления, протекающие в человеческом организме, представляют чрезвычайно интересную и еще недостаточно исследованную область. Известно, что движение скелетных мышц, сокращение сердца, возбуждение и торможение клеток центральной нервной системы, распространение импульсов по нервам сопровождаются электрическими явлениями. Возникают электрические потенциалы, «токи действия», которые можно обнаружить и измерить специальной аппаратурой. Широко используются приборы, которые записывают эти токи в целях диагностики некоторых заболеваний сердца, головного мозга и мышц - электрокардиографы, электроэнцефалографы и электромиографы. Биологические ткани и жидкости содержат значительное количество электролитов и обладают довольно высокой электропроводностью. Основываясь на этом, в физиотерапии успешно применяют ионофорез, т.е. введение лекарств в виде ионов с поверхности кожи и слизистых, к которым прикладывают соответствующие электроды. ЭЛЕКТРОДНЫЕ ПРОЦЕССЫ И ЭЛЕКТРОДВИЖУЩИЕ СИЛЫ. При подготовке к занятию необходимо ответить на следующие вопросы:
ЭЛЕКТРОД И ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ. Электродом называют электронопроводящую фазу (металл или полупроводник), контактирующий с электролитом. При погружении металла в воду происходит отрыв ионов от кристаллической решетки металла под влиянием полярных молекул растворителя. В результате перехода катионов в раствор металлическая пластинка приобретает отрицательный заряд за счет оставшихся электронов, а близлежащий слой воды - положительный. На границе раздела металл-вода возникает двойной электрический слой (рис. 1). При определенном заряде металла устанавливается равновесие, которое характеризуется равенством скоростей прямого и обратного процессов VМ→Н О ↔ VН О→М. Установившаяся разность потенциалов в двойном электрическом слое зависит от природы металла, растворителя и температуры Если же металл погружен в раствор собственной соли, то переходу ионов металла в раствор будут противодействовать уже имеющиеся в растворе такие же ионы. 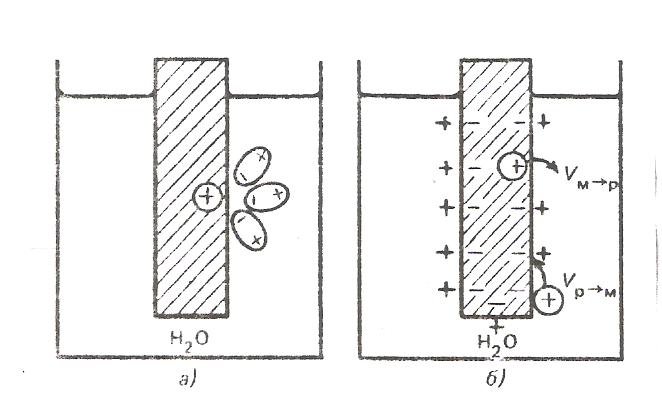 Рис. 1. Возникновение скачка потенциала на границе раздела металл-вода Это противодействие выражается в стремлении ионов металла из раствора собственной соли, перейти на поверхность металла. 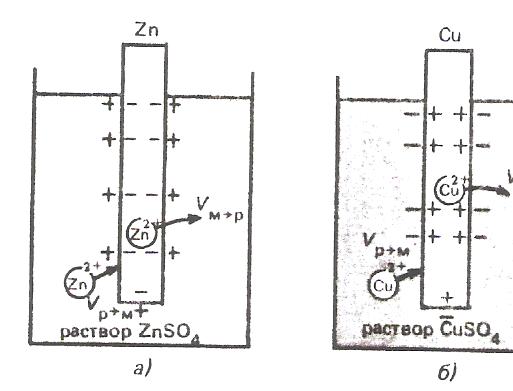 Рис. 2. Возникновение скачка потенциала на границе раздела металл-раствор его соли Если в начальный момент скорость υм→р > υр→м, то металл по отношению к раствору заряжается отрицательно (см. рис.2а). При этом по мере перехода ионов в раствор υм→р уменьшается, а υр→м возрастает. При определенном значении скачков потенциала в системе устанавливается равновесие υм→р = υр→м. Направление самопроизвольного перехода ионов М→Р или Р → М и равновесное соотношение скоростей перехода ионов υм→р и υр→м определяются энергией Гиббса этих процессов. Скачок потенциала, возникающий на границе раздела металл - раствор его соли называется электродным. 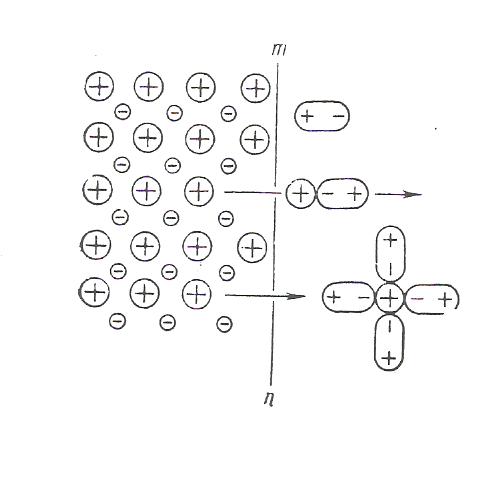 Гидратация поверхностно расположенных катионов металла в воде - поверхностная растворимость металла (схема): mn – поверхность раздела жидких и твердых фаз СТРОЕНИЕ ДВОЙНОГО ЭЛЕКТРИЧЕСКОГО СЛОЯ НА ГРАНИЦЕ РАСТВОР-МЕТАЛЛ Двойной электрический слой (ДЭС) создается электрическими зарядами, находящимися на металле, и ионами противоположного знака, ориентированными в растворе у поверхности электрода. В формировании ионной обкладки ДЭС принимают участие электростатические силы и силы теплового движения. За счет электростатических сил ионы подходят к поверхности металла, а за счет молекулярного, т.е. теплового движения, ДЭС приобретает размытое строение (рис.3). 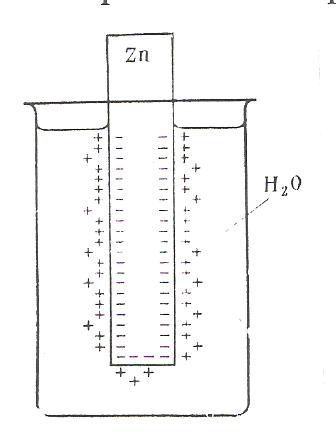 Рис. 3. Под строением ДЭС понимают распределение зарядов в его ионной обкладке. Ионная обкладка состоит из плотной части «а – б», образованной ионами, вплотную подошедшими к металлу, и диффузной части, созданной ионами, находящимися на расстоянии, превышающем радиус сольватированного иона «б – в». Распределение потенциала в ионной обкладке представлено на рис. 4. φ- скачок потенциала на границе металл – раствор; φ1- падение потенциала в плотной части ДЭС;  φ2- падение потенциала диффузной части ДЭС. Рис. 4 Строение ДЭС зависит от общей концентрации раствора. С её ростом толщина диффузной части уменьшается за счет ослабления диффузии ионов от поверхности металла в раствор. В концентрированных растворах диффузная часть практически отсутствует и ДЭС подобен плоскому конденсатору, что соответствует модели Гельмгольца, впервые предложившего теорию строения ДЭС. УРАВНЕНИЕ НЕРНСТА Зависимость электродного потенциала от природы металла, активности его ионов в растворе и температуры количественно выражается уравнением, выведенным немецким физиком В.Нернстом: RT φм = φ˚м + ln a(м́ z+)∙, ZF где φм - электродный потенциал, В; φ˚м - стандартный электродный потенциал. В; T - абсолютная температура, К; R - газовая постоянная, равная 8,32 Дж/(моль К); F – постоянная Фарадея, равная 96500 Кл/моль а(мz+) – активность ионов металла в растворе, моль/л, Z – заряд иона. Стандартным электродным потенциалом φ˚м называют скачок потенциала на границе раздела металл – раствор его соли с активностью ионов Мz+, равной 1, при стандартных условиях. Для разбавленных растворов можно использовать концентрацию. Уравнение В.Нернста в этом случае имеет вид: RT φм = φ˚м + ln c(м́ z+). ZF Основы сольватационной теории возникновения скачка потенциала на границе металл – раствор. Теория возникновения электродного потенциала получила развитие в трудах В.Нернста, Л.Писаржевского, Н.Изгарышева и У.Герни. Объединяя результаты исследований названных авторов, можно представить сольватационную теорию возникновения электродного потенциала следующим образом. Скачок потенциала возникает за счет следующих процессов:
М ↔ Мz+ + zē ( Ем )
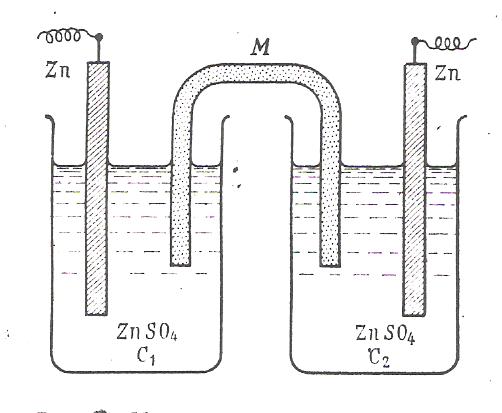
Мz+ + nL ↔ Mz+nL ( Ec ) Каждая из указанных реакций характеризуется определённой энергией. Ионизация электродного металла характеризуется энергией разрушения кристалической решётки Ем. Сольватация образующихся ионов металла молекулами растворителя характеризуется энергией сольватации Ес. Соотношение Ем/Ес определяет направление суммарной реакции: М + nL ↔ Mz+nL + zē , а также знак и величину потенциала. Это энтальпийные составляющие энергии Гиббса. Если Ес>Ем, то самопроизвольно идет процесс перехода ионов металла в раствор и металл в растворе собственной соли заряжается отрицательно. Если Ec Электростатическое взаимодействие между металлом и ионами раствора препятствует беспредельному переходу ионов в одном направлении. В итоге в системе металл – раствор устанавливается подвижное равновесие. На границе двух фаз формируется ДЭС, которому соответствует определённое значение разности потенциалов. Разность потенциалов между двумя точками определяется работой, которую необходимо совершить, чтобы перенести элементарную частицу электричества из одной точки в другую. Если точки лежат в двух разных фазах, то работа по переносу элементарной частицы будет носить электрический и химический характер, т.к. химические потенциалы этой частицы в двух фазах будут неодинаковы. Поэтому энергетическое состояние элементарной частицы в каждой фазе будет характеризоваться электрохимическим потенциалом μ̃ ,который равен сумме химического потенциала и её электрической энергии: μ̃ = μ+ zFφ Условием равновесия для заряженной частицы, о котором мы говорили ранее, является равенство электрохимических потенциалов в каждой фазе μ̃1 = μ̃ 2 или μ1 + zFφ1 = μ2 + zFφ2 Отсюда скачок потенциала между двумя фазами ∆φ = φ2 – φ1 выразится равенством ∆φ =(μ1 – μ2)/ zF. Химический потенциал иона в металле μ2 можно считать постоянным, а химический потенциал иона в растворе выражается уравнением: μ1 = μº1 + RT ln(a) тогда: μº1– μ2 RT RT ∆φ = + · ln (a1) = ∆φº + · ln (a) zF zF zF где ∆φº - стандартный потенциал электрода при а = 1, а ∆φ = φ RT φ = φº + ln (a) zF Полученное уравнение не отличается от уравнения Нернста. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ И ИХ ЭЛЕКТРОДВИЖУЩИЕ СИЛЫ Гальванический элемент – это устройство, в котором энергия химической реакции превращается в электрическую. Он состоит из двух полуэлементов, а именно из двух растворов, соприкасающихся друг с другом, в которые погружены металлические электроды, соединенные внешним проводником. В гальваническом элементе сами по себе равновесные электроды образуют неравновесную систему, дающую электрический ток. Если сила тока в системе мала и система практически находится в состоянии равновесия, элемент этот работает обратимо. Максимальная разность потенциалов, достигаемая при обратимой работе гальванического элемента, называется его электродвижущей силой. В качестве обратимого гальванического элемента удобно рассмотреть элемент Якоби – Даниеля, который состоит из медного и цинкового электродов, погруженных соответственно в растворы ZnSO4 и CuSO4 . Схематично этот элемент изображается следующим образом (рис. 5): 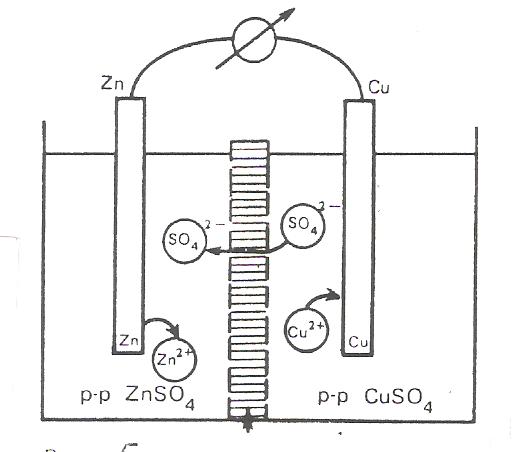 Рис. 5. Гальваническийи элемент Якоби-Даниэля Zn|ZnSO4 ||CuSO4 ||Cu Разомкнутый элемент находится в заторможенном неравновесном состоянии и может пребывать в этом состоянии как угодно долго. При замыкании электродов металлическим проводником наблюдается иная картина: электроны по нему переходят от цинкового электрода к медному. Этот процесс сопровождается переходом ионов цинка с электрода в раствор и осаждением ионов меди из раствора на электрод. Оба эти процесса являются результатом окислительно-восстановительной реакции. На цинковом электроде протекает реакция окисления: Zn(т) ↔ Zn²+(p) + 2ē ; ∆ G° = - 146 кДж На медном – полуреакция восстановления: Cu²+ (p) + 2ē ↔ Cu(т) ; ∆G° = - 66 кДж Следовательно, электрический ток обусловлен суммарной окислительно-восстановительной реакцией: Cu²+ (p) + Zn(т) ↔ Cu(т) + Zn²+ (p) ; ∆ G° = - 212 кДж Раствор в приэлектродном пространстве цинкового электрода обогащается ионами цинка, а медного электрода обедняется ионами меди. Вследствие этого сульфат – ионы перемещаются через пористую перегородку из раствора сульфата меди в раствор сульфата цинка, увеличивая его концентрацию. Катионы цинка диффундируют в обратном направлении, замещая перешедшие на медный электрод катионы меди. В результате этого раствор сульфата меди постепенно превращается в сульфат цинка. Гальванический элемент будет работать до тех пор, пока весь цинковый электрод не раствориться. После этого электрический ток прекратиться. При работе гальванического элемента происходит одновременный перенос электричества по двум цепям: внешней (поток электронов по проводнику) и внутренней (поток ионов в жидкой фазе элемента). Цинк для внешней цепи играет роль катода, так как посылает во внешнюю цепь поток электронов, а для внутренней цепи – анода, так как посылает во внутреннюю цепь положительно заряженные катионы. Медь для внешней цепи играет роль анода – акцептор электронов, а для внутренней цепи роль катода – донор электронов. Общее выражение для ЭДС гальванического элемента. Обозначим электрохимическую реакцию следующим образом: аА+ вВ ↔ сС + дД Для реакции, протекающей при постоянных давлении и температуре, убыль энергии Гиббса можно оценить с помощью уравнения изотермы химической реакции: ∆G = - RT ln Ka + RT ln (aсC · adD /aaA · abB) В соответствии со вторым началом термодинамики максимальная работа равна убыли энергии Гиббса W max = - ∆G. Электрическая работа в изобарно – изотермических условиях равна W max = zFE , где Е= ЭДС Следовательно: zFE = RT ln Ka – RT ln(aсC · adD /aaA · abB) Разделив обе части уравнения на величину zF получим RT RT E = ln Ka – ln(aсC · adD /aaA · abB) zF zF Выражение RT/zF ln Ka при Т = const, является величиной постоянной, определяемой свойствами электродов. Эту величину обозначают через Е° и называют стандартной ЭДС. В конечном итоге следует общее выражение для ЭДС гальванического элемента. RT E = Е° - ln(aсC · adD /aaA · abB) zF Конкретно для реакции Zn(т) + Cu²+(т) ↔ Zn²+(p) + Cu (т), протекающей в гальваническом элементе Якоби - Даниеля, выражение для ЭДС можно записать следующим образом: RT а (Zn²+) Е = Е°– ln zF а (Cu²+) Где активность твердого вещества (металла) при данной температуре постоянна и равна единице. КОНЦЕНТРАЦИОННЫЕ ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ.В концентрационных гальванических элементах электрическая энергия образуется не за счет химической реакции, а за счет разницы концентраций растворов, в которые опущены электроды, изготовленные из одного и того же металла. Расcмотрим цепь (рис. 6 ) Zn|ZnSO4(a1)||ZnSO4(a2)|Zn , причем а1<а2.
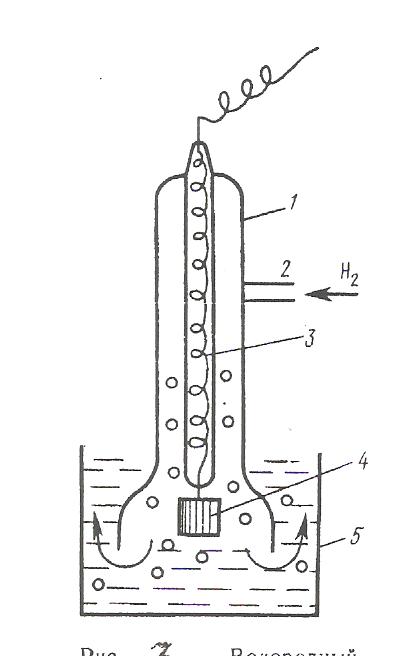
Поскольку металл обоих электродов один и тот же, стандартные потенциалы их также одинаковы. Однако, из-за различия концентрации (активности) катионов металла равновесие: Zn ↔ Zn²++ 2ē в растворе в обоих полуэлементах неодинаково. В полуэлементе с менее концентрированным раствором (а1) равновесие несколько сдвинуто вправо Zn→ Zn²++ 2ē и электрод заряжается отрицательно. Электрод, погруженный в раствор большей концентрацией (а2), заряжается положительно. В процессе работы гальванического элемента концентрация а2 постепенно уменьшается, концентрация а1 увеличивается. Элемент работает до тех пор, пока выравняются концентрации. Для вычисления ЭДС цепи воспользуемся уравнением E= φ2 - φ1 На основании уравнения Нернста можно записать: RT φ1 = φºZn + ln a1, zF RT φ2 = φºZn + ln a2, zF Подставляя значения φ1 и φ2 в уравнение для ЭДС получим: RT a2 Е = ln , Eº = 0 zF a1 Для разбавленных растворов используют вместо активностей концентрации растворов RT с2 Е = ln . zF с1 ДИФФУЗНЫЙ ПОТЕНЦИАЛ. В гальванических элементах на границах соприкосновения растворов могут возникать диффузионные потенциалы (φg). Скачок потенциала на границе между неодинаковыми по составу или по концентрации растворами называется диффузионным потенциалом. Диффузионный потенциал можно определить экспериментально, а так же вычислить. Сделаем это на примере рассмотренной выше концентрационной цинковой цепи. При работе элемента электроны во внешней цепи переносятся слева направо. Следовательно, внутри элемента сульфат – ионы переходят справа налево. Ионы цинка движутся в обратном направлении. Подвижность сульфат ионов (la) больше подвижности ионов цинка (lк). Соответственно работы переноса одного грамм – иона равны. a2 a2 W(SO4²¯) = RT ln ; W(Zn²+) = - RT ln . a1 a1 Через границу проходят неравные количества ионов, а количества, пропорциональные числам переноса ионов и суммарная работа тогда равна: a2 W= RT (t (-) –t (+)) ln a1 la t (-) = - число переноса сульфат- ионов la + lk lk t (-) = - число переноса ионов цинка la + lk- Доля количества электричества, переносимого ионами данного знака по отношению к электричеству, переносимому всеми ионами, называется числом переноса данных ионов. Подставим значения t (-) и t (+) в уравнение для суммарной работы la – lk a2 W= RT ln la +lk a1 Зная, что W= zFφg, запишем la – lk a2 zFφд = RT ln la +lk a1 RT la – lk a2 Откуда φд = ln zF la +lk a1 ЭДС концентрационной цинковой цепи с учетом диффузионного потенциала будет равна: Е=Ек + φд 2la RT a2 Е = ln la+lk zF a1 При lk > la ЭДС концентрационной цепи была бы равна Е=Ек - φд При точных вычислениях ЭДС гальванических элементов обязательно должна вводиться поправка на величину диффузионного потенциала. Однако, на практике чаще всего устраняют влияние диффузионного потенциала, включая между растворами электролита насыщенный раствор хлорида калия. ЭЛЕКТРОДЫ ПЕРВОГО РОДА. К электродам первого рода относят металлические электроды, обратимые относительно катионов, и металлоидные, обратимые относительно анионов. Обратимость электрода относительно тех или других ионов означает зависимость его потенциала от концентрации данных ионов. Примерами металлических электродов типа М/Мz+ являются Zn°/ Zn²+, Cu°/ Cu²+ и др. Электродный потенциал их определяется уравнением: RT φ = φ° + ln a (мz+) zF и зависит только от концентрации (активности) одного вида ионов. Для электродов, обратимых относительно анионов, применимо уравнение: RT φ = φ° - ln a (Аz-) zF Примером металлоидного электрода, обратимого относительно аниона, может служить селеновый электрод Se/Se²ˉ . К электродам первого рoда относят также газовые электроды, которые могут быть обратимы по отношению к катиону или аниону. Их создают по схеме (металл), газ|раствор. Металл в газовых электродах необходим как переносчик электронов и для создания поверхности, на которой протекает реакция. Металл должен быть инертным по отношению к веществам, находящимся в растворе. Типичным примером газового электрода является водородный электрод: (Pt), Н2|Н+ Водородный электрод. Водородный электрод (рис. 7) представляет собой покрытую платиновой чернью платиновую пластинку, насыщенную газообразным водородом, которая опущена в водный раствор кислоты. Водород, растворенный в платине, частично диссоциирует на протоны и электроны: Н2↔2Н+ + 2ē В результате такая платиновая пластинка приобретает способность обмениваться с раствором ионами водорода: Н+(Рt) + Н2О↔Н3О+(Рt) Возникающий при этом потенциал зависит от активности ионов водорода в растворе и ионов водорода в платине Н3О+(р) +2ē↔ Н2(Рt) +2Н2О
Активность ионов водорода в платине пропорциональна давлению газообразного водорода. Количественно эта зависимость выражается уравнением Нернста: RT a²(н+) φн2 = φ° н2 + ln 2F р(н2) где р(н2) – давление газообразного водорода, Па. Стандартным водородным электродом (φ°н2) называют электрод, в котором давление газообразного водорода поддерживается равным 101 кПа, а активность ионов водорода в растворе равна 1. Потенциал стандартного водородного электрода условно принят за нуль: φ°н2 = 0 При всех других активностях ионов водорода при условии, что р(н2)=101 кПа уравнение Нернста для водородного электрода принимает вид RT φ°н2= ln a (н+), F или с учетом, что – lg а (н+) =рН RT φ°н2 = - 2,3 · рН F Стандартный водородный электрод используется как электрод, относительно которого измерены потенциалы всех остальных стандартных электродов. Стандартный электродный потенциал численно равен электродвижущей силе со знаком «+» или «–» гальванического элемента, составленного из стандартного водородного и стандартного данного электродов. Например, цепь с цинковым электродом Zn|ZnSO4||H2SO4|H2 , Pt ЭДС водородно-цинковой цепи будет равна Е°= φ°н2 - φ°Zn ; φ°Zn = - Е° в случае медно – водородной гальванической цепи ЭДС равна Pt, H2 | H2SO4 | CuSO4 | Cu Е°= φ°Cu - φ°н2 φ°Cu = Е° Последовательность металлов, расположенных в порядке убывания (возрастания) значений их стандартных электродных потенциалов, называют рядом напряжений. Ионоселективные электроды Ионоселективные электроды – это электроды, которые состоят из двух фаз: ионита и раствора, а потенциал на границе раздела фаз возникает за счет ионообменного процесса, в результате которого поверхность ионита и раствора приобретают электрические заряды противоположного знака. Иониты обладают повышенной избирательной способностью по отношению к определенному виду ионов, находящихся в растворе, поэтому такие электроды и называют ионоселективными. Все ионоселективные электроды в зависимости от агрегатного состояния ионита (мембраны) подразделяются на электроды с жидкими и твердыми мембранами. В качестве жидких мембран используют органические жидкости: хлор – бензол, толуол, которые не смешиваются с водой, не растворяют ионогенное вещество, способное к обмену с ионами данного вида в исследуемом растворе. К твердым мембранам относятся стеклянные, кристаллические: монокристаллы или прессованные пластинки труднорастворимого соединения и др. В последнее время область применения ионоселективных электродов расширилась благодаря использованию фермента. Например, мочевина под действием уреазы превращается в ион NH+4. С помощью ионоселективного электрода, содержащего уреазу, можно анализировать раствор на содержание мочевины. В настоящее время используют электроды, содержащие ферменты для определения глюкозы, витаминов, антибиотиков, гормонов, аминокислот и др. Стеклянный электрод Стеклянные электроды изготавливают из стекла определенного состава. Стекло чаще всего представляет собой соединение диоксида кремния с щелочными и щелочно–земельными оксидами. В результате гидролиза силикатов на поверхности стекла образуется тонкая пленка геля поликремниевой кислоты, незначительно диссоциированной на ионы. R–O–Si–OH ↔ R–O–Si–Oˉ+ H+ || || О О Анионы поликремниевой кислоты R–OSiO2ˉ сообщают отрицательный заряд поверхности стекла. Ионы водорода заряжают положительно прилегающий к поверхности стекла слой раствора. Степень диссоциации поликремниевой кислоты зависит от концентрации ионов водорода в растворе. Одной из распространенных форм стеклянного электрода является стеклянная трубка, заканчивающаяся шариком (рис. ). Шарик заполнен раствором HCl, в который погружен вспомогательный х.с. электрод. Шарик погружают в исследуемый раствор и с помощью мостика стеклянный электрод соединяют с внешним электродом сравнения. Собранную таким образом цепь можно записать следующим образом: Ag,AgCl | HCl(p )| стекло | исследуемый раствор || KCl(p) || KCl(p) | AgCl,Ag внутренний φ2 φ3 φ4 внешний электрод электрод сравнения φ1 сравнения ЭДС этой цепи определяется суммой :φ1 + φ2 + φ3 + φ4. Скачки потенциалов φ1, φ2 и φ4 постоянны, следовательно, ЭДС цепи изменяется в зависимости от потенциала φ3, зависящей от рН исследуемого раствора. 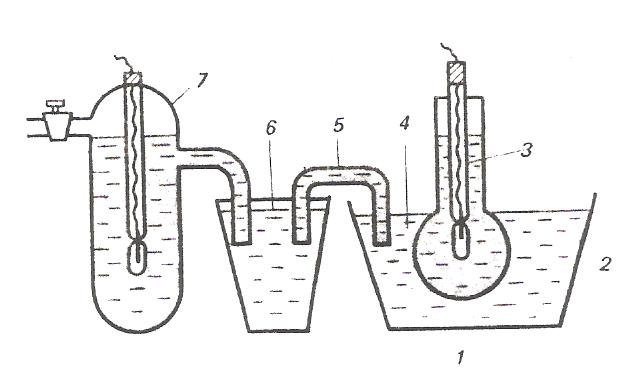 Рис.8. Стеклянный электрод: 1 – шарик из стеклянной мембраны; 2 – раствор НСl; 3 – внутренний сереброхлоридный электрод; 4 – исследуемый раствор; 5 – агаровый мостик; 6 – раствор хлорида калия; 7 – внешний сереброхлоридный электрод Электродная реакция сводится к обмену ионами водорода между двумя фазами – раствором и стеклом. В реакцию обмена вовлекаются и ионы щелочных металлов. Устанавливается равновесие Н+(ст) + М+(р) ↔ Н+(р) + М+( ст) Условие равновесия этой реакции выражается в законом действующих масс: ан+(р) · ам+(ст) Кобм = ан+(ст) · ам+( р) Размер этой константы обмена зависит от свойств стекла и температуры. Исходя из предположения, что в стекле данного сорта сумма активностей ионов водорода и ионов щелочного металла постоянна, т.е. ан+ (ст) + ам+ (ст) = а, уравнение константы обмена можно представить в следующем виде: ан+ (р)(а - ан+ (ст)) Кобм = ан+ (ст) · ам+ ( р) Решая это уравнение относительно ан+ (р) / ан+ (ст) , получим ан+ (р) ан+ (р) + Кобм · ам+ ( р) = ан+ (ст) а Потенциал стеклянного электрода (φ0) может быть выражен следующей зависимостью: RT ан+ (р) φст = φ˚ст + · ln zF ан+ (ст) Замена ан+ (р)/ан+ (ст) в уравнении электродного потенциала стекла его значением приводит к следующей зависимости: RT φст = φ˚ст + ln (ан+ (р) + Кобм · ам+ ( р)), zF где RT/zF·ln(a) входит стандартный потенциал стеклянного электрода φ0. Таким образом, в общем случае потенциал любого стеклянного электрода обусловливается двумя величинами – активностью ионов водорода и активностью щелочного металла. Если в растворе ан+ (р) >> Кобм · ам+ ( р), то RT RT φст = φ˚ст + ·ln ан+ (р) = φ˚ст – 2,3 ·pH, zF F т.е. электрод обладает водородной функцией и поэтому может служить индикаторным электродом при определении рН. Если в растворе ан+ (р) << Кобм · ам+ ( р), то RT RT φст = φм = φ˚ст + ·ln Кобм + ·ln ам+ ( р), zF zF RT или φм = φ˚м + ·ln ам+ ( р), zF во всех уравнениях z=1. Стеклянный электрод с металлической функцией может использоваться в качестве индикаторного электрода для определения активности соответствующего щелочного металла. Таким образом, в зависимости от сорта стекла, точнее от величины константы обмена, стеклянный электрод может обладать водородной и металлическойфункциями. ЭЛЕКТРОДЫ ВТОРОГО РОДА. Электроды второго рода состоят из металла, труднорастворимой соли этого метала и второго соединения, хорошо растворимого и с тем же анионом, что и первое соединение. Условное обозначение таких электродов М׀МА׀А-. Представителями электродов второго рода являются хлорсеребряный и каломельный электроды. Хлорсеребряный электрод Аg ׀ Ag Cl. KCl Хлорсеребряный электрод (рис. 9) представляет собой серебряную проволоку, покрытую слоем хлорида серебра и опущенную в сосуд, наполненный насыщенным раствором хлорида калия. Сосуд имеет микрощель для контакта с исследуемым раствором. 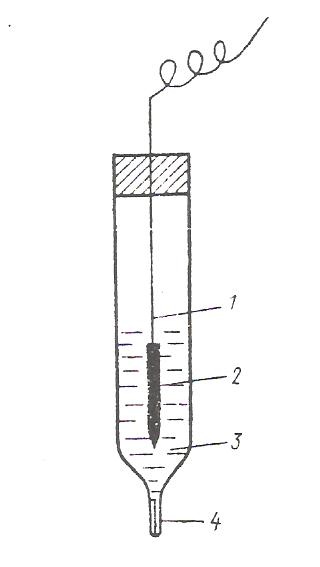 Рис.9. Хлорсеребряный электрод: 1-серебряная проволока; 2-слой AgCl; 3-раствор KCl; 4-микрощель Основной химический процесс: Аg+ + ē ↔ Аg◦ Сопровождается реакцией растворения или осаждения соли АgСl:АgСl ↔ Аg+ + Сl ‾ В присутствии хлорида калия, содержащего одноименный с хлоридом серебра ион хлора, растворимость хлорида серебра снижается. При постоянных концентрации KCl и температуре концентрация ионов Аg+ постоянна, чем и объясняется необходимая устойчивость потенциала электрода. Потенциал хлорсеребряного электрода возникает на поверхности соприкосновения металлического серебра с раствором его ионов и может быть выражен следующим уравнением: RT exc = e°Ag+ ∙ ln a(Ag+) zF Хлорид серебра трудно растворим в воде. Его произведение растворимости ПР = a(Ag+)∙a(Сl‾), из которого следует что a(Ag+) = ПР/ a(Сl‾). Подставляя a(Ag+) в уравнение для потенциала хлорсеребряного электрода, получим: RT RT φхс = φAg°+ ∙ ln(ПР) – ∙ ln a(Сl‾) zF zF Объединяя постоянные при данной температуре величины e°Ag и RT/zF ∙ ln(ПР) в одну величину и обозначая её через e°xc, получают уравнение для потенциала хлорсеребряного электрода: RT φхс = φ°хс – ∙ ln a(Сl‾) zF Таким образом, потенциал хлорсеребряного электрода в конечном итоге зависит от концентрации (активности) ионов хлора. ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ СИСТЕМЫ (ОВ) И ОВ –ЭЛЕКТРОДЫ. В зависимости от механизма окисления – восстановления разнообразные ОВ - системы можно разделить на два типа: 1-ый тип: ОВ – системы, в которых окислительно – восстановительный процесс связан с передачей только электронов, например: Fe³+ +ē ↔ Fe²+ 2-ой тип: ОВ- системы, в которых окислительно – восстановительный процесс связан не только с передачей электронов, но и протонов, например: С6Н4О2 + 2Н+ +2ē ↔ С6Н4(ОН)2 хинон гидрохинон MnO4- + 8H+ + 5ē ↔ Mn²+ + 4H2O Инертный металл в сочетании с ОВ – системой называют окислительно – восстановительным или редокс – электродом, а возникающий на этом электроде потенциал называют окислительно – восстановительным (ОВ) или редокс – потенциалом. Инертный металл принимает лишь косвенное участие в потенциалопределяющей реакции, являясь посредником в передаче электронов от восстановленной формы вещества Red к окисленной ОХ. При погружении инертного металла в раствор, содержащий избыток окисленной формы железа, металлическая пластинка заряжается положительно (рис. 10 а) При избытке восстановленной формы железа поверхность платины заряжается отрицательно (рис. 10 б).  Рис. 10. Возникновение ОВ-потенциала Передача электронов с одного иона на другой через металл приводит к образованию на поверхности металла ДЭС. Межионный обмен электронами возможен и без металла. Но ионы Fe²+ и Fe³+ сольватированы различным образом и для переноса электронов необходимо преодолеть энергетический барьер. Переход электронов от ионов Fe²+ на металл и с поверхности металла к иону Fe³+ характеризуется меньшей энергией активации. При равенстве активностей ионов Fe²+ и Fe³+ платиновая пластина заряжается положительно, т.к. электроно – акцепторная способность ионов Fe³+ больше чем электроно – донорная способность Fe²+. Уравнение Петерса. Количественная зависимость ОВ – потенциала от природы ОВ – системы (φ°r), соотношения активностей окисленной и восстановленной форм, температуры, и от активности ионов водорода устанавливается уравнением Петерса. RT а(OX) 1-ый тип: φr = φ°r + ∙ ln zF a(RED) mRT a(OX)a(H+) 2-ой тип: φr = φ°r + ∙ ln zF a(RED) где φr - ОВ - потенциал, В; φ°r - стандартный ОВ - потенциал, В; z – число электронов, участвующих в ОВ – процессе; а (Ох) – активность окисленной формы, моль/л; а (Red) – активность восстановительной формы, моль/л; m - число протонов; а(н+) – активность ионов водорода, моль/л. Стандартным ОВ – потенциалом называют потенциал, возникающий на границе раздела инертный металл – раствор, в котором активность окисленной формы равна активности восстановленной формы, а для системы второго типа, кроме того, активность ионов водорода равна единице. Классификация обратимых электродов. Рассмотрев принцип работы электродов можно сделать вывод, что по свойствам веществ, участвующих в потенциалоопределяющих процессах, а также по устройству все обратимые электроды делят на следующие группы:
ПРАВИЛА, РЕКОМЕНДОВАННЫЕ ИЮПАК, ПРИ ЗАПИСИ ГАЛЬВАНИЧЕСКИХ ЦЕПЕЙ И УРАВНЕНИЙ РЕАКЦИЙ, ПРОТЕКАЮЩИХ В НИХ.
Pt|Fe³+, Fe²+ ; Pt, H2 |HCl(p)
Zn|ZnSO4(р) : CuSO4 (р) |Cu ИЗМЕРЕНИЕ ЭДС ГАЛЬВАНИЧЕСКИХ ЭЛЕМЕНТОВ. Наибольшее применение в практике нашел компенсационный метод измерения ЭДС. Он основан на включении во внешнюю цепь источника тока, который может скомпенсировать ЭДС исследуемого элемента. Принципиальная компенсационная схема измерения ЭДС представлена на (рис. 11) 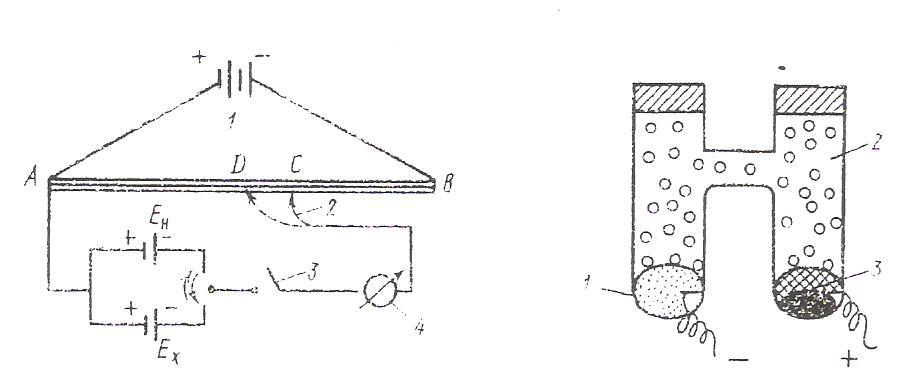
От аккумулятора 1 на реохорд АВ с большим сопротивлением подают напряжение (2-4 В). Подвижный контакт 2 позволяет менять напряжение. С помощью переключателя тока 3 в цепь включают элемент Вестона с известным значением ЭДС ( Ен = 1,018 В при 298К ). Элемент Вестона подключают одноименными полюсами, чтобы ток от элемента Вестона шёл навстречу току аккумулятора. Передвигая контакт 2, подбирают такое положение на реохорде , чтобы падение напряжения на участке АС равно ЭДС элемента Вестона (Ен). При этом стрелка гальванометра не должна отклонятся от нуля. При таком положении ток в цепи не идёт и система находится в равновесии. Это позволяет найти цену деления реохорда как Ен/Ас (В/м). Затем с помощью переключателя 3 вместо элемента Вестона включают таким же образом исследуемый элемент (Еx). Передвигая контакт 2, находят положение, при котором падение напряжения на участке АД равно Еx. при этом стрелка гальванометра так же не должна отклонятся от нуля в указанном состоянии равновесия: Ен Ех = АД АС ПОТЕНЦИОМЕТРИЯ. Потенциометрией называют совокупность физико – химических методов исследования, в основе которых лежит измерение электродвижущей силы цепей, составленных из индикаторного электрода и электрода сравнения, Поскольку потенциал индикаторного электрода зависит от активности (концентрации) исследуемого иона в растворе, измерение ЭДС позволяет определять количество соответствующих ионов. Различают прямые и косвенные потенциометрические методы. Прямые потенциометрические методы. В прямых потенциометрических методах источником информации для определения активности или концентрации ионов является числовое значение индикаторного электрода. Успешное потенциометрическое определение возможно только при правильном подборе индикаторного электрода, соответствующего целям исследования. В качестве индикаторного электрода для потенциометрического определения рН можно использовать любой электрод, потенциал которого зависит от активности ионов водорода. Чаще всего для этих целей применяют стеклянный электрод, реже – водородный. Измерение ЭДС проводят с помощью специальных приборов – универсальных ионометров. Косвенные потенциометрические методы. Чаще всего потенциометрические измерения используют для определения точки эквивалентности в титриметрическом анализе – потенциометрическое титрование. В ациди- или алкалиметрии в качестве индикаторного электрода применяют стеклянный электрод , т.к. его потенциал зависит от рН среды. В оксидиметрическом титровании применяют редокс – электрод. В осадительном и комплексиметрическом – ионоселективные электроды. Для определения точки эквивалентности строят кривую титрования (рис.12) – график зависимости ЭДС измерительной цепи от объёма прилитого титранта. 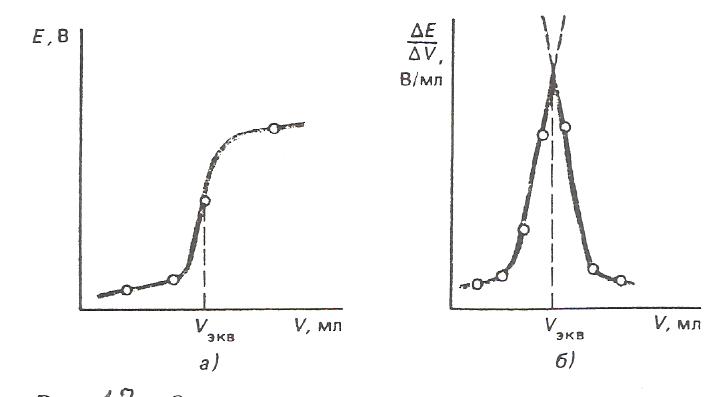 Рис. 12. Определение точки эквивалентности в потенциометрическом титровании: а) по графику 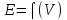 ; б) по графику ; б) по графику 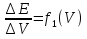 Затем проецируют точку перегиба кривой титрования на ось абсцисс (рис.12,а). Более точно искомое значение можно определить по графику изменения приращения потенциала на единицу, добавляемого объёма титранта ∆φ/ΔV в зависимости от общего объёма прилитого титранта (рис 12,б). ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ И ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ. Задача№1: Рассчитать потенциал кадмиевого электрода, опущенного в водный раствор сульфата кадмия с активностью ионов кадмия 0,015, при температуре 30ºС. Решение: Электродная реакция может быть записана следующим образом: Cd2+ +2ē → Cd Количество электронов, участвующих в данной электродной реакции n = 2 Равновесный электродный потенциал рассчитываем по уравнению Нернста: RT φ = φº+ · ln(aCd2+), zF φ = -0,403+(8,314·303/2·96485)ln 0,015 = - 0,4578 B Задание №1: Рассчитайте потенциалы электродов при следующих условиях. Средние коэффициенты активности взять из справочника.
|