Аритмии сердца. Кушаковский М.С.. Руководство для врачей СанктПетербург гиппократ 1992 Глава 1 система образования и проведения импульса в сердце (проводящая система сердца)
 Скачать 7.14 Mb. Скачать 7.14 Mb.
|
|
Глава 17 ФИБРИЛЛЯЦИЯ И ТРЕПЕТАНИЕ ПРЕДСЕРДИЙ ФИБРИЛЛЯЦИЯ (МЕРЦАНИЕ) ПРЕДСЕРДИЙ Фибрилляция предсердий встречается, по данным Н. Kulbertus и соавт. (1982), в 0,4% среди взрослой популяции людей. У лиц в возрасте 60 лет и старше она регистрируется уже в 2—4% случаев. Лишь у младенцев и детей ФП и ТП редки (если не считать тех, у кого имеется синдром WPW). В общем же, по распространенности ФП уступает только экст-расистолии. Согласно многолетним наблюдениям А. А. Обуховой и соавт. (1986), на долю мерцательной аритмии приходится до 40 % всех нарушений сердечного ритма. Некоторое представление об этом могут дать и материалы Ленинградского городского противоаритмического центра. С 01.01.80 г. по конец 1988 г. здесь были госпитализированы свыше 6,7 тыс. больных'с ФП и ТП, т. е. ежегодно в стационар поступало около 750 больных. Соотношение между ФП и ТП составило 10 : 1 (по другим данным может достигать 20:1). Почти 80 % больных переносили пароксизмы аритмии, у остальных она была расценена как хроническая, поскольку ее длительность превышала 6 нед. Из «аритмических» больных, обращавшихся за амбулаторной помощью в диспансерный кабинет противоаритмического центра, около 40% страдали ФП (ТП). Термин «мерцание предсердий» (Vor-hofflimmern) предложили С. Rothberger и Н.Winterberg (1909). Однако первое сообщение об этой форме аритмии было сделано значительно раньше R.Adams (1827), считавшим ее проявлением митрального стеноза. В 1863 г. Е. Магеу зарегистрировал кривые пульса у больного с митральным стенозом, осложнившимся ФП. Соответствующие ЭКГ были записаны W. Ein-thoven (1906-1907) и Н. Hering (1908). Во время фибрилляции в миокарде предсердий происходит полная дезорганизация электрических процессов, т. е. хаотическое, асинхронное и неполноценное возбуждение. От 400 до 700 беспорядочных импульсов за 1 мин охватывают лишь отдельные мышечные волокна или небольшие группы волокон, что исключает возможность координированного систолического сокращения предсердий. Для объяснений механизмов возникновения и поддержания ФП были выдвинуты различные гипотезы. Одна из них, сформулированная в 1921 г. Т. Lewis и соавт. и имеющая ряд модификаций, — гипотеза множественного microre-entry в мышце предсердий, — пользуется наиболее широкой поддержкой [Арьев М. Я., 1924; Ветохин И. А., 1926; Самойлов А. Ф., 1930; Ситерман Л. Я., 1935; Сигал А. М., 1958; Балаховский И. С.> 1965; Розенштраух Л. В. и др., 1972, 1988; Дзяк В. Н., 1979; Бровкович Э. Д., 1982; Недоступ А. В., 1982; Ку-шаковский М. С., 1984]. В современном виде эта гипотеза изложена в серии известных работ о «ведущем круге», выполненных группой исследователей во главе с М. Allessie (1973— 1984) (см. гл. 2). Другая гипотеза, согласно которой ФП вызывается частым образованием импульсов в нескольких эктопических предсердных очагах, принадлежит Т. Engelman (1884). В последующем эту концепцию поддержали D. Scherf и соавт. (1928, 1948), М. Prinzmetal и соавт. (1951). Она имеет приверженцев и в наше время, хотя число их не столь велико. Наконец, в 80-х годах появились признаки того, что многолетняя дискуссия 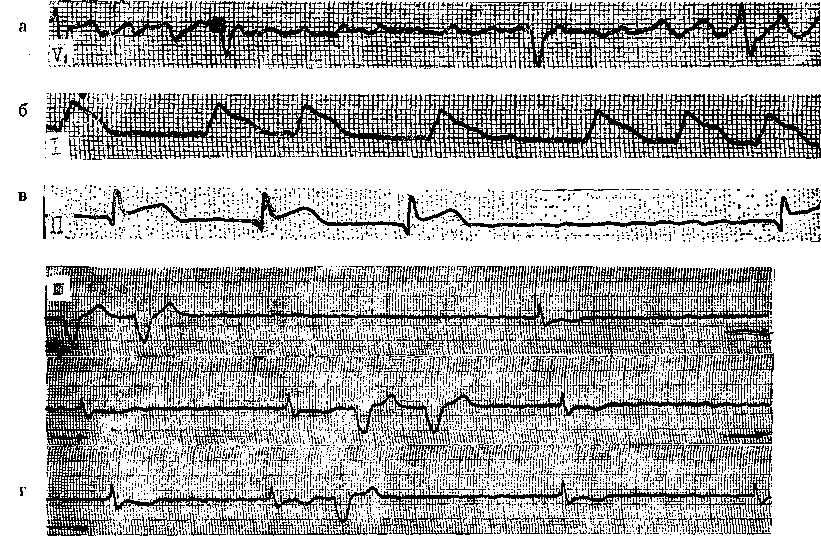 Рис. 169. а — ФП; нерегулярные волночки f различной формы и величины, интервалы R — R от 0,68 до 1,30 с; б — ФП у больного в остром периоде переднебокового инфаркта миокарда; блокада левой ножки пучка Гиса; в — ФП у больного в остром периоде нижнего инфаркта миокарда; г — фибрилляция предсердий; субтотальная АВ узловая блокада; желудочковая парасистолия с блокадой выхода II степени типа П. между сторонниками двух точек зрения может закончиться принятием синтетической теории о существовании в предсердиях при фибрилляции частой фокусной импульсации и кругового движения волн возбуждения [Розенштраух Л. В., Зайцев А. В., 1991; Hashida E. et al., 1980]. Ниже мы представим дополнительные данные о патогенезе ФП. ЭЛЕКТРОКАРДИОГРАФИЧЕСКИЕ ПРИЗНАКИ ШП Хотя источник фибрилляции находится в одном из предсердий, она, за редким исключением, тотчас же охватывает оба предсердия. В результате исчезают зубцы Р, что является основным электрокардиографическим проявлением этой аритмии. Вместо них регистрируются нерегулярные волночки различной формы и величины, неодинаковые даже в одном и том же отведении (волны f — flim-mern) (рис. 169, а, б, в, г; рис. 170). Традиционно различают 2 варианта активации мышцы предсердий при фибрилляции [Prinzmetal M. et al., 1952]. При первом из них число воли I—350—450 в 1 мин, их амплитуда превышает 0,5 мм, они появляются с относительно большей правильностью. Такую ФП называют крупноволновой, или грубоволновой. Она встречается при тиреотоксикозе, у больных, получивших полную (насыщающую) дозу дигиталиса, при введении раствора натрия гидрокарбоната больным с ацидозом, при по-  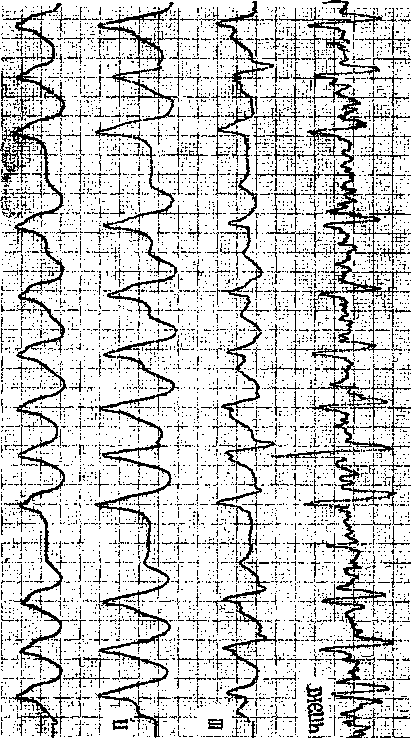 вышении оксигенации гемоглобина, после инъекции адреналина. Второй вариант ФП характеризуется еще большей частотой волн f — до 600—700 в 1 мин. Они плохо видны даже в отведениях II, III, aVF, особенно в V], где эти волночки всегда более заметны; их амплитуда меньше 0,5 мм, нерегулярность волн выражена резче, чем при первом варианте. Эта мелковолновая, или неж-новолновая, разновидность ФП чаще наблюдается у пожилых людей, страдающих кардиосклерозом, у больных, имеющих аневризму левого предсердия (пороки сердца), а также при токсической дигитализации, гиперка-лиемии. В подобных случаях как будто менее эффективной бывает электрическая дефибрилляция [De 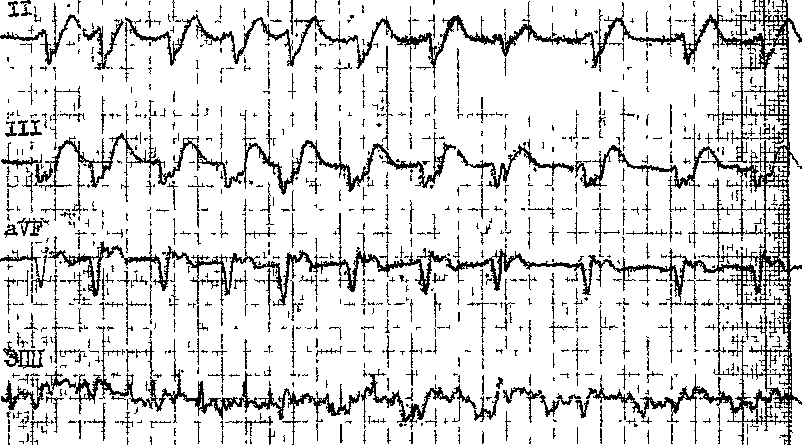 Рис. 171. Тахисистолическая форма" ФП. На ЭПП — множественные нерегулярные вол-ночки f (III тип по Waldo) Silva R. et al., 1980]. В. Olshansky, A. Waldo (1987) выделили 4 типа ФП в зависимости от формы волн А на биполярной правопредсердной ЭГ. Анализ волн фибрилляции значительно облегчается при использовании устройств, позволяющих усиливать или выделять низкоамплитудные элементы ЭКГ [Янушкевичус 3. И. и др., 1977, 1990; Праневичюс А. А., 1979; Ругенюс Ю. Ю. и др., 1981; Кибарс-кис А. X., 1981; Вайткус Э. А., 1984; Рудис А. А., 1985]. Той же цели служит регистрация ЧПЭКГ, на которой волночки f видны отчетливее. При этом нельзя не упомянуть, что амплитуда волн f не позволяет судить о размерах предсердий. Нерегулярность желудочковых сокращений, т. е. отчетливые различия в продолжительности интервалов R—R,— другой ведущий признак ФП (рис. 171). Н. Hering (1903) назвал это состояние «pulsus irregularis per-petuus» (синонимы: arrhythmia регре-tua, arrhythmia absolute, delirium cor-dis). Желудочковая аритмия связана прежде всего с хаотическим поступлением в АВ узел предсердных им- пульсов, многие из которых блокируются, поскольку под влиянием частой стимуляции удлиняется ЭРП АВ узла. Однако новые данные указывают на то, что «поведение» АВ узла во время ФП может быть более сложным, чем думали прежде. Так, J. Ro-wles, E. Rowland (1986), применив компьютерный анализ, обнаружили, что последовательность интервалов R—R была случайной только у 70% больных с ФП, у остальных 30% больных имелась корреляция (положительная или отрицательная) между последовательными интервалами R—R. Еще раньше к такому же выводу пришел Е. А. Березный (1981), установивший, что структура желудочковых ответов при ФП поддается анализу. С помощью метода корреляционной ритмографии Е. А. Березный выделил 5 типов КРГ, которые, по мнению автора, позволяют прогнозировать реакции миокарда на электрическую дефибрилляцию и лечение сердечными гликозидами. Среди факторов, влияющих на правильность проведения импульсов в АВ узле (помимо уже упомянутых), можно назвать: взаимодействие кле- ток АВ узла (их рефрактерности — Е. Raeder, 1990) с изменяющимися стимулами вегетативных нервов сердца («вегетативная буря» при ФП); так называемая «короткая память» АВ узла [Billetre J., 1981], т. е. выраженная изменчивость его электрофизиологических свойств, а также то, что АВ узел у млекопитающих, подобно СА узлу, возможно, функционирует как биологический осциллятор [van der Tweel L. et al., 1986]. Наконец, немалое значение придается механизму скрытого АВ узлового проведения: проникновению волн предсердной фибрилляции на разную глубину в АВ узел без возбуждения желудочков, но с активацией части АВ узла, затрудняющей движение последующих импульсов [Hoffman В. et al., 1961; Мое G., Abildskov J., 1964]. Зона скрытого АВ проведения, т. е. период, в течение которого оно может осуществляться, зависит от рефрактерности АВ узла и не является постоянной [Fujiki A. et al., 1990]. Как видно, вопрос о том, всегда ли пульс при ФП полностью нерегулярен („irregularly irregular"), нельзя считать риторическим, он заслуживает дальнейшего изучения. Теперь следует указать электрокардиографические признаки скрытого АВ узлового проведения: а) на фоне частых желудочковых ответов появляются два (или несколько подряд) длинных интервала R—R, каждый из которых содержит скрытые ответы клеток АВ узла; б) в период длинных желудочковых пауз отсутствуют выскальзывающие АВ импульсы, что указывает на скрытую разрядку автоматических центров АВ соединения; в) в момент перехода ФП в ТП иногда наблюдается ускорение желудочкового ритма за счет того, что более медленное возбуждение предсердий и уменьшение числа предсердных импульсов сопровождается исчезновением скрытого проведения в АВ узел. При неконтролируемой ФП интакт-ный АВ узел может проводить к желудочкам до 110—150 и изредка — до 220 импульсов в 1 мин. Эту форму ФП называют тахикардической, или тахисистолической. На фоне очень частого сердечного ритма нерегулярность интервалов R—R сглаживается, и для ее выявления требуются тщательные измерения. Число желудочковых сокращений при ФП возрастает во время предпринимаемых больным физических усилий. Удлинение ЭРП АВ узла, узловая блокада приводят к урежению сокращений сердца. Частота желудочковых ответов ^ 60 в 1 мин характерна для бра-дикардической или брадисистоличе-ской, формы ФП. Обычно при хронической ФП (дольше 6 нед) сердце сокращается реже, чем при острой, па-роксизмальной ФП. Однако и у больных с хронической ФП могут наступать периоды выраженного учащения сердечной деятельности, что связано с временным укорочением ЭРП АВ узла. Желудочковые комплексы QRS при ФП сохраняют нормальный вид либо же становятся аберрантными. Последние бывает трудно отличить от ЖЭ, появляющихся на фоне ФП, особенно в период дигиталисной интоксикации. Распознавание тех и других комплексов QRS имеет практическое значение, поскольку токсическая экстрасистолия — указание на необходимость прервать дигитализа-цию, тогда как аберрантность желудочковых комплексов не препятствует ее продолжению. При дифференциальном диагнозе учитывают, что: а) аберрантные комплексы QRS часто следуют за длинным предшествующим интервалом R—R, их собственный интервал R—Ra6ep. обыЧНО бывает КОРОТКИМ (феномен Ашмана, или феномен «длинный-короткий цикл», отражающий известное правило: длительность рефрактерного периода в системе Ги-са—Пуркинье прямо пропорциональна длине предшествующего цикла) [Ashman R., 1947]; дигиталисные ЖЭ имеют одинаковый интервал сцепления R—rskctp ; б) форма аберрантных комплексов QRS напоминает неполную (реже — полную) блокаду правой ножки пучка Гиса (rSR' в отведении V]) с сохранением нормальных начальных электрических сил QRS; ЖЭ имеют MOHO-(R,QS)-или двухфазную (QR, RS) форму комплексов QRS с изменением начальных электрических сил; в) интервалы после аберрантных комплексов R36ep.—R бывают различной длины, тогда как вслед за желудочковой экстрасистолой пауза удлиняется («компенсаторная пауза» предсерд-ной фибрилляции, по R. Langendorf, 1951). Е. Pritchett и соавт. (1980) показали, в частности, что если у больного с ФП вызвать искусственный желудочковый экстрастимул, то пауза после него удлинится на 107— 136 мс по сравнению со средним циклом; г) на Гис-электрограмме перед аберрантным комплексом QRS (волна V) расположен Н потенциал, которого нет перед ЖЭ. Наконец, необходимо помнить, что быстро следующие друг за другом аберрантные желудочковые комплексы могут имитировать приступ желудочковой тахикардии. ТРЕПЕТАНИЕ ПРЕДСЕРДИЙ В 1887 г. J. McWilliam впервые наблюдал у собаки ТП, вызванное воздействием фарадического тока. У человека оно было зарегистрировано на ЭКГ W. Jolly и W. Ritchie (1909). В 1913 г. Т. Lewis указал электрокардиографические признаки ТП, которые сохранили свое значение до нашего времени. В отличие от фибрилляции ТП — правильный, координированный предсердный рищм с частотой, превышающей уровень надже-лудочковых пароксизмальных тахикардии. Среди гипотез, выдвинутых для объяснения механизмов ТП, наибольшим признанием пользуется гипотеза macrore-entry [Самойлов А. Ф., 1930; Розенштраух Л. В. и др., 1972, 1978; Lewis Т. et al., 1921; Rosenble-uth A., Garsia Ramos J., 1947; Wells J. et al., 1979; Watson R., Jo-sephson M., 1980; Boyden P., 1988]. Поскольку характеристика macrore-entry была дана в гл. 2, мы ограничимся лишь некоторыми дополнительными сведениями. В свое время Т. Lewis и соавт. (1921) высказали предположение, что импульс во время трепетания совершает круговое движение, направляясь вниз по стенке правого предсердия и вверх — по стенке левого предсердия. В 1975 г. W. McAlpin указал уже 15 теоретически возможных кругов macrore-entry в предсердиях. По его расчетам, длина самого короткого крута, огибающего одну легочную вену, должна была бы равняться 3—6 см. Длина самого большого круга, огибающего устья всех предсердных вен (верхней и нижней полых, правых и левых легочных), достигала бы 26 см. Между тем в реальных условиях, в нерасширенных, неизмененных предсердиях такие длинные петли не могут «существовать», так как интакт-ные пучки мышечных волокон между отверстиями вен будут «закорачивать» эти петли. Если же предсерд-ная мышца изменена и проводимость в отдельных ее участках замедлена, то появляются условия для кругового движения импульса даже в нерасширенных предсердиях. На это указывают математические выкладки M. Allessie и F. Bonke (1980), которые мы приводим в сокращенном виде. При нормальной скорости проведения импульса в предсердиях около 0,7 м/с для возникновения macrore-entry понадобилась бы длина круга от 12 до 20 см, что практически невозможно. Если же скорость проведения в предсердиях понижается до 0,4 м/с, то анатомическое препятствие с периметром в 9 см оказывается достаточным для кругового движения волны с частотой 300 в 1 мин. По мнению G. Pastelin и соавт. (1978^, петля трепетания иногда включает специализированные проводящие тракты предсердий. Допускается также, что движение может, помимо прочего, происходить вокруг коронарного синуса. A.Waldo (1987) полагает, что ТП может быть следствием macrore-entry в правом предсердии, тогда как левое предсердие функционирует подобно «невинному свидетелю». Основываясь на результатах эп-докардиального картографирования предсердий, F. Gosio и соавт. (1990) пришли к выводу, что ТП («типичное») связано с движением волны возбуждения вокруг кольца трехстворчатого клапана (против часовой стрелки: в каудокраниальном направлении по межпредсерднои перегородке и в краниокаудальном — по боковой и передней стенкам правого предсердия). Гипотезу об эктопическом очаге (фокусе) с очень частыми разрядами, вызывающими ТП, разрабатывали в свое время М. Prinzmetal и соавт. (1952), D. Scherf и соавт. (1963). Прямая регистрация хода возбуждения в предсердиях в период трепетания, а также данные, полученные при электрической стимуляции предсердия, показывают, что эта точка зрения позволяет понять особенности некоторых вариантов ТП [Kishon J., Smith К., 1969; Rosen К. et al., 1969; WellensH. et al., 1971]. Как и в отношении ФП, Е. Hashi-da и соавт. (198СИ разработали гипотезу о сочетании при ТП частой фокусной импульсации с круговым движением волны возбуждения. Здесь уместно еще раз коснуться общего вопроса о том, как в современной электрофизиологии понимают термин «генерирующий фокус» в миокарде. Он отнюдь не всегда означает точечную активность, поскольку может занимать более широкую, хотя и ограниченную, зону, например площадь 1,5X1,5 см, что было показано в экспериментальной работе М. Allessie и соавт. (1977). Такой автоматический или триггерный фокус иногда формируется в коронарном синусе или в створках митрального клапана. Однако фокусную (очаговую) активность может имитировать и петля re-entry вокруг устья легочной вены, коронарного синуса или полой вены [Allessie M. et al., 1977]. О локализованном re-entry как возможной причине «фокусного» ТП сообщают В. Olshansky и соавт. (1986). ЭЛЕКТРОКАРДИОГРАФИЧЕСКИЕ ПРИЗНАКИ ТП В зависимости от того, какую форму имеют волны трепетания F (Flatter) различают «типичное», или «классическое», ТП [Lewis Т., 1913J и «атипичное», или «необычное», ТП [Prinzmetal M. et al., 1952]. В первом случае на ЭКГ в отведениях II, III, aVF регистрируется пилообразная базальная линия с положительной и отрицательной фазами волн F, переходящими непосредственно друг в друга; отрицательная фаза более пологая и протяженная (рис. 172). В отведении Vi волны F часто бывают представлены небольшими двухфазными зубцами с изо-электрической линией между ними. В отведениях I, aVL, Vs-e волны трепетания не всегда различимы. Частота предсердного ритма — около 280—320 в 1 мин. При гипер-тиреозе иногда достигается крайняя частота ТП — до 400 в 1 мин. Дигиталис может слегка ускорять трепетание, укорачивая рефрактерный период предсердий. Хинидин (рис. 173) и другие противоаритмические препараты I класса урежают трепетание за счет удлинения рефрактерности в предсердиях: число волн F может уменьшаться до 200 в 1 мин, они становятся очень широкими. L. Katz (1956) наблюдал больного, у которого под воздействием хинидина число волн ТП снизилось до 120 в 1 мин, при этом длина волны (F) трепетания стала очень протяженной. Атипичная, необычная разновидность ТП встречается намного реже, чем типичная. Она представлена: а) краниальной формой (положительные однофазные волны F в отведениях II, III, aVF, они отделены друг от друга изоэлектрической линией) — около 15% всех случаев ТП; б) каудалъной формой (Отрицатель- 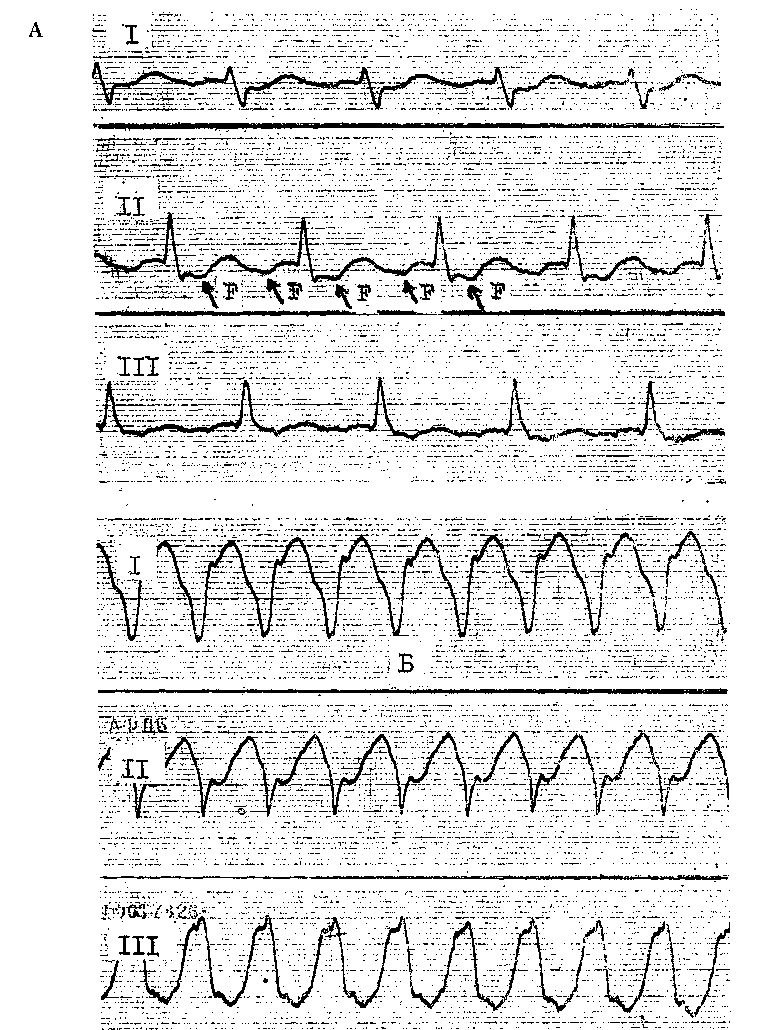 Рис. 174. Пароксизм ТП у больной 30 лет, страдавшей митральным стенозом. Интервалы F — Р = 240 мс (250 в 1 мин); АВ узловая блокада 2:1 (А). Перед ЭИТ больной внутримышечно ввели 1 мл 2% раствора промедола и 0,5 мл 0,1% раствора атропина, что не повлияло на ритм. Через 30 мин после преме-дикации начато внутривенное введение 1% раствора гексенала для достижения наркоза. Вслед за инъекцией 50 мг препарата число желудочковых комплексов внезапно возросло в 2 раза, появилась тахизависимая блокада ножки (В) — ТП с АВ проведением 1:1. АД снизилось до 90/50 мм рт. ст., больная побледнела, покрылась потом. Синусовый ритм восстановлен с помощью ЭИТ. 456 Рис 175 У больного С 53 лет пароксизмы ТП возникали на фоне ожирения и дистрофии миокарда. Слева 1П (250 в 1 мин), АВ узловое проведение 3 2, 4 3, 3 2, в отдельных комплексах QRS признаьи блокады передневерхнего разветвления левой ножки Вслед за внутривенным введением 200 мг тиопентала натрия внезапно возникла регулярная форма ТП с АВ проведением 1 1 (250 в 1 мин) После ЭИТ быч восстановлен синусовый ритм (для наркоза понадобилось 600 мг тиопентала натрия) 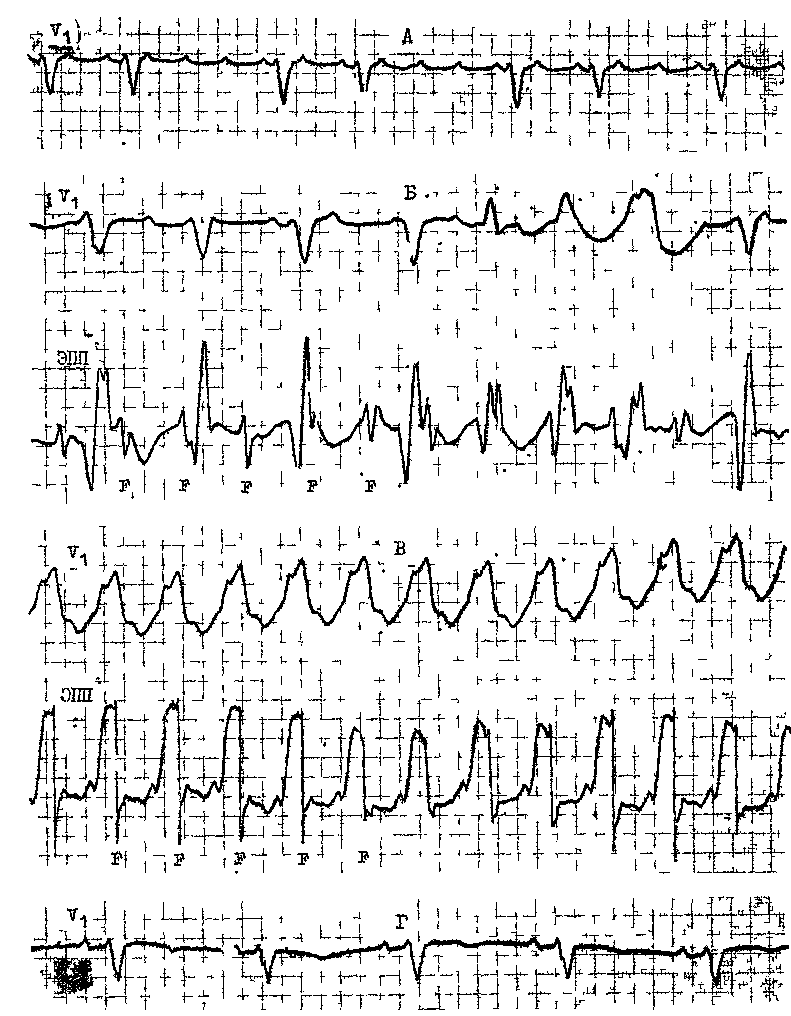 Рис 176 У больного R. 44 лет пароксизмы ТП возникали вследствие дистрофии карда алкогольно токсического происхождения интервалы F—R также оказываются постоянными, чем обеспечивается правильность желудочкового ритма. В случае АВ блокады 2:1 число сердечных сокращений велико: 140— 160 в 1 мин, при АВ проведении 4:1 сердце сокращается с нормальной частотой (70—80 в 1 мин), что иногда вводит в заблуждение врача. Ритм сердца (желудочков) становится нерегулярным, если АВ узловая блокада неустойчива, т. е. возникают переходы от блокады 2:1 к 4:1, изредка к нечетным соотношениям типа 3:1 и т. д. На длину интервалов R—R оказывает влияние и продолжительность интервалов F—R в проведенных к желудочкам волнах трепетания. У некоторых больных можно видеть периодику Самойлова — Венке-баха интервалов F—R с блокированием последней волны F в периодике. Как нарастание блокады в АВ узле, так и колебания интервалов F—R часто бывают следствием скрытого АВ узлового проведения внешне блокированных волн F. Таким образом, в части случаев ТП сокращения сердца могут быть столь же нерегулярными, что и при ФП. Обе эти родственные по патогенезу и клиническим проявлениям формы аритмии нередко объединяют под названием «мерцательная аритмия» [Ланг Г. Ф., 1916, 1958; Кедров А. А., 1971]. Ch. Homey и соавт. (1979) описали ТП с блокадой выхода. Сначала у больного было зарегистрировано типичное трепетание с частотой волн F 290 в 1 мин и АВ узловой блокадой 2:1. Затем предсердный ритм самопроизвольно сократился до 145 волн F в 1 мин при сохранении АВ блокады 2:1. Далее вновь произошло ускорение трепетания до 290 в 1 мин. При каждой перемене ритма форма и полярность волн F оставались одинаковыми. Авторы подчеркивают, что наблюдавшаяся ими блокада выхода может рассматриваться как факт, подкрепляющий гипотезу о существовании единого (фокусного) генератора импульсов при некоторых формах этой аритмии, Комплексы QRS во многих случаях ТП сохраняют узкий (наджелудоч-ковый) вид. Однако при частых желудочковых ответах могут возникать аберрации этих комплексов в форме неполной блокады правой ножки пучка Гиса. Если же появляется полная тахизависимая блокада ножки, то это может служить указанием на скрытый дефект внутрижелудочко-вой проводимости. Комплексы QRS деформируются и за счет наложения на них волн трепетания, иногда создавая иллюзию электрической альтернации этих комплексов [Mittal S. et al., 1987]. Степень смещения книзу сегментов ST и уплощения (инверсии) зубцов Т зависит от ряда причин: частоты желудочкового ритма, коронарной недостаточности, гипертрофии левого желудочка и т. д. Регулярные желудочковые ответы с широкими комплексами QRS при ТП могут имитировать приступ ЖТ. Правда, в отведениях Vi и Д удается выявить регулярные волны F, что дает ключ к правильному диагнозу. Следует рассмотреть переходную форму между фибрилляцией и трепетанием предсердий — так называемое нечистое трепетание, или Fibrillo-Fla-tter. Этот диагноз ставится не всегда точно, в частности в тех случаях, когда интервалы F—F одинаковы, но волны F полиморфны. Скорее, здесь речь должна идти просто о ТП, поскольку неодинаковая форма волн F может зависеть от изменений проекции векторов F на линию отведения или от других причин. Что же касается истинных случаев «нечистого трепетания», то, по-видимому, это явление неоднородное. Можно себе представить, что у некоторых больных неустойчивость электрофизиологических условий в миокарде предсердий бывает причиной временного раздробления больших кругов re-entry на многочисленные круги microre-entry с последующим восстановлением macrore-entry и т. д. Другой механизм такой своеобразной предсердной аритмии был указан С. Leier и S. Schaal (1980). При ре- гистрации несколькими катетерами-электродами ЭГ правого и левого предсердий они установили, что у 62% больных с электрокардиографическим синдромом «фибрилляция-трепетание» предсердий имелись разобщенные предсердные ритмы: трепетание в одном предсердии, фиб-рилляция — в другом; трепетание в одном участке правого предсердия, фибрилляция — в остальной части того же предсердия; различная частота трепетания в области правого предсердия. У остальной трети больных отмечался чрезвычайно высокий темп трепетания (интервалы F—F^ 170 мс) либо происходило фрагмен-тирование волн F. Аналогичные наблюдения были сделаны в нашей клинике [Кушаковский М. С., Гриш-кин Ю. Н., 1990]. |
