Эрнандес Е.И. - Косметический пилинг - теоретические и практические аспекты. Эрнандес Е.И. - Косметический пилинг - теоретические и практичес. Сборник статей. Общ ред. Е. И. Эрнандес. М. Ооо Фирма Клавель
 Скачать 3.86 Mb. Скачать 3.86 Mb.
|
|
Часть I. Биологическое действие AHA. Принципы создания АНА-косметики Елена Эрнандес Марина Крючкова Вступление Впервые появившись в составе косметических средств в начале 90-х гг., а-гидроксикислоты (alpha hydroxy acids, AHA) стремительно завоевали косметический рынок. Сегодня это одни из самых популярных ингредиентов разнообразных косметических продуктов. В материале, подготовленном нашей редакцией совместно со специалистами сырьевых компаний, консультантами известных профессиональных косметических линий и практикующими врачами, мы расскажем о биологических эффектах AHA в коже, о принципах разработки АНА-содержащих препаратов и об их использовании в косме-тологической практике. Что такое AHA Органические вещества, в которых имеются различные функциональные группы, называются соединениями со смешанными функциями. К таким соединениям относятся и гидроксикислоты, у которых наряду с кислотной (карбоксильной) группой -СООН имеется гидро-ксильная (спиртовая) группа -ОН. Согласно распространенному варианту номенклатуры углеродный атом, к которому присоединена карб 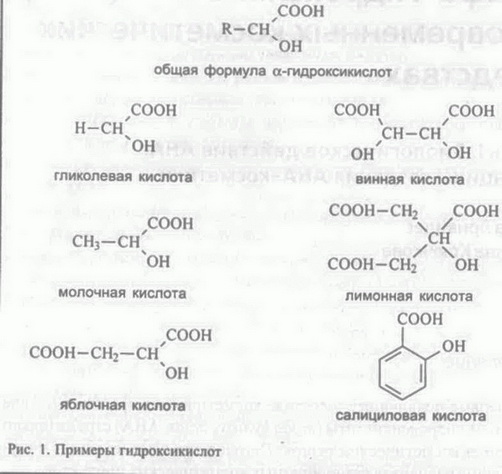 оксильная группа, обозначают буквой а, следующий за ним углерод — (3 и так далее, в соответствии с греческим алфавитом. В случае достаточно длинных цепей наиболее удаленный от карбоксила атом обычно обозначают со. Соответственно, если гидроксильная группа находится у а-атома углерода, то такое соединение называется а-гид-роксикислотой (AHA), у (3-атома — (3-гидроксикислотой (ВНА) и т. д. (рис. 1). оксильная группа, обозначают буквой а, следующий за ним углерод — (3 и так далее, в соответствии с греческим алфавитом. В случае достаточно длинных цепей наиболее удаленный от карбоксила атом обычно обозначают со. Соответственно, если гидроксильная группа находится у а-атома углерода, то такое соединение называется а-гид-роксикислотой (AHA), у (3-атома — (3-гидроксикислотой (ВНА) и т. д. (рис. 1).В природе наиболее распространены се-гидроксипроизводные кар-боновых кислот (AHA). Их получают из Сахаров ряда растений, а также из некоторых биологических субстанций. Например, гликолевая кислота выделяется из сахарного тростника, молочная — из скисшего молока, винная — из старого вина, лимонная — из плодов цитрусовых, а яблочная, как нетрудно догадаться, — из яблок. Гидрокси-кислоты, полученные из фруктов, часто называют фруктовыми кислотами. носн2соосн2соон о/ : \о (С2Н202)х гликолид СОСН2 полигликолид карбоксиметилгидроксиацетат Рис. 2. Соединения, полученные в результате реакции молекул гликолевой кислоты друг с другом Г 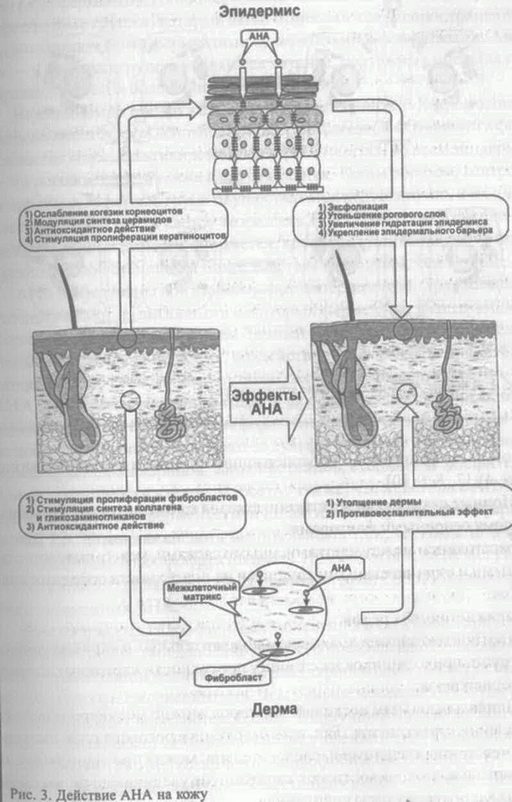 ликолевая (оксиуксусная) кислота — первая и самая маленькая в ряду гидроксикислот: она содержит всего два углеродных атомов. Как и другие AHA, гликолевая кислота растворима в высокополярных растворителях (воде, метаноле, этаноле, ацетоне, уксусной кислоте, этилацетате), малорастворима в этиловом эфире и практически не растворима в неполярных гидрофобных предельных углеводородах. Молекулы гликолевой кислоты, реагируя друг с другом, способны превращаться в линейные полиэфирные олигомеры, циклические димеры гликолиды, линейные димеры и полимеры (рис. 2). В сочетании с другими AHA гликолевая кислота может также образовывать биоразлагаемые сополимеры сложноэфирной природы. Свойства этих сополимеров (скорость разложения, растворимость в воде и др.) определяются их составом и молекулярным весом. Из малорастворимых в воде сополимеров изготавливают микросферические частицы, которые считаются перспективными переносчиками лекарственных препаратов [1, 2, 3, 4]. ликолевая (оксиуксусная) кислота — первая и самая маленькая в ряду гидроксикислот: она содержит всего два углеродных атомов. Как и другие AHA, гликолевая кислота растворима в высокополярных растворителях (воде, метаноле, этаноле, ацетоне, уксусной кислоте, этилацетате), малорастворима в этиловом эфире и практически не растворима в неполярных гидрофобных предельных углеводородах. Молекулы гликолевой кислоты, реагируя друг с другом, способны превращаться в линейные полиэфирные олигомеры, циклические димеры гликолиды, линейные димеры и полимеры (рис. 2). В сочетании с другими AHA гликолевая кислота может также образовывать биоразлагаемые сополимеры сложноэфирной природы. Свойства этих сополимеров (скорость разложения, растворимость в воде и др.) определяются их составом и молекулярным весом. Из малорастворимых в воде сополимеров изготавливают микросферические частицы, которые считаются перспективными переносчиками лекарственных препаратов [1, 2, 3, 4].Водорастворимые формы AHA используются в дерматологических и косметических препаратах, в составе которых они воздействуют на состояние кожи на молекулярном, клеточном и тканевом уровнях. Биологические эффекты AHA Первое упоминание о накожном применении гликолевой кислоты относится к 1974 г [5]. Van Scoth и Yu, изучая действие различных препаратов при ихтиозе, обнаружили, что гликолевая кислота способна контролировать процесс кератинизации эпидермиса, ослабляя сцепление между корнеоцитами. Аналогичное действие было обнаружено и у других AHA. Впоследствии была установлена терапевтическая эффективность AHA при любых формах гиперкератоза. Дальнейшие исследования показали, что AHA легко преодолевают роговой слой, достигают нижних слоев эпидермиса и даже проходят через базальную мембрану в дерму (рис. 3). Отшелушивающее действие Один из основных эффектов AHA — отшелушивающий — связан с их способностью ослаблять сцепление.(когсзию) корнеоцитов [6]. AHA не вызывают дезагрегации корнеоцитов верхних слоев рогового слоя, а влияют на когезию корнеоцитов в его нижних, более молодых, слоях (рис. 3). Этим они принципиально отличаются от истинных кератолити-ческих агентов — сильных кислот, щелочей, тиолов и таких денатурирующих веществ, как мочевина и соли лития в высоких концентрациях. Толщина рогового слоя в норме и патологии определяется двумя противоположными факторами — теми, которые ослабляют когезию корнеоцитов, и теми, которые ее усиливают. В когезии корнеоцитов принимают участие как ковалентные (например, дисульфидные, пептидные и межсахаридные), так и различные нековалентные (в том числе ионные) связи. Самая распространенная нековалентная связь, не имеющая выраженного ионного характера, — это водородная связь. Она очень слабая и легко разрушается такими агентами, как бромид лития, мочевина и щелочи, действующими как химические денатуранты (хаотропные, т. е. разупорядочивающие реагенты). Межмолекулярная водородная связь ослабляется также при разбавлении водой из-за конкуренции между молекулами растворенного вещества и самими молекулами воды, весьма склонными к водородному связыванию. Ионные связи возникают между противоположно заряженными группами — отрицательными (например, карбоксильная, сульфатная, фосфатная) и положительными (аминогруппы основных аминокислот). Н 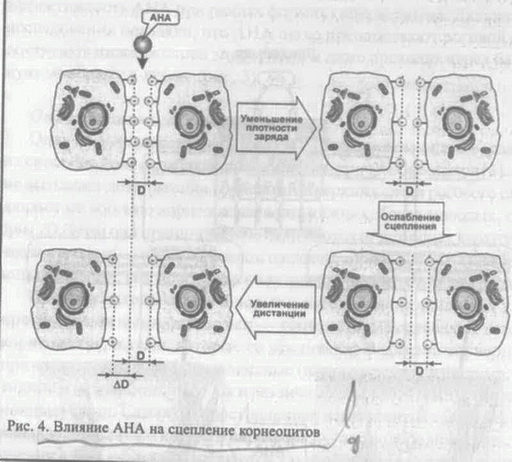 апомним, что роговой слой эпидермиса состоит йз корнеоцитов (роговых клеток), между которыми имеется скрепляющая их липид-ная прослойка. Эта прослойка наиболее развита в середине рогового слоя, однако на уровне перехода гранулярного слоя в роговой эта прослойка выражена еще слабо. Здесь между клетками все еще имеется водная фаза, и когезия корнеоцитов осуществляется в основном за счет ионных взаимодействий. Эти взаимодействия обусловлены наличием на поверхности клеток заряженных групп различных биомолекул, входящих в состав клеточных мембран, — мукополисахаридов, гликопротеинов, серосодержащих стеринов и фосфолипидов (рис. 4) [7, 8,9,10]. апомним, что роговой слой эпидермиса состоит йз корнеоцитов (роговых клеток), между которыми имеется скрепляющая их липид-ная прослойка. Эта прослойка наиболее развита в середине рогового слоя, однако на уровне перехода гранулярного слоя в роговой эта прослойка выражена еще слабо. Здесь между клетками все еще имеется водная фаза, и когезия корнеоцитов осуществляется в основном за счет ионных взаимодействий. Эти взаимодействия обусловлены наличием на поверхности клеток заряженных групп различных биомолекул, входящих в состав клеточных мембран, — мукополисахаридов, гликопротеинов, серосодержащих стеринов и фосфолипидов (рис. 4) [7, 8,9,10].Ионные связи и соответственно когезия корнеоцитов определяются тремя основными факторами:
Влияя на один или несколько факторов, можно модулировать силу сцепления корнеоцитов. Так, при гидратации рогового слоя дистанция между корнеоцитами и, следовательно, между противоположными зарядами клеточных стенок корнеоцитов увеличивается, что приводит к снижению силы сцепления. Что касается распределения и плотности различных заряженных групп на поверхности клеток, то этот процесс находится иод контролем ряда ферментов. Наиболее «мобильными» являются сульфатные и фосфатные группы, которые легко отщепляются распространенными эпидермальными ферментами сульфатазами и фосфатазами. Ами-н0 — и карбоксигруппы удаляются труднее, поэтому их число на поверхности клеток более или менее постоянно. Недавно было обнаружено, что при сцепленном с Х-хромосомой ихтиозе имеется врожденный дефицит сульфатазной активности в фиб-робластах кожи, культивированных кератиноцитах, во всем эпидермисе и в роговом слое, а также в других тканях. Таким образом, контроль за числом сульфатных групп осуществляется недостаточно, и их плотность на поверхности клеток возрастает. В результате сила сцепления между корнеоцитами увеличивается, процесс слущивания тормозится и роговой слой становится более толстым и плотным, чем в норме. AHA эффективны при любой форме гиперкератоза. Предполагают, что они влияют на активность некоторых ферментов, участвующих в формировании ионных связей. Точный механизм этого процесса до конца неясен. Судя по всему, воздействие на ферменты происходит одновременно несколькими путями (рис. 5). Например, известно, что AHA могут замещать сульфатные и фосфатные группы в реакциях, катализируемых сульфаттрансферазами, фосфотрансферазами и ки-назами. Эти ферменты отвечают за сульфатирование и фосфорилиро-вание мукополисахаридов, гликопротеинов, стеринов и фосфолипидов на поверхности клеток. Известно также, что некоторые AHA напрямую угнетают ферментативную активность фосфотрансфераз и киназ. Так, лимонная кислота значительно ингибирует глюкозо-6-фос-фотрансферазу и фосфофруктокиназу. Помимо этого, AHA могут выступать в качестве акцепторов фосфатных групп с образованием фос-форилированных AHA. Д 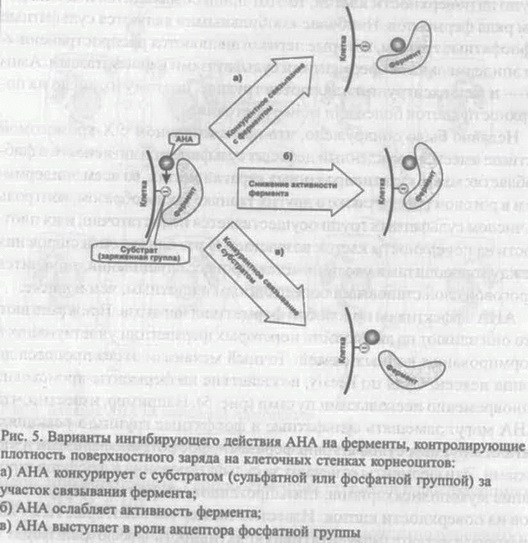 ля маленьких гидрофильных молекул AHA роговой слой не является преградой: они довольно легко его преодолевают и оказываются в межклеточной водной среде гранулярного слоя, где вступают во взаимодействие с корнеоцитами. Чем меньше молекула AHA, тем лучше она проходит через роговой слой. Наилучшей проникающей способностью обладает гликолевая кислота именно в силу своих маленьких размеров [11,12]. В отличие от гидрофобных ретиноидов, AHA не нуждаются в специальных связывающих их рецепторах на плазматических мембранах клеток [13]. Ослабление сцепления корнеоцитов на уровне гранулярного слоя способствует их более быстрому продвижению в роговой слой и последующему отторжению (эксфолиации). Это служит сигналом к делению и дифференцировке лежащих ниже кератиноцитов. Таким образом, жизненный цикл основных клеток эпидермиса — от базальной клетки (кератиноцита) до роговой чешуйки (корнеоцита) — сокращается. Вместе с этим уменьшается и толщина рогового слоя, которая определяется скоростью обновления эпидермиса и скоростью слущивания чешуек с поверхности кожи. ля маленьких гидрофильных молекул AHA роговой слой не является преградой: они довольно легко его преодолевают и оказываются в межклеточной водной среде гранулярного слоя, где вступают во взаимодействие с корнеоцитами. Чем меньше молекула AHA, тем лучше она проходит через роговой слой. Наилучшей проникающей способностью обладает гликолевая кислота именно в силу своих маленьких размеров [11,12]. В отличие от гидрофобных ретиноидов, AHA не нуждаются в специальных связывающих их рецепторах на плазматических мембранах клеток [13]. Ослабление сцепления корнеоцитов на уровне гранулярного слоя способствует их более быстрому продвижению в роговой слой и последующему отторжению (эксфолиации). Это служит сигналом к делению и дифференцировке лежащих ниже кератиноцитов. Таким образом, жизненный цикл основных клеток эпидермиса — от базальной клетки (кератиноцита) до роговой чешуйки (корнеоцита) — сокращается. Вместе с этим уменьшается и толщина рогового слоя, которая определяется скоростью обновления эпидермиса и скоростью слущивания чешуек с поверхности кожи.Дисбаланс между процессами эксфолиации и деления клеток базального слоя в сочетании с нарушенной дифференцировкой кератиноцитов лежит в основе ряда патологий, таких, как гиперкератоз (ихтиоз, кератодермин), паракератоз (псориаз), дискератоз (болезнь Дарні,с. болезнь Боуэна). В стареющей коже снижение митотической активности клеток базального слоя обычно сопровождается замедленной эксфолиацией, что приводит к утолщению рогового слоя. В этих случаях применение АНА-препаратов вполне оправданно, поскольку результатом их действия является уменьшение толщины рогового слоя и более быстрое обновление эпидермиса. Влияние па барьерную функцию рогового слоя Возникает вопрос: не приведет ли усиленное шелушение к ослаблению барьерной функции рогового слоя? Fartasch с соавт. провели серию экспериментов, в которых с помощью морфологических и биофизических методов исследовали действие AHA на роговой слой [14]. В течение трех недель на внутреннюю сторону предплечья добровольцев дважды в день наносили 4%-й препарат гликолевой кислоты, а затем обработанный участок подвергали биопсии. С помощью электронной микроскопии изучали: 1) морфологию и толщину рогового слоя, 2) ламеллярные тельца и организацию липидных пластов и 3) адгезию корнеоцитов. Кроме того, проводилась оценка транеэпидер-мальной потери воды (ТЭПВ) и степени гидратации рогового слоя до и после обработки. Оказалось, что в ядерных слоях эпидермиса никаких морфологических изменений не произошло: в клетках гранулярного слоя присутствовали нормальные ламеллярные тельца, а структура липидной прослойки в роговом слое после обработки кожи гликолевой кислотой не изменилась. Показатель ТЭПВ, по которому судят о барьерных свойствах рогового слоя, также не изменился. Эти данные наряду с данными других авторов свидетельствуют о том, что AHA специфически действуют на когезию корнеоцитов, не нарушая при этом барьер рогового слоя [15]. Более того, есть сведения, что некоторые AHA положительно влияют на синтез церамидов — важнейших компонентов межклеточных липидных пластов рогового слоя. Изучая действие изомеров молочной кислоты на биосинтез церамидов и состояние барьера рогового слоя, ученые из компании Unilever обнаружили, что молочная кислота не только увеличивает общее количество церамидов в роговом слое, но и модулирует тип церамидов, синтезируемых в клетках [16]. Как известно, особую роль в поддержании целостности рогового слоя играют церамиды 1 [17]. В их состав входят длинноцепочечные полиненасыщенные жирные кислоты, преимущественно линолевая кислота (75-80%) [18]. Они играют роль заклепок в липидных структурах рогового слоя, пронизывая соседние липидныс пласты и скрепляя их друг с другом. При дефиците линолеат-содержащих церамидов 1 нормальная структура липидного барьера нарушается, в результате чего увеличивается проницаемость рогового слоя. Это происходит при атопическом дерматите, дефиците незаменимых жирных кислот, акне. В экспериментах in vivo и in vitro было показано, что L-энантио-мер (оптический изомер) молочной кислоты стимулирует синтез церамидов 1, содержащих полиненасыщенные жирнокислотные хвосты. При суточной инкубации культуры кератиноцитов человека в среде, содержащей 20 мМ молочной кислоты, меняется качественный состав синтезируемых липидов: помимо церамидов 2, характерных для липидного обмена клеток в культуре, появляются церамиды 1 и 3. Качественный анализ церамидов 1 после месячной аппликации 4%-го водного раствора L-молочной кислоты на предплечье добровольцев показал, что соотношение линолеат- и олеат-содержащих церамидов 1 резко возрастает [16]. Эффект зависел оттого, какой из оптических изомеров молочной кислоты использовался [16]. В экспериментах in vitro L-форма была гораздо эффективнее, чем D-форма (увеличение синтеза церамидов на 300 и 100% соответственно). В экспериментах in vivo эффективным оказался только L-изомер. Так, лосьон с L-формой повышал синтез на 48%, с DL-формой — на 25%, а лосьон на основе D-фор-мы не оказывал никакого эффекта. О влиянии на барьерную функцию эпидермиса свидетельствуют измерения ТЭПВ на участке кожи, предварительно раздраженной лаурилсульфатом натрия. Обработка этого участка L-молочной кислотой ускорила восстановление барьера, в то время как D-форма оказалась неэффективной [16]. Описанное в работе влияние AHA на биохимию эпидермальных липидов является одним из немногих известных механизмов их действия на состояние эпидермиса [16]. Увлажняющее действие Уменьшение когезии корнеоцитов влияет еще на один очень важный параметр, во многом определяющий внешний вид кожи, — на гидратацию эмидермиса.' Существенный вклад в общую гидратацию эпидермиса вносит вода', которую удерживает комплекс гигроскопичных молекул, называемый натуральным увлажняющим фактором (natural moisturizing factor, NMF). Находясь в корнеоцитах, NMF обеспечивает упругость и механическую прочность роговых чешуек. NMF лучше развит в более молодых корнеоцитах [19]. По мерс продвижения корнеоцитов к noBepxHocnrNMF постепенно деградирует, и роговые чешуйки становятся более сухими и ломкими. Быстрое слущйва-нис роговых чешуек и обновление эпидермиса приводит к тому, что в коже повышается содержание функционально активного NMF и, следовательно, связанной с ним воды. Наилучший увлажняющий эффект характерен для молочной кислоты, которая, помимо всего прочего, непосредственно входит в состав NMF [20, 21, 22, 23]. Содержание воды в результате действия AHA повышается и за счет других факторов. Так, гигроскопичные молекулы AHA способны связывать воду и, проникая в кожу, доставлять ее в глубокие слои эпидермиса. Кроме того, укрепление барьерной функции эпидермиса, а также стимуляция синтеза гликозаминогликанов (см. ниже) повышает водосберегающие и водоудерживающие свойства кожи [24]. Противовоспалительное и антиоксидантное действие "ЛІТА обладают противовоспалительным действием, оказывая влияние на медиаторы воспаления, снижая выработку супероксида и гидроксил-радикала, участвуя в функционировании В- и Т-лимфоцитов. Интересные и на первый взгляд несколько неожиданные данные о фотозащитном и противовоспалительном действии гликолевой кислоты были получены Perricone и DiNardo [25]. Было решено проверить распространенное мнение о том, что обработка кожи гликолевой кислотой повышает чувствительность кожи к солнечному излучению, иными словами, вызывает фотосенсибилизацию кожи. Было проведено две серии экспериментов. В первой серии на основе эритемной реакции оценивали противовоспалительный потенциал гликолевой кислоты. Два симметричных участка на спине добровольцев трижды облучали минимальной эритемной дозой (МЭД) УФ-В. Через 4 ч после облучения на один участок наносили крем с гликолевой кислотой (эмульсия типа «масло-в-воде», 12%-я гликолевая кислота, частично нейтрализованная гидроксидом аммония до рН 4,2), а на другой — крем-плацебо. Обработку участков кремом проводили 4 раза в день. Через 48 ч после последней аппликации крема оценивали размеры эритемы. Было отмечено значительное уменьшение эритемы на том участке, который обрабатывался кремом с гликолевой кислотой. Во второй серии экспериментов облучению подвергли четыре участка на спине добровольцев:
Оказалось, что степень эритемы на участке 2, который после облучения обрабатывался АНА-продуктами, была на 16% меньше, чем на контрольном участке 1. Это говорит о том, что при обработке гликолевой кислотой кожа заживает быстрее. Сравнение участков 1 и 3 показало, что предварительная обработка кожи гликолевой кислотой повышает ее устойчивость к облучению в 2,4 раза. Химический пилинг кожи перед облучением (участок 4) снижает солнцезащитные свойства кожи почти в 2 раза по сравнению с участком 3, однако даже в этом случае устойчивость кожи к облучению в 1,7 раза выше по сравнению с контрольным участком 1. Полученные данные свидетельствуют о том, что гликолевая кисло-та обладает фотозащитным действием, повышая устойчивость кожи к облучению. Кроме того, обработка гликолевой кислотой раздраженной кожи приводит к более быстрому исчезновению эритемы. Противовоспалительное действие у разных AHA выражено в разной степени и прямо связано с их антиоксидантными свойствами. Так, сравнение четырех AHA — гликолевой, молочной и винной кислот и глюконолактона (внутреннего сложного эфира глюконовой кислоты) — показало, что более эффективным противовоспалительным действием обладают два последних соединения, которые являются и более сильными антиоксидантами [26]. И все же антиоксидантные свойства изолированных AHA выражены не очень сильно. Однако при сочетании AHA с другими антиоксидантами проявляется эффект синергизма, благодаря которому обший антиоксидантный потенциал смеси существенно возрастает. Моїтеаіе и Livrea исследовали антиоксидантную активность гликолевой кислоты в паре с витамином Е и мелатонином на модельных липидных бислоях и гомогенате кожи человека [27]. Они обнаружили, что в присутствии гликолевой кислоты антиоксидантная активность витамина Е возрастает в 2,5 раза, а мелатонина — в 1,8 раза. Роль гликолевой кислоты, по всей видимости, сводится к восстановлению второго компонента, в результате которого повышается его антиоксидантный потенциал. Усиление синтеза коллагена и гпикозаминогликанов До сих пор нет окончательной ясности в отношении того, каким образом AHA разглаживают мелкие морщинки. Одним из аспектов их действия является стимуляция пролиферации фибробластов и активация синтеза коллагена I, входящего в состав межклеточного вещества дермы [28,29,30]. Кроме того, показано, что гликолевая кислота стимулирует биосинтез гликозаминогликанов, также входящих в состав межклеточного вещества и участвующих в межклеточной коммуникации [13,31]. Эффективность действия различается у разных AHA и прямо пропорциональна их дозе. Так, в экспериментах in vivo и in vitro было показано, что в ряду AHA самым сильным пролиферативным эффектом обладает гликолевая кислота, затем следуют молочная и яблочная кислоты [32]. Под действием AHA роговой слой эпидермиса становится тоньше, а дерма, наоборот, утолщается. В результате мелкие морщинки разглаживаются, а крупные становятся не столь заметными. К сожалению, тех количеств AHA, которые вырабатывает наш организм, не хватает для того, чтобы предотвратить образование морщин. Более того, в организме синтезируются а-ацетоксикислоты (alpha acetoxy acids, AAA), которые действуют противоположно AHA: они вызывают утолщение эпидермиса и утоньшение дермы, а также способствуют возникновению белых и черных угрей. Общий подход к разработке АН А-косметики Технолог, работающий над рецептурой косметического средства с AHA, одновременно решает несколько задач. Прежде всего, следует помнить, что AHA — вещества с сильным биологическим действием. При грамотном применении АНА-косметики эффект превосходит все ожидания — внешний вид кожи существенно улучшается, однако при бесконтрольном и неправильном ее использовании коже можно нанести непоправимый ущерб. В случае АНА-косметики грань между безопасностью и эффективностью очень узкая, и средство должно быть сбалансировано настолько, чтобы добиться максимальной эффективности при минимальном риске. С другой стороны, перед разработчиком стоит непростая технологическая задача — создать средство, стабильное при низких значениях рН. Выбор AHA Применяемые в косметологии AHA могут содержать в своей молекуле до 14 атомов углерода. В зависимости от молекулярного веса и структуры углеводородной цепочки, которая может быть линейной или разветвленной, насыщенной или ненасыщенной, содержать различное число карбоксильных и гидроксильных групп, иметь другие активные группировки (амино-, кето-, тиогруппы), данная AHA может превосходить другие AHA или, напротив, уступать им в проявлении тех или иных свойств. Биологическая активность AHA зависит и от конфигурации молекулы. Например, в случае молочной кислоты эффективным является только L-изомер, в то время как D-изомер не оказывает на кожу какого-либо выраженного действия. Нередко в рецептуру вводится не одна, а смесь нескольких разных кислот. Например, во многих АНА-продуктах гликолевую кислоту комбинируют с фруктовыми кислотами. В последнее время становятся популярными продукты, содержащие смесь а- и Р-гидроксикйслот (так называемые АНА/ВНА-продукты). Считается, что AHA обладают более выраженным отшелушивающим действием, а ВНА — более сильным пролиферативным действием. Среди AHA, разрешенных к использованию в косметике, следующие: гликолевая, молочная, яблочная, лимонная, винная. Среди ВНА можно назвать салициловую, хотя с химической точки зрения она не является типичной [3-гидроксикислотой, поскольку содержит не спиртовую, а фенольную гидроксигруппу. Как видно, кислот довольно много, однако частота их использования разная. Безусловными лидерами являются гликолевая и молочная кислоты; они же лучше всего изучены. Большинство исследований по действию AHA на кожу было проведено с гликолевой кислотой. С ее помощью был установлен механизм действия AHA, осуществлен подбор концентраций и химических параметров готовых рецептур, проведены широкие токсикологические и клинические испытания, выработан общий подход к созда и использованию АНА-косметики. Не случайно именно гликоле-НИ КИСЛота до сих пор наиболее популярна среди разработчиков косметической продукции, косметологов, а также покупателей. рН и концентрация AHA в готовом продукте Безопасность и эффективность АНА-содержащего косметического средства определяется в первую очередь рН и лишь потом концентрацией в нем AHA [33]. От рН зависит раздражающий потенциал данного продукта. Пороговым значением рН, ниже которого раздражающий потенциал резко возрастает, является 3,5. Увеличения рН можно добиться, снизив содержание AHA. Однако при этом снижается и эффективность продукта, которая зависит именно от концентрации. Поэтому предпочтительнее другой способ, позволяющий увеличить рН, не снижая при этом концентрации AHA,— частичная нейтрализация. В частично нейтрализованных растворах имеется как свободная кислота, так и ее соль. Соль служит резервом, из которого в глубоких слоях кожи образуется кислота. Обнаружено, что децегпуры с более высокой концентрацией ДНА и рН 3.5-4,5 оказывают наиболее сильное воздействие на дерму, эффективно ст иму-jwgyji гтрддукипк> гликозаминогликанов и коллагена. Основа косметического средства с AHA Компоненты, которые входят в АНА-рецептуру, выбирают с учетом их стабильности и активности при низких значениях рН. Выбранные ингредиенты должны быть функциональны в кислой среде и не подвергаться гидролизу в течение всего срока годности препарата. Если рецептура представляет собой эмульсию, то важно правильно выбрать ее стабилизаторы, в качестве которых чаще всего используют гидрофильные коллоиды и ПАВ. Поскольку используемые AHA водорастворимы, в основном используются кремы и лосьоны на основе эмульсий типа «масло-в-воде». Гидрофильные коллоиды В условиях водно-эмульсионной системы гидрофильные КОЛЛОИДЫ (гидроколлоиды) способствуют ее стабилизации, а также оказывают влияние на реологические свойства эмульсии, в большинстве случаев повышая ее вязкость. Примером гидроколлоидов, которые используются при разработке АНА-содержащих эмульсий тина «масло-в-воде», являются целлюлозная, гуаровая и ксантановая смолы. Чтобы успешно функционировать в качестве стабилизаторов эмульсии, коллоиды должны хорошо диспергироваться при низком рН и не должны подвергаться кислотному гидролизу. В АНА-содержащих эмульсиях типа «масло-в-воде» гидроколлоиды используются прежде всего как модификаторы вязкости и лишь затем как стабилизаторы эмульсий. В качестве стабилизаторов обычно используются ПАВ. Согласно общепринятой классификации, выделяют четыре основных типа ПАВ: катионные, неионогенные, анионные и амфотерные. Амфотерные ПАВ используются в качестве вторичных эмульгаторов и солюбилизирующих агентов, которые эффективны и стабильны при кислых рН. Поскольку в АНА-продуктах амфотерные ПАВ используются только как вторичные эмульгаторы, в рамках данного обзора мы на них останавливаться не будем. Катионные эмульгаторы В АНА-содержащих эмульсиях типа «масло-в-воде» используются два типа катионных эмульгаторов. Первый тип представлен длин-ноцепочечными первичными, вторичными и третичными аминами, которые растворимы в воде и ионизованы в кислой среде (например, алкиламидоамины). В определенной степени эти эмульгаторы мог.ут служить буфером для AHA, поскольку при растворении в воде они способны образовывать пары с такими анионными молекулами, как AHA. Второй тип катионных ПАВ представлен длинноцепочечными четвертичными аммониевыми соединениями, которые являются катионами при любых значениях рН (например, катионные соли алкилами-нопропилдиметиламинов). Катионные эмульгаторы — устойчивые и активные стабилизаторы эмульсий в тех пределах рН, которые используются в АНА-рецептурах. Однако их нельзя сочетать с длинноцепочечными анионными ПАВ, поскольку они могут реагировать с ними, образуя преципитат (осадок). Неионогенные эмульгаторы В общем случае лучшим выбором эмульгаторов для АНА-рецеп-туры являются неионогенные ПАВ, эмульгирующая активность которых, как правило, не зависит от рН среды (например, полиэтиленгли-коли, полиоксипропиленгликоли, сорбитановые эфиры). Неионогенные ПАВ стабилизируют эмульсию, механически препятствуя слиянию внутренних фаз. Это коренным образом отличает их от катионных и анионных ПАВ, которые образуют вокруг мицелл двойной слой отталкивающихся зарядов. Благодаря способности формировать ламеллярные жидкокристаллические и/или кристаллические гелевыс фазы в эмульсиях, содержащих протяженную водную фазу, некоторые неионогенные ПАВ (например, глицерилстеараты) работают как агенты, придающие эмульсии пышность. Этот эффект особенно выражен при их сочетании с анионными эмульгаторами. Неионогенные ПАВ не вступают в реакции с длинноцепочечными ионными компонентами и могут использоваться и как первичные, и как вторичные эмульгаторы в комбинации с любым катионным или анионным ПАВ. Анионные эмульгаторы Анионные ПАВ могут быть использованы в АНА-препаратах в тех случаях, когда рН системы выше значения, оптимального для эффективности AHA. В общем случае анионные ПАВ представлены мыльными системами, которые при рН ниже 7 могут быть нестабильными. Самоэмульгирующиеся системы на основе глицерилстеаратов, устойчивые в кислой среде, существуют в том случае, если в качестве самоэмульгирующегося компонента используется лаурилсульфат натрия. В таких системах рН не должен быть меньше 4, в противном случае начинается гидролиз лаурилсульфата натрия. В случае анионных эмульгаторов нельзя использовать катионные ПАВ, с которыми возможен процесс преципитации. Трансдермальные носители Терапевтический эффект биологически активного вещества (БАВ) зависит от его концентрации непосредственно в месте действия. Адресная доставка активного ингредиента позволяет снизить его концентрацию, а значит, уменьшить вероятность побочных реакций. Перспективным считается использование систем доставки на основе полиэфиров [34 ,35]. В этом направлении вот уже несколько лет работает американская химическая компания Inolex, разработавшая несколько вариантов полиэфирных носителей для различных гидрофильных и липофильных БАВ, включая AHA и УФ-фильтры. Полиэфирные компоненты с различной структурой, различной молекулярной массой и растворимостью подбираются с учетом химических характеристик доставляемого агента. Они обладают способностью проникать через барьер рогового слоя, не нарушая при этом его структуру, и постепенно высвобождать активный ингредиент уже в более глубоких слоях кожи. Работа над созданием эффективной контролируемой системы доставки AHA в глубокие слои кожи ведется не только в научных центрах производственных компаний, но и в независимых лабораториях. Недавно в International Journal of Pharmacology были опубликованы интересные результаты, полученные итальянскими учеными из отделения фармацевтической химии университета г. Павия [36]. Изучая проблему липосомной доставки гликолевой кислоты, они подобрали оптимальные параметры системы, позволяющей эффективно и без побочных реакций доставлять гликолевую кислоту в кожу. Они исследовали различные типы микрокапсульных носителей: липосомы, ли-посомы, модифицированные хитозаном, и хитозановые микросферы. Липосомы, состоящие из фосфатидилхолина и холестерина (молярное соотношение 1:1), были приготовлены стандартным способом обращения фаз. Хитозан добавляли в липидный бислой на стадии приготовления липосом или покрывали им уже готовые липосомы. Микрокапсулы изучали с помощью электронного микроскопа, контроль за их размерами осуществляли методом светорассеяния. Для оценки способности микрочастиц модулировать высвобождение гликолевой кислоты были разработаны специальные тесты на растворение in vitro. Полученные результаты показали, что липосомы могут модулировать высвобождение гликолевой кислоты, и оптимальным условием для этого является молярное соотношение гликолевая кислота/липид, равное 5:1. Липосомы с добавлением хитозана также могут постепенно высвобождать гликолевую кислоту, в то время как хитозановые микрочастицы не способны контролировать высвобождение гликолевой кислоты ни при каких условиях. Сочетание AHA с другими компонентами Отшелушивающее действие AHA облегчает проникновение других БАВ, которые могут присутствовать в препарате. Так, в состав АНА-рецептуры нередко включают антиоксиданты (например, витамины С и Е) и растительные экстракты с разнообразными свойствами (противовоспалительными, увлажняющими, седативными). В рецептуры, разработанные для пигментированной кожи, вводят отбеливающие агенты, например, гидрохинон или койевую кислоту. В АНА-пре-паратах встречаются и такие биологически акгивные компоненты, как гиалуроновая кислота, пирролидонкарбоновые кислоты, сквален, пептиды и аминокислоты, мочевина, фитоэстрогены, эффективность которых возрастает в присутствии AHA. Эмоленты — обязательные компоненты в А НА-препаратах. Не оказывая какого-либо биологического действия, эмоленты тем не менее выполняют очень важную функцию — временно смягчают и защищают поверхность кожи, подвергшейся шелушению. Среди эмолентов, входящих в состав АНА-препаратов, используются как натуральные, так и синтетические соединения. Заключение После обработки АНА-препаратами кожа становится более упругой и эластичной, заметно уменьшается число мелких и выраженность глубоких морщин — кожа разглаживается и выглядит моложе и свежее. Чудесное омоложение кожи связано с многообразным биологическим действием AHA. Так, в эпидермисе AHA активируют процесс отшелушивания мертвых клеток и повышают степень гидратации. В составе дермы AHA влияют на синтез основных элементов межклеточного матрикса — коллагена и гликозаминогликанов. Противовоспалительное действие AHA обусловлено их антиоксидантными свойствами и способностью влиять на медиаторы воспаления. Несмотря на то что многие аспекты механизма действия AHA до конца не ясны, картина в целом понятна. Именно многоплановость действия AHA обусловливает тот замечательный эффект, который наблюдается после курса АНА-терапии. Во второй части нашего обзора, помещенной в рубрике «Медицина», мы расскажем об использовании AHA в клинической практике и рассмотрим различные варианты, при которых применение AHA эффективно и оправдано. |
