01 Болезни органов дыхания. Сокращения и условные обозначения
 Скачать 2.33 Mb. Скачать 2.33 Mb.
|
|
Осложнения Острая или хроническая дыхательная недостаточность, вторичная полицитемия, хроническое легочное сердце, застойная сердечная недостаточность, пневмония, спонтанный пневмоторакс, пневмомедиастинум. Диагностика Для правильного установления диагноза ХОБЛ необходимо опираться на ключевые положения определения заболевания. Диагноз ХОБЛ следует предполагать у каждого человека с кашлем, избыточной продукцией мокроты и (или) одышкой при условии существования в анамнезе факторов риска развития болезни (курение и табачный дым, промышленная пыль и химикаты, дым домашних отопительных приборов и гарь от приготовления пищи). При клиническом обследовании определяют удлиненную фазу выдоха в дыхательном цикле, над легкими при перкуссии - легочный звук с коробочным оттенком, при аускультации легких - ослабленное везикулярное или жесткое дыхание и рассеянные сухие хрипы. Приведенные признаки не считают диагностически значимыми в отдельности, но присутствие нескольких из них повышает вероятность заболевания. В установлении диагноза ХОБЛ наиболее важными и определяющими считают результаты исследования функции внешнего дыхания. Обязательный признак - постбронходилатационное значение ОФВ:/ФЖЕЛ <70%. Этот показатель постоянен для всех стадий течения заболевания и служит наиболее ранним признаком ограничения скорости воздушного потока, даже при сохранении ОФВ1 >=80%. В процессе обследования больного необходимо исключить другие заболевания (бронхиальную астму, недостаточность левого желудочка (отек легкого), тромбоэмболию легочной артерии, обструкцию верхних дыхательных путей, рак легкого, туберкулез, пневмоторакс), манифестирующие бронхообструктивным синдромом. Таким образом, диагностику ХОБЛ осуществляют на основании следующих данных: существования факторов риска, клинических признаков, главные из которых - кашель и экспираторная одышка, неуклонно прогрессирующего нарушения бронхиальной проходимости (по данным исследования функции внешнего дыхания) и исключения других заболеваний, которые могут привести к возникновению симптомов, аналогичных ХОБЛ. Формулировка развернутого клинического диагноза ХОБЛ включает указание: • тяжести течения заболевания - легкое (I стадия), среднетяжелое (II стадия), тяжелое (III стадия) и крайне тяжелое (IV стадия) течение; • фазы процесса - обострение или ремиссия; • осложнений (дыхательная недостаточность, легочное сердце, недостаточность кровообращения). При тяжелом течении заболевания рекомендуют указывать клиническую форму ХОБЛ (эмфизематозная, бронхитическая или смешанная). Лечение Направлено на предупреждение прогрессирования заболевания, повышение толерантности к физическим нагрузкам, уменьшение симптомов, улучшение качества жизни, профилактику и лечение обострений и осложнений. Первый и самый важный шаг в программе лечения ХОБЛ - ослабление влияния факторов риска и в первую очередь - прекращение курения. Это единственный и пока наиболее эффективный метод, позволяющий уменьшить риск развития и прогрессирования ХОБЛ. Разработаны специальные программы лечения табачной зависимости. Выбор лечения зависит от степени тяжести (стадии) заболевания и его фазы (стабильное состояние или обострение), а также от существования или отсутствия осложнений. Ведущее место в комплексном лечении больных ХОБЛ занимают бронхолитические препараты. Показано, что все виды бронхолитиков повышают толерантность к физической нагрузке даже при отсутствии изменений ОФВГ Предпочтение отдают ингаляционным препаратам. Лечение ХОБЛ при стабильном состоянии. При легком течении ХОБЛ применяют ингаляционные бронходилататоры короткого действия по требованию (β2-агонисты и М-холинолитики). Ипратропия бромид назначают по 40 мкг (две дозы) 4 раза в день, сальбутамол - в дозе 100-200 мкг до 4 раз в сутки, фенотерол - в дозе 100-200 мкг до 4 раз в сутки. При применении короткодействующих бронходилататоров предпочтение отдают их бесфреоновой форме. М-холинолитические средства - препараты первого ряда в лечении ХОБЛ, и их назначение обязательно при всех степенях тяжести заболевания. При среднетяжелом, тяжелом и крайне тяжелом течении приоритетным считают длительное и регулярное лечение бронхолитиками. Преимущество отдают бронхолитикам длительного действия (GOLD, 2008): тиотропия бромид (в дозе 18 мкг 1 раз в сутки через хендихалер), салметерол (по 25-50 мкг 2 раза в сутки), формотерол (по 4,5-9 мкг 2 раза в сутки или по 12 мкг 2 раза в сутки). Получены убедительные данные в пользу раннего (со II стадии заболевания) начала лечения ХОБЛ бронхолитическими препаратами длительного действия, в первую очередь - тиотропия бромидом. У больных с тяжелым и крайне тяжелым течением ХОБЛ бронходилатационное лечение осуществляют с помощью специальных растворов (ипратропия бромид, фенотерол, ипратропия бромид + фенотерол) через небулайзер. Небулайзерная терапия также предпочтительна, как и применение дозированного аэрозоля со спейсером у пожилых людей и больных с ментальными нарушениями. Из препаратов ксантинового ряда применяют только пролонгированные теофиллины (теопэк*, теотард* и др.), но с учетом их потенциальной токсичности они могут быть только препаратами второй линии. У пациентов с ОФВ1 <50% должной величины (тяжелая и крайне тяжелая стадия ХОБЛ) и повторяющимися обострениями (3 раза и более за последние три года) наряду с бронходилататорами применяют ингаляционные глюкокортикоиды (беклометазон (так называемое легкое дыхание), флутиказон и будесонид). Наиболее эффективна комбинация ингаляционных глюкокортикоидов с β2-агонистами длительного действия (салметерол + флутиказон (серетид) и формотерол + будесонид (симбикорт*)). Фиксированная комбинация формотрол + будесонид (симбикорт*) благодаря эффекту формотерола вызывает быстрое улучшение самочувствия больных при использовании утром, сразу встав с постели. Это особенно важно для пациентов с тяжелым течением ХОБЛ, так как утро для них - самое тяжелое время суток. У больных II-IV стадией ХОБЛ для повышения эффективности лечения можно использовать тройную комбинированную терапию, включающую фиксированную комбинацию ингаляционных глюкокортикоидов и β2-агониста длительного действия с тиотропия бромидом. Назначение муколитиков (мукорегуляторов, мукокинетиков) рекомендовано очень ограниченному контингенту больных стабильной ХОБЛ. Их применяют при вязкой мокроте, но на течение заболевания они существенно не влияют. Для профилактики обострения ХОБЛ считают перспективным длительное применение муколитика ацетилцистеина, одновременно обладающего антиоксидантной активностью. Для профилактики обострения ХОБЛ антибактериальные препараты использовать не рекомендовано. С этой целью проводят ежегодную вакцинацию во время эпидемических вспышек гриппа (однократно в октябре-первой половине ноября). Помимо лекарственных средств, при стабильном течении ХОБЛ применяют немедикаментозное лечение. Больным с хронической дыхательной недостаточностью проводят постоянную многочасовую малопоточную (более 15 ч/сут) кислородотерапию, которая пока остается единственным методом, способным снизить летальность при крайне тяжелой стадии ХОБЛ. На всех стадиях течения процесса высокой эффективностью обладают физические тренирующие программы, повышающие толерантность к физической нагрузке и уменьшающие одышку и усталость. В последние годы стали применять хирургические методы лечения, и в первую очередь - буллэктомию, которая приводит к уменьшению одышки и улучшению легочной функции. Оперативную коррекцию легочного объема, достигаемую с помощью буллэктомии, считают паллиативной хирургической процедурой. Лечение обострения заболевания. В связи с тем что все обострения ХОБЛ следует рассматривать как фактор прогрессирования, их лечение должно быть более интенсивным. В первую очередь это относят к бронхолитической терапии. При лечении обострения увеличивают дозы препаратов и модифицируют способы их доставки. Предпочтение отдают небулайзерному лечению. В зависимости от тяжести течения и обострения ХОБЛ, лечение можно проводить в амбулаторных (легкое или среднетяжелое обострение у больных с легким течением ХОБЛ) или стационарных условиях. Для купирования обострения наряду с бронхолитической терапией применяют антибиотики и глюкокортикоиды, а в условиях стационара - контролируемую оксигенотерапию и неинвазивную вентиляцию легких. При обострении ХОБЛ, сопровождающемся снижением ОФВ1 <50% должного показателя, отдают предпочтение системным глюкокортикоидам (преднизолон в дозе 30-40 мг на протяжении 10-14 дней). В дальнейшем при достижении клинического эффекта больных переводят на ингаляционное введение этих препаратов. Альтернативой системному применению глюкокортикоидов (особенно у больных ХОБЛ в сочетании с сахарным диабетом, обострением язвенной болезни, высокой артериальной гипертензией (АГ), слабостью дыхательных мышц) может быть назначение суспензии будесонида через небулайзер (по 2-4 мг 2 раза в сутки). При усилении одышки, увеличении количества мокроты и ее гнойном характере назначают антибактериальную терапию. В большинстве случаев обострения ХОБЛ антибиотики можно принимать внутрь. Продолжительность антибактериальной терапии - от 7 до 14 дней. При неосложненном обострении препаратом выбора считают амоксициллин (в качестве альтернативы можно использовать респираторные фторхинолоны или амоксициллин + клавулановую кислоту, а также новые макролиды - азитромицин и кларитромицин). При осложненных обострениях препаратами выбора служат респираторные фторхинолоны (левофлоксацин, моксифлоксацин) или цефалоспорины II-III поколения, в том числе с антисинегнойной активностью. Показания для парентерального введения антибиотиков: тяжелое обострение, нахождение больного на искусственной вентиляции легких, отсутствие формы антибиотика для приема внутрь, нарушения со стороны ЖКТ. Для лечения тяжелого инфекционного обострения ХОБЛ рекомендовано применение через небулайзер раствора, содержащего муколитик (ацетилцистеин) и антибиотик, - тиамфеникола глицинат ацетилцистеинат. Обязательный метод лечения ХОБЛ при обострении - оксигенотерапия. При неосложненных обострениях быстро достигают оптимального уровня оксигенации - РаО2 >8,0 кПа (>60 мм рт.ст.) или СО2 >90%. После начала оксигенотерапии через назальные катетеры (скорость потока - от 1 до 2 л/мин) или маску Вентури (содержание кислорода во вдыхаемой кислородно-воздушной смеси - от 24 до 28%) газовый состав крови следует контролировать через 30- 45 мин (полноценность оксигенации, исключение ацидоза и гиперкапнии). При отсутствии эффекта через 30-45 мин ингаляции кислорода необходимо решить вопрос о применении неинвазивной вентиляции легких с положительным давлением. Если у больного с тяжелым обострением ХОБЛ последняя оказывается неэффективной (недоступной), то проводят инвазивную вентиляцию легких. Прогноз Прогноз в отношении выздоровления неблагоприятен. Болезнь характеризуется неуклонно прогрессирующим течением, приводящим к инвалидизации. В оценке прогноза определяющую роль играют следующие параметры: возможность устранения провоцирующих факторов, приверженность больного к лечению и социально-экономические условия. Неблагоприятные прогностические признаки: тяжелые сопутствующие заболевания, сердечная и дыхательная недостаточность, пожилой возраст больных. Применение длительно действующего холинолитика (тиотропия бромида) и комбинации ингаляционного глюкокортикоида в сочетании с длительно действующими β2-агонистами открывает перспективу для улучшения прогноза заболевания. Профилактика Ведущее значение для профилактики имеет ранняя диагностика заболевания и устранение факторов риска. Особое место занимает отказ от курения и профилактика инфекционных заболеваний дыхательных путей. БРОНХИАЛЬНАЯ АСТМА Бронхиальная астма (БА) - хроническое заболевание, в основе которого лежит воспалительный процесс в дыхательных путях с участием разнообразных клеточных элементов, включая тучные клетки, эозинофилы и Т-лимфоциты. У предрасположенных лиц этот процесс приводит к развитию генерализованной бронхиальной обструкции разной степени выраженности, полностью или частично обратимой спонтанно или под влиянием лечения. Хроническое воспаление вызывает гиперреактивность дыхательных путей, приводящую к возникновению повторных эпизодов свистящих хрипов, одышки, чувства стеснения в груди и кашля (особенно ночью или ранним утром). Это определение дано в международных рекомендациях «Глобальная стратегия по лечению и профилактике бронхиальной астмы» (GINA) пересмотра 2006 г. В отличие от предшествующих, оно стало возможным в связи с тем, что за последние годы значительно изменилось представление о сути БА, ее этиологии, патогенезе, клинической картине, лечении и профилактике. В основе БА (независимо от степени тяжести) лежит хронический воспалительный процесс в дыхательных путях. Гиперреактивность бронхов, изменяющаяся со временем бронхиальная обструкция и связанные с этим клинические симптомы болезни - следствие персистирующего воспаления в бронхах. Этиология БА - распространенное заболевание (распространенность колеблется от 3 до 8%). Резкий рост заболеваемости БА произошел во второй половине XX в., когда за период с 30-х по 80-е годы отмечено десятикратное увеличение ее распространенности как среди детского, так и среди взрослого населения. В настоящее время в мире живет около 300 млн больных БА. В возникновении БА имеет значение наследственная предрасположенность. Установлена связь некоторых антигенов гистосовместимости (HLA) с тяжестью течения БА. Увеличение последней особенно часто отмечают у носителей антигенов А2, В7, В12, В13, В27, В35, DR2, DR5 и их комбинации. Показано увеличение распространенности БА среди кровных родственников больных, страдающих этим заболеванием (20-25% по сравнению с 4% в общей популяции), что может свидетельствовать об участии в его развитии генетических факторов. Их вклад в формирование болезни составляет от 35 до 70%. В развитии заболевания играют роль внутренние и внешние факторы. Внутренние (генетические) факторы - биологические дефекты иммунной, эндокринной, вегетативной нервной систем, чувствительности и реактивности бронхов, мукоцилиарного клиренса, эндотелия сосудов легких, системы быстрого реагирования (тучные клетки и др.), метаболизма арахидоновой кислоты и т.д. Среди них особо выделяют гены, предрасполагающие к атопии, и гены, предрасполагающие к бронхиальной гиперреактивности. В международных рекомендациях GINA (2006) к внутренним факторам, влияющим на развитие и манифестацию БА, относят ожирение и пол (женщины чаще болеют БА, чем мужчины). Внешние факторы, способствующие клинической реализации биологических дефектов, включают: • аллергены (пыльцевые, пылевые, пищевые, лекарственные, производственные, клещей, насекомых, животных и др.); • возбудителей инфекционных заболеваний (главным образом, вирусы, грибы и некоторые виды бактерий); • механические и химические раздражители (металлическая, древесная, силикатная, хлопковая пыль, пары кислот и щелочей, дымы и др.); • метеорологические и физико-химические факторы (изменение температуры и влажности воздуха, колебания барометрического давления, магнитного поля земли, физические усилия и др.); • стрессовые нервно-психические воздействия и физическую нагрузку; • фармакологические воздействия(β-адреноблокаторы, НПВС и т.д.); • курение табака (активное и пассивное). У больных БА курение табака сопровождается ускоренным ухудшением функций легких и увеличением степени тяжести заболевания. Курение может приводить к снижению ответа на применение глюкокортикоидов, а также уменьшать вероятность достижения контроля за БА. Инфекционные агенты, помимо аллергизирующего действия, могут также: • снижать порог чувствительности организма к неинфекционным (атопическим) аллергенам и повышать проницаемость слизистой оболочки дыхательных путей для них; • неиммунологическим путем формировать изменение реактивности клеток-мишеней (тучные клетки, базофилы, моноциты и др.) и эффекторных систем. Известно, что некоторые вирусы и бактерии оказывают бета-адреноблокирующее действие и способны воздействовать на эфферентные зоны вагусного бронхоконстриктивного механизма. Различные вирусные инфекции (респираторносинцитиальный вирус, вирус парагриппа), перенесенные в младенческом возрасте, способствуют формированию астматического фенотипа. Как правило, при БА у одного и того же больного можно заподозрить или обнаружить сочетание нескольких этиологических факторов. Вместе с тем важнейшим идентифицируемым предрасполагающим фактором развития заболевания служит атопия, т.е. выработка избыточного количества IgE как реакция на воздействие аллергенов окружающей среды. При продолжительном течении болезни большее значение приобретают различные неспецифические раздражения и психогенные факторы. Аллерген, первоначально вызвавший развитие БА, со временем может утратить свое значение, исчезнув из зоны окружения больного; собственно обострения болезни обусловлены иными причинами. Патогенез Центральное звено патогенеза БА - неинфекционный воспалительный процесс в бронхах, вызванный воздействием различных воспалительных клеток и выделяемых ими биологически активных веществ - медиаторов. В свою очередь, воспаление бронхов ведет к развитию их гиперчувствительности и гиперреактивности, предрасполагая, таким образом, бронхиальное дерево к сужению в ответ на действие различных стимулов (рис. 1-6). 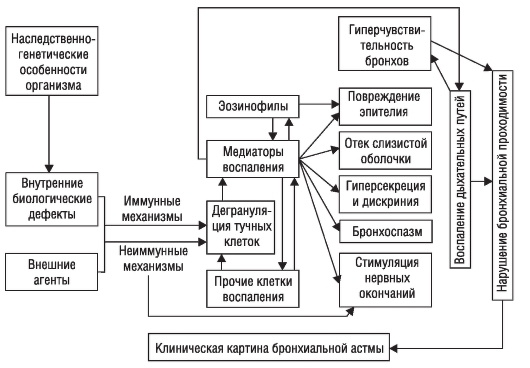 Рис. 1-6. Патогенез бронхиальной астмы Иммунные механизмы. В подавляющем большинстве случаев БА - аллергическое заболевание, поэтому главным механизмом формирования патологического процесса служит иммунный. Согласно классификации R. Coombs и P. Gell, у значительной части больных БА нарушения иммунокомпетентной системы протекают по I, III и IV типу реакций гиперчувствительности. Развитие реакций II (цитотоксического) типа при БА пока не описано. Чаще других основную роль играют механизмы гиперчувствительности I (анафилактического или атопического) типа. К этому типу аллергии относят немедленные реакции, развивающиеся вследствие взаимодействия аллергена (антигена) со специфическим IgE. Реакция происходит преимущественно на поверхности субмукозных тучных клеток дыхательных путей и базофилов, циркулирующих в крови. В результате происходит их дегрануляция с высвобождением биологически активных молекул, среди которых преобладают медиаторы воспаления. Уже через несколько секунд после реакции дегрануляции клетки секретируют ранее синтезированные вазоактивные амины - гистамин и серотонин. Более отдаленным последствием активации тучных клеток служит запуск продукции метаболитов арахидоновой кислоты (простагландинов, лейкотриенов), тромбоксанов и цитокинов, которые участвуют в поддержании воспалительной реакции в тканях (ИЛ-3, -4, -5, -8; нейтрофильный хемотаксический фактор, фактор агрегации тромбоцитов, гранулоцитарно-макрофагальный колониестимулирующий фактор и др.). Секретируемые тучными клетками медиаторы и цитокины вызывают интенсивный приток эозинофилов и других клеток воспаления (гранулоцитов, моноцитов, Т-лимфоцитов) к месту проникновения аллергена. Через 6-12 ч развивается поздняя стадия аллергической реакции, при которой доминирует клеточная инфильтрация. Эозинофил рассматривают в качестве ключевой клетки в повреждении эпителия дыхательных путей, что связано с продукцией и секрецией им эозинофильного катионного белка, а также выделения фактора активации тромбоцитов и так называемого большого основного протеина. В свою очередь, повреждение эпителия бронхов эозинофильным большим основным протеином приводит к развитию неспецифической гиперреактивности и гиперчувствительности. Медиаторы тучных клеток привлекают в зону воспаления нейтрофилы и способствуют выделению ими активных форм кислорода. Активированные нейтрофилы стимулируют дегрануляцию тучных клеток, что замыкает «порочный круг». В развитии хронического воспаления в бронхах велика роль лимфоцитов, выделяющих интерлейкины, с последующей активацией тучных клеток и эозинофилов. Кроме того, макрофаги и моноциты вырабатывают вещества, обладающие мощным бронхоспастическим действием и потенцирующие воспаление. Под влиянием всех вышеописанных изменений повышается проницаемость микроциркуляторного русла, развиваются отек, гипер- и дискриния, бронхоспазм и прочие признаки неинфекционного воспаления дыхательных путей. Клинически это выражается острым нарушением проходимости бронхов и развитием приступа БА. В возникновении реакции I типа большую роль отводят избыточному синтезу реагинов, дефициту секреторного IgA и, главное, снижению Т-супрессорной функции лимфоцитов. Реакция III типа (иммунокомплексный тип или феномен Артюса) происходит в зоне избытка антигена с участием преципитирующих антител. Она развивается под воздействием экзоаллергенов (микроорганизмы, ферменты, пыль, антибиотики и др.) и эндоаллергенов (инфекционное и/или аллергическое воспаление, различные раздражители и другие факторы могут приводить к денатурации белков бронхиол и альвеол с последующим формированием эндоаллергенов - аутоаллергенов). При иммунокомплексных реакциях III типа образуются антитела, принадлежащие преимущественно к иммуноглобулинам класса G и М. Повреждающее действие образованного комплекса «антиген-антитело» реализуется, главным образом, через активацию комплемента и освобождение лизосомных ферментов. Происходят повреждение базальных мембран, спазм гладких мышц бронхов, расширение сосудов и повышение проницаемости микроциркуляторного русла. Тип IV (клеточный), при котором повреждающее действие оказывают сенсибилизированные лимфоциты, относят к гиперчувствительности замедленного типа (ГЗТ). Основные медиаторы аллергической реакции IV типа - интерлейкины. Это лимфокины, действующие на макрофаги и эпителиальные клетки, и лизосомные ферменты. Не исключена роль активации кининовой системы. Под влиянием этих веществ развиваются отек, набухание слизистой оболочки, бронхоспазм и гиперпродукция вязкого бронхиального секрета. Выделямые лимфоцитами интерлейкины способствуют привлечению к месту аллергической реакции других клеток воспаления с развитием персистирующей воспалительной реакции. Все это приводит к длительному нарушению бронхиальной проходимости. В патогенезе БА определенная роль принадлежит местной «поломке» иммунной защиты: отмечают уменьшение концентрации секреторного IgA и изменение системы фагоцитоза, действие которой в органах дыхания в основном обеспечивают альвеолярные макрофаги. При нарушении их функции (воздействие лимфокинов и др.) резко снижается противовирусная защита организма, что связано со снижением продукции интерферона. Воспаление приобретает персистирующий характер. Основные этапы развития аллергической реакции включают: • нарушение соотношения субпопуляций лимфоцитов (Тh1-Тh2-лимфоцитов), приводящее к поляризации Тh2-лимфоцитов; • синтез Т-лимфоцитами цитокинов (ИЛ-4, -5, -10); • стимуляция интерлейкинами внутриклеточной продукции IgE, индукция под их влиянием активности и пролиферации эозинофилов, а также созревания тучных клеток; • вовлечение в аллергическую реакцию других клеток (базофилы, макрофаги, эпителиальные клетки, фибробласты); • высвобождение активированными клетками провоспалительных медиаторов - гистамина, цистеиниловых лейкотриенов, эйкозаноидов, активных форм кислорода и др.; • высвобождение нейротрансмиттеров и активация афферентных нервов. Воспалительный процесс, возникший в результате аллергической реакции, затрагивает все структуры стенки бронхов, включая эпителиальный покров, базальную мембрану, ассоциированные с бронхами лимфоидные узелки (так называемую БАЛТ-систему), сосуды и гладкие мышцы. Это приводит к целому ряду патоморфологических изменений: • спазму гладких мышц (острая бронхоконстрикция); • гипертрофии слизистых желез, гиперсекреции слизи и образованию слизистых пробок в просвете бронхов; • отеку слизистой оболочки и ее инфильтрации активированными клетками; • дилатации и пролиферации сосудов, а также повышению их проницаемости; • перестройке (ремоделированию) морфологических структур легочной ткани (гибели эпителиального покрова, утолщению стенок бронхов, изменению размеров базальной мембраны, васкуляризации слизистых оболочек дыхательных путей). |
