пособие. ТТД ч1 учебное пособие. Техническая термодинамика
 Скачать 4.15 Mb. Скачать 4.15 Mb.
|
|
4.2. Частные случаи политропных процессов Рассмотрим частные случаи политропных процессов, имеющих наибольшее распространение в практике. К таким процессам относятся: изобарный, изохорный, изотермический и адиабатный процессы. Для каждого из этих процессов определим характеристики политропы: показатель политропы долю теплоты, идущую на увеличение внутренней энергии, Уравнения процессов, расчетные выражения их теплоты, работы, изменения внутренней энерги, энтальпии и энтропи Изобарный процесс, протекает при постоянном давлении. Уравнение изобарного процесса Р=const. В соответствии с уравнением политропы Рvn = const политропа превращается в изобару Р=const при показателе политропы n=0. Теплоемкость изобары cp при n=0 соответствует выражению c=cvк=cp . Доля теплоты, идущая на увеличение внутренней энергии в изобарном процессе, соответствует величине =1/к. Кроме уравнения Р=const, для изобарного процесса можно записать уравнение Tvn-1 = const, которое при n=0 превращается в уравнение T/v=const. Таким образом, основные величины, характеризующие изобарный процесс, будут представлены выражениями Р=const, T/v=const, n=0, c=cp, =1/к. Теплота изобарного процесса соответствует выражению qp = cp(T2-T1) = h2-h1, (4.17) а работа изменения объема – выражению Изменение внутенней энергии, энтальпии и энтропии в изобарном процессе соответствует выражениям u2 - u1 = cv(T2 - T1); (4.19) h2 - h1 = cp(T2 - T1) = qp; (4.20) Изохорный процесс, протекает при постоянном объеме. Уравнение изохорного процесса v=const. В соответствии с уравнением политропы Теплоемкость изохоры при n= соответствует выражению c=cv. Доля теплоты, идущая на увеличение внутренней энергии в изохорном процессе, соответствует величине = 1. Кроме уравнения v=const, для изохорного процесса можно записать уравнение TP(1-n)/n = const, которое при n= превращается в уравнение T/P=const. Таким образом, основные величины, характеризующие изохорный процесс, будут представлены выражениями v = const, T/P = const, n = , c = cv, = 1. Теплота изохорного процесса соответствует выражению qv = cv(T2 - T1) = u2 - u1, (4.22) а работа изменения объема равна нулю, т.к. dv=0: Изменение внутенней энергии, энтальпии и энтропии в изохорном процессе соответствует выражениям u2 - u1 = cv(T2 - T1) = qv ; (4.24) h2 - h1 = cp(T2 - T1) ; (4.25) Изотермический процесс, протекает при постоянной температуре. Уравнение изотермического процесса T=const. В соответствии с уравнением политропы Tvn-1=const политропа превращается в изотерму Т=const при показателе политропы n=1. Теплоемкость изотермы при n=1 равна бесконечности: cт=. Доля теплоты, идущая на увеличение внутренней энергии в изотермическом процессе, равна нулю ( = 0). Кроме уравнения Т=const, для изотемического процесса можно записать уравнение Pvn = const, которое при n=1 превращается в уравнение Pv=const. Таким образом, основные величины, характеризующие изотермический процесс, будут представлены такими выражениями: T = const, Pv = const, n = 1, cт = , = 0. Теплота изотермического процесса равна работе, т.к. изменение внутренней энергии идеального газа при Т=const равно нулю: qт = lт, (4.27) а работа изменения объема определяется по уравнению Изменение внутенней энергии и энтальпии в изотермическом процессе для идеального газа равно нулю: u2 - u1 = 0 , h2 - h1 = 0 , а изменение энтропии определяется выражением Адиабатный процесс – это процесс без теплообмена с окружающей средой, т.е. для него q = 0 или q = 0. Уравнение адиабатного процесса соответствует выражению s=const, т.к. q=Tds=0 при ds=0. Поэтому адиабатный процесс имеет еще одно название – изоэнтропный процесс. Теплоемкость адиабаты равна нулю (сs=0), т.к. температура в этом процессе изменяется, а q=cdT=0. Показатель политропы при сs=0 будет соответствовать выражению n=cp/cv=к, т.е. показатель политропы в адиабатном процессе равен коэффициенту Пуассона. Доля теплоты, идущая на увеличение внутренней энергии в адиабатном процессе, равна бесконечности (=). Таким образом, основные величины, характеризующие адиабатный процесс, будут представлены выражениями s = const, Pvк = const, n = к, cs = 0, = . Теплота адиабатного процесса равна нулю, следовательно, для идеального газа в адиабатном процессе работа равна изменению внутренней энергии, взятой с обратным знаком: ls = - (u2 - u1) = cv(T1 - T2). (4.30) Изменение энтальпии в адиабатном процессе ведется традиционно – h2-h1=cp(T2-T1), а изменение энтропии в этом процессе равно нулю – s2-s1=0. 4.3. Изображение политропных процессов в Р,v и T,s- диаграммах Политропа в Р,v- диаграмме На рис.4.2 изображены характерные политропные процессы в Р,v- координатах. Все процессы проведены через общую точку А, что позволяет наглядно сопоставить изображение политроп с различными значениями показателя политропы n. Показатель политропы определяет характер процесса. В Р,v- координатах политропа описывается уравнением Рvn=const, в соответствии с которым основные процессы будут представлять: изобара – горизонтальная прямая, n=0, Р=const; изохора – вертикальная прямая, n=, v=const; изотерма – равнобокая гипербола с осями асимптот в виде осей координат Р и v, т.к. при n=1 уравнение изотермы p=const/v, причем константа – величина положительная; адиабата – неравнобокая гипербола, т.к. при n=к>1 уравнение адиабаты Р=const/vк, адиабата круче изотермы. Политропы при 0 < n < +в соответствии с уравнением Р=const/vn представляют собой гиперболы, крутизна которых возрастает с увеличением показателя n. Самая крутая из них – изохора (n=), а самая пологая – изобара (n=0). Все политропы с положительным показателем n>0 располагаются во II и IV квадрантах относительно точки А. Политропы с 1 < n < к располагаются между изотермой и изобарой и имеют отрицательную теплоемкость в соответствии с уравнением (4.9). В таких процессах при подводе теплоты температура газа уменьшается, а при отводе теплоты от газа его температура увеличивается. Примером такого процесса может служить сжатие газа (l<0) в цилинре с поршнем при его внешнем охлаждении (q<0), когда величина работы сжатия по модулю больше величины, отведеной от газа теплоты |l|>|q|, т.е. в этом случае будет увеличение внутренней энергии (u=q-l>0) и температуры газа при отводе от него теплоты. Политропы с отрицательным показателем - < n < 0 – это кривые, которые в соответствии с уравнением Р=constv-n проходят через начало координат, причем если n 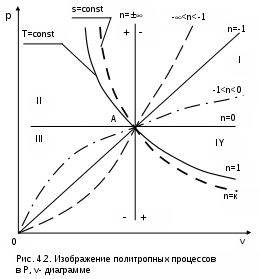 = -1 – это прямая линия, -1 < n < 0 – кривая выпуклостью вверх, - < n < -1 – кривая выпуклостью вниз. При n=-1 теплоемкость процесса имеет среднее арифметическое значение между изобарной и изохорной теплоемкостями: с=(cp+cv)/2. Все политропы с отрицательным показателем n<0 располагаются в I и III квадрантах относительно точки А. В диаграмме P,v изотермы, а также адиабаты идеального газа представляют собой непересекающиеся гиперболы (рис.4.3). Однако они не являются эквидистантными кривыми, поскольку расстояние между ними по оси v будет изменяться в зависимости от численного значения давления. Так для двух изотерм Т1=const и Т2=const расстояние по оси v будет определяться по изобаре P=const выражением v2 - v1 = R(T2-T1)/P. В соответствии с этим выражением при увеличении давления расстояние между двумя изотермами по оси v уменьшается, если Т2>Т1. Кроме этого, исходя из уравнения изобары Т2/Т1=v2/v1, изотермы в P,v- диаграмме находятся одна над другой (или одна правее другой) по в 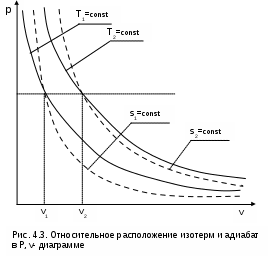 озрастающей, т.к. Т2>T1 только при v2>v1. Для двух адиабат s1=const и s2=const расстояние между ними по оси v можно оценить по любой изобаре P=const. Исходя из уравнений адиабатного и изобарного процессов, Pvк = const и s2 - s1 = cpLn(v2/v1) , следует, что точке на данной изобаре с большим объемом будет соответствовать большее значение энтропии, т.е. при v2>v1 будет s2>s1. Следовательно, в Р,v- диаграмме адиабаты (изоэнтропы) чем выше (или правее), тем большее значение энтропии им соответствует. Для изоэнтропы s2 в уравнении Pvк=const=А2 константа А2 будет больше, чем константа А1 изоэнтропы s1 в уравнении Pvк=const=А1, поскольку при Р=const Pv2к-Pv1к=А2-А1>0. Выразив объем из уравнения адиабаты v=const/P1/к, получим расстояние между двумя адиабатами вдоль оси v в виде выражения 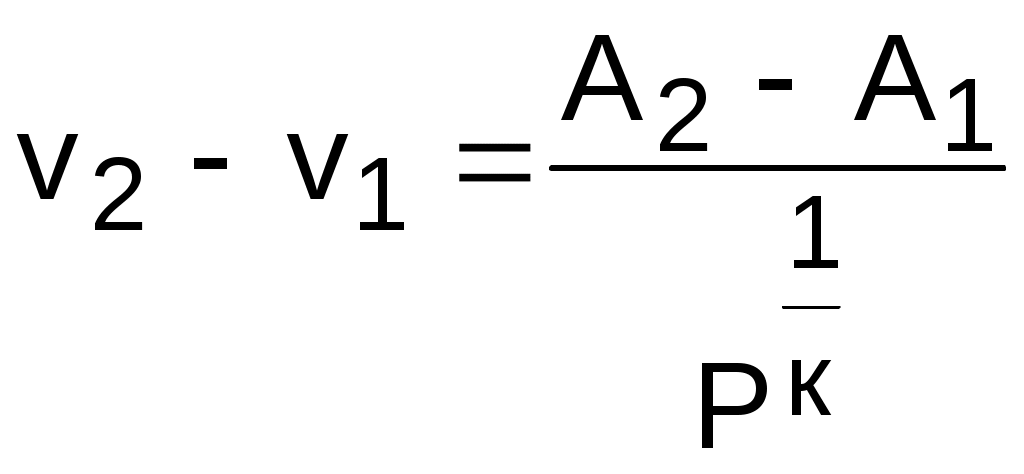 . .Из этого выражения видно, что с увеличением давления расстояние между адиабатами вдоль оси v в P,v- диаграмме уменьшается, т.е. адиабаты в Р,v- диаграмме не являются эквидистантными кривыми, хотя на всем своем протяжении не пересекаются друг с другом. Политропа в T,s- диаграмме Для политропного процесса идеального газа изменение энтропии определяется уравнением (4.13): И 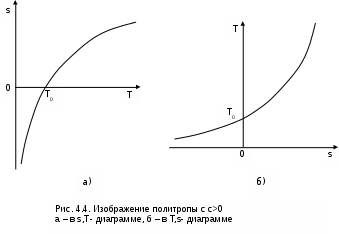 зображение политропы в Т,s- диаграмме ведется в соответствии с этим уравнением при фиксации начала отсчета энтропии (рис.4.4). В общем случае начало отсчета энтропии so=0 можно зафиксировать любой парой независимых параметров состояния. Для упрощения анализа политропы зафиксируем so=0 точкой, находящейся на нашей политропе при температуре То. В этом случае второй параметр состояния, определяющий so=0, при расчете абсолютного значения энтропии не потребуется, т.к. он определен своим местонахождением на данной политропе. При необходимости его несложно определить через параметры любой точки на данной политропе, воспользовавшись одним из уравнений политропы, включающим температуру, например Тovon-1=T1v1n-1. Таким образом, расчетное выражение абсолютного значения энтропии можно представить в виде Выражение (4.31) соответствует логарифмической кривой. При положительной теплоемкости c>0 эта кривая в s,T- координатах изображена на рис. 4.4, а. Та же кривая в Т,s- координатах (перевернутых) показана на рис. 4.4, б. Таким образом, в Т,s- координатах политропа представляет логарифмическую кривую. Политропа с отрицательной теплоемкостью представляет собой логарифмику в виде зеркального отражения политропы с такой же, но положительной теплоемкостью относительно оси Т (рис.4.5). П 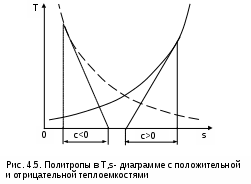 ричем, если подкасательная любой точки политропы (подкасательная в Т,s- координатах соответствует теплоемкости данной точки процесса) расположена слева от нее, то теплоемкость этой политропы положительная (c>0), если подкасательная расположена справа от точки – теплоемкость политропы отрицательная (с<0) (рис.4.5). Численное значение теплоемкости политропы определяет ее круризну в Т,s- диаграмме. Чем больше теплоемкость, тем больше подкасательная и меньше крутизна политропы. Х 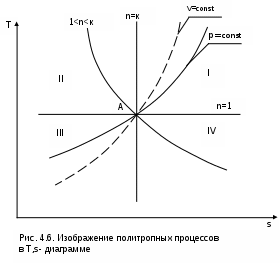 арактер основных политропных процессов в Т,s- диаграмме показан на рис.4.6. Для наглядности сопоставления характера политропных процессов они проведены через общую точку А. Политропы, проходящие через I и III квадранты, относительно точки А имеют положительную теплоемкость, причем изохора круче изобары, т.к. cp > cv. Самая крутая политропа – адиабата, для нее теплоемкость равна нулю. Самая пологая политропа – изотерма, для нее теплоемкость равна бесконечности. Политропы, проходящие через II и IV квадранты, имеют отрицательную теплоемкость. Процессы идеальных газов с одинаковыми показателями политропы в T,s- диаграмме представляют собой эквидистантные по оси s кривые (непересекающиеся, с одинаковым расстоянием друг от друга по оси s). На рис.4.7 изображены в Т,s- диаграмме две политропы идеального газа А1А2 и В1В2 с одинаковым показателем n и соответственно с одинаковыми теплоемкостями. Доказать, что эти политропы эквидистантны несложно. Достаточно рассмотреть расстояние между ними вдоль оси s по двум произвольным изотермам Т1 и Т2. Поскольку теплоемкости этих процессов одинаковые, то изменение энропии на интервале температур Т1-Т2 в этих процессах тоже одинаковое и соответствует отрезкам А1С1 = В1С2 = В прямоугольнике С1А2В2С2 противоположные стороны равны (А2В2=С1С2), равны и отрезки А1С1 и В1С2 (А1С1 = В1С2), следовательно, равны и отрезки А1С1 и В1С2 (А1С1 = В1С2). Расстояние между этими политропами по иси s можно рассчитать по формуле оределения изменения энтропии изотермического процесса (4.13) при любой температуре: s2 - s1 = 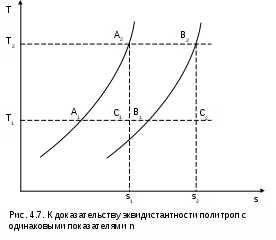 sB - sA = А1В1 = А2В2 = 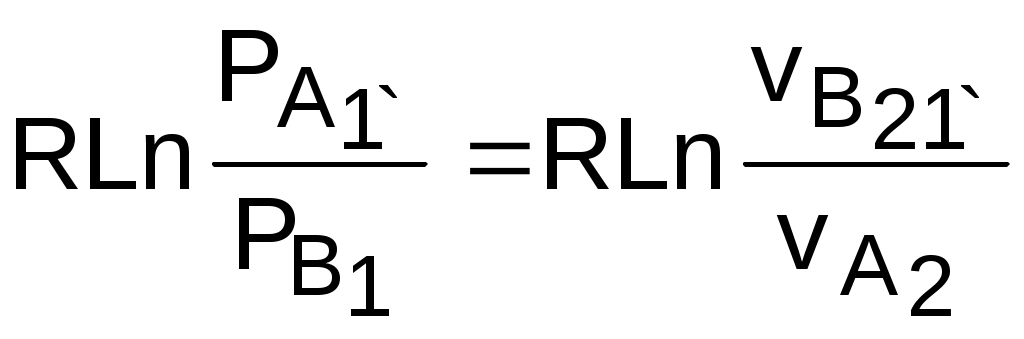 . .Изобары и изохоры являются частными случаями политроп, следовательно, и они представляют в Т,s- диаграмме эквидистантные по оси s кривые. В Т,s- координатах (рис.4.8) изобары находятся одна над другой по возрастающей, а изохоры одна под другой по возрастающей, т.к. если брать расстояние между ними по изотерме, оно будет равно положительной разности энтропий, только при Р1 > Р2 и v2 > v1. 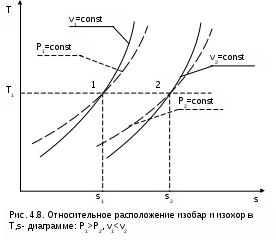 4.4. Установление показателя политропы по опытным данным Все, что было изложено ранее относительно политропных процессов, применимо к идеальным газам с постоянной изохорной теплоемкостью – сv. Для реальных газов изохорная теплоемкость величина переменная, следовательно, политропному процессу реального газа, отвечающему соотношению du/q==const, будет соответствовать переменная теплоемкость с=сv/. Переменная величина теплоемкости политропного процесса реального газа приводит к сложным зависимостям между термическими и энергетическими параметрами газа в таких процессах. Однако с достаточной для технических расчетов степенью точности для реальных газов можно использовать большинство полученных ранее формул для политропного процесса идеального газа [8], понимая при этом под политропным процессом реального газа процесс, удовлетворяющий уравнению Pvn=const. Величина показателя политропы n считается постоянной. Для уменьшения погрешности расчетов изохорную теплоемкость сv берут как среднюю cvm в интервале температур рассматриваемого процесса. Используя среднюю изохорную теплоемкость реального газа, можно приближенно рассчитать показатель политропы n. По заданной величине определяют среднее значение теплоемкости политропного процесса на данном интервале температур как сm=сvm/, и по этой теплоемкости рассчитывается показатель политропы: где срm=cvm+R. При экспериментальном исследовании процессов изменения состояния газов получают опытные данные серии мгновенных значений термических параметров в виде графического или цифрового материала. Для проведения термодинамического анализа таких процессов необходимо установить, являются ли они политропными. В случае, если процесс соответствует политропному процессу, необходимо определить показатель политропы n. Если весь процесс не может рассматриваться как политропный, то он может быть разделен на участки, которые с достаточной степенью точности могут рассматриваться как политропные, и для каждого из этих участков определяется свое среднее значение показателя политропы n. Рассмотрим некоторые из методов обработки и анализа опытных данных закономерных газовых процессов. Оценить, относится газовый процесс к политропному или нет, наиболее просто, изобразив его в логарифмических координатах LnP–Lnv. Прологарифмировав уравнение политропы Pvn=const, получим уравнение LnP + nLnv = A. (б) В логарифмической системе координат LnP–Lnv это уравнение прямой линии. Следовательно, нанеся опытные точки процесса в данной системе координат, можно сделать вывод, относится ли данный процесс к политропному. Если все опытные точки ложатся на одну прямую (рис.4.9), то процесс подчиняется уравнению политропы Pvn=const. Если точки не ложатся на одну прямую, то это не политропный процесс. Однако в этом случае может быть проведена аппроксимация опытных точек с заменой действительного процесса политропным. Оценить пригодность такой политропы для расчетов процесса с заданной степенью точности можно по отклонению опытных точек от политропы. Д 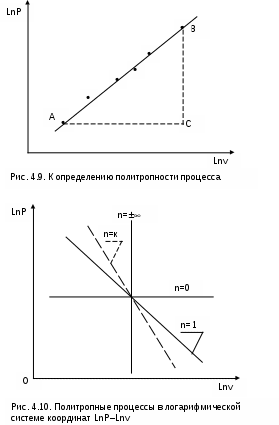 ля политропного процесса, изображенного в виде прямой в системе координат LnP–Lnv, показатель политропы легко определяется из уравнения (б) в виде углового коэффициента, который можно выразить через отношение отезков (см. рис.4.9): На рис.4.10 изображены политропные процессы в логарифмической системе координат с различными показателями политропы: n=0 – изобара, n=1 – изотерма, n=к – адиабата, n= – изохора. Определить показатель политропы можно и по параметрам двух точек процесса. В случае если процесс соответствует политропе, для двух его точек можно записать равенство 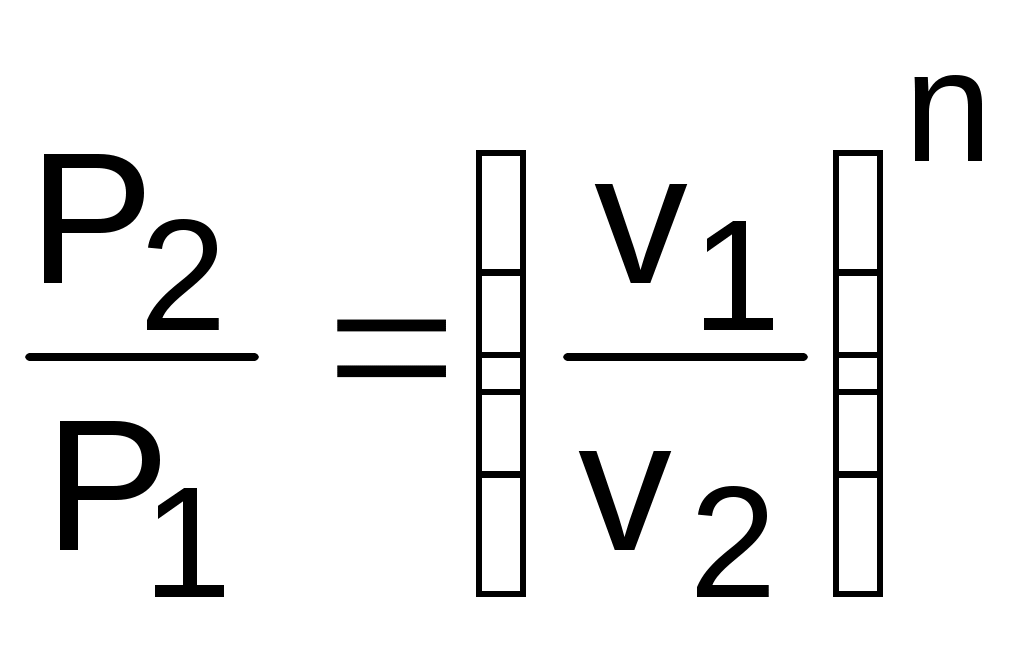 . .Прологарифмировав полученное равенство, получим расчетное выражение для показателя политропы: 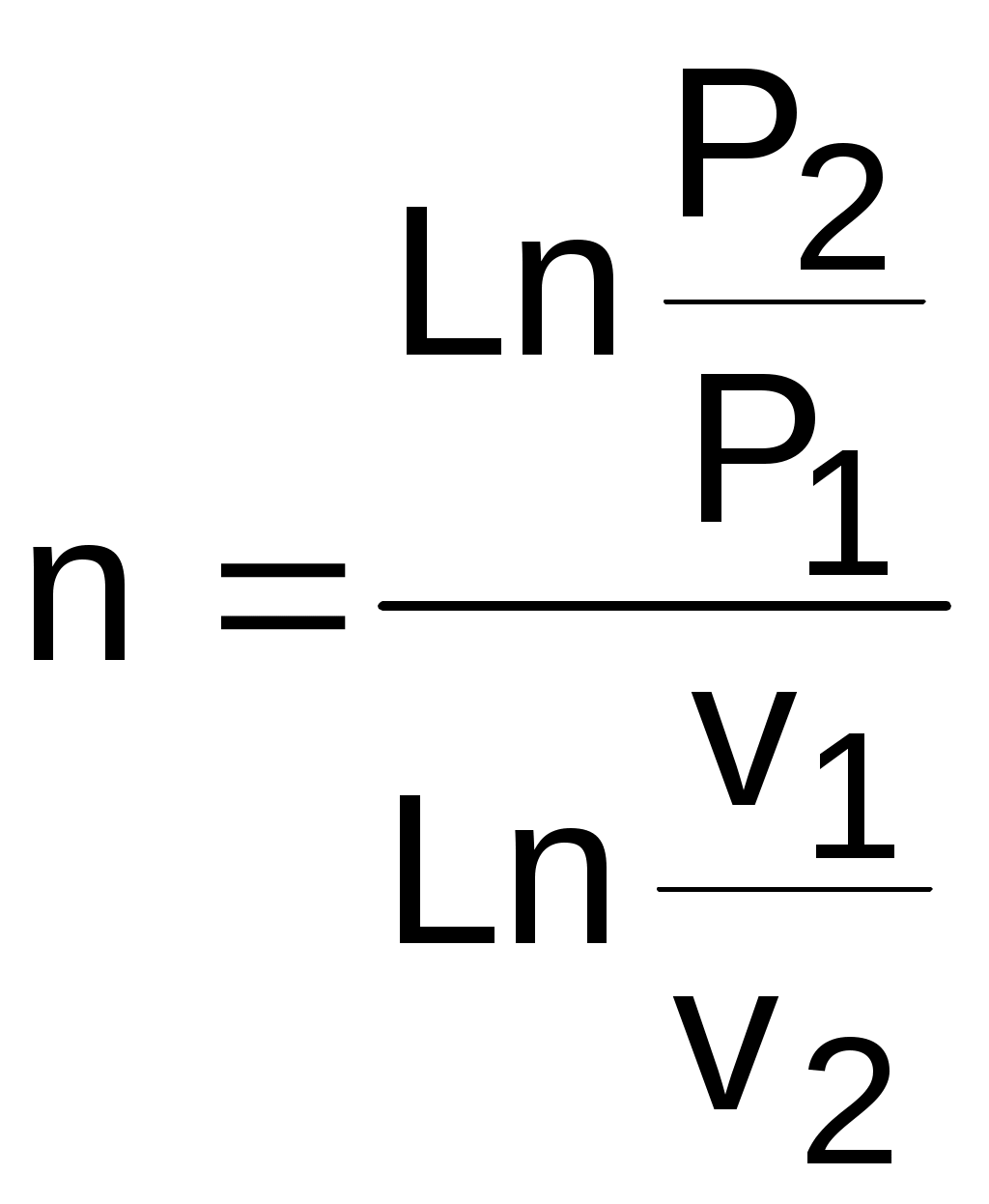 . (г) . (г) |
