современные химические методы анализа. Тема 1 Методы аналитической химии
 Скачать 465.58 Kb. Скачать 465.58 Kb.
|
|
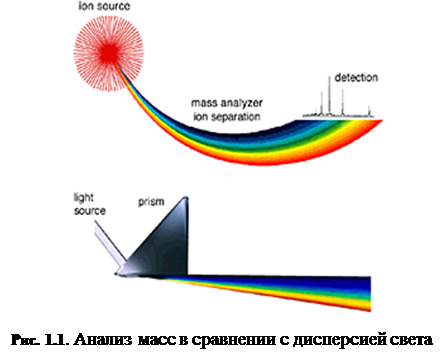
Тема № 6. Масс-спектроскопический метод анализа. Масс-спектрометр определяет массу молекулы, измеряя отношение массы к заряду (m / z ) её иона. Ионы генерируются при потере или получении заряда нейтральными частицами. После образования ионы электростатически направляются в анализатор массы, где они разделяются соответственно своему m / z и, наконец, детектируются. Результатом ионизации молекул, разделения ионов и детектирования ионов является спектр, по которому можно определить молекулярную массу и даже некоторую информацию о строении вещества. Можно провести аналогию между масс-спектрометром и призмой, как показано на рис. 1.1 . В призме свет разделяется на компоненты по длинам волн, которые затем определяются оптическим рецептором. Точно так же, в масс-спектрометре сгенерированные ионы разделяются в анализаторе массы, подсчитываются и определяются в детекторе ионов (таких, как, например, электронный умножитель).
Масс- спектроскопия положительных и отрицательных ионов Перенос соединений, уже заряженных в растворе, легко достигается при использовании десорбции или выбрасыванием заряженных частиц из конденсированной фазы в газовую. Обычно это осуществляется с использованием MALDI или ESI. Отрыв электрона Как видно из названия механизма, отрыв электрона придаёт молекуле 1+ положительный заряд при выбивании электрона, так что при этом часто образуются катион-радикалы. Наблюдаемый, в основном, при электронной ионизации, отрыв электрона обычно применяется для относительно неполярных соединений с низкой молекулярной массой. Также известно, что он часто приводит к образованию значительных количеств фрагментарных ионов. Захват электрона При захвате электрона, отрицательный заряд 1- сообщается молекуле при присоединении электрона. Этот механизм ионизации в первую очередь наблюдается для молекул с большим сродством к электрону, таких как галогенсодержащие соединения. Таблица 1.1. Механизмы ионизации, их преимущества и недостатки.
Метод ионизации. Механизмы ионизации. Протонирование – механизм ионизации, при котором к молекуле присоединяется протон, сообщая ей заряд 1+ на каждый присоединённый протон. Положительные заряды обычно локализуются на основных частях молекулы, таких, как амины, с образованием стабильных катионов. Пептиды часто ионизируются при помощи протонирования. Протонирование осуществляется при MALDI, ESI и APCI. Депротонирование– механизм ионизации, при котором отрицательный заряд 1- получается при отрыве протона от молекулы. Такой механизм ионизации обычно осуществляется при MALDI, ESI и APCI и очень полезен для определения кислотных образцов, включая фенолы, карбоновые кислоты и сульфоновые кислоты. Спектр отрицательных ионов сиаловой кислоты показан на рисунке: 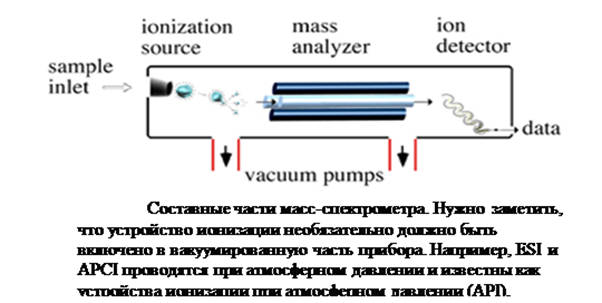 Катионизация – механизм ионизации, в котором заряженный комплекс образуется при координационном присоединении положительно заряженного иона к нейтральной молекуле. В принципе, пртонирование тоже подпадает под это определение, поэтому катионизацией считается присоединение иона, отличного от протона, например щелочного металла или аммония. Кроме того, катионизация применима к молекулам, которые неспособны к протонированию. Связь катионов, в отличие от протонов, с молекулой менее ковалентна, поэтому заряд остаётся локализован на катионе. Это минимизирует размывание заряда и фрагментацию молекулы. Катионизация также может быть произведена при MALDI, ESI и APCI. Углеводы – лучшие вещества для такого механизма ионизации, с Na+ как обычным присоединённым катионом. Масс-спектральные приборы. Масс анализаторы. Четыре базовых компонента являются стандартными для большей части масс-спектрометров: система ввода образца, устройство ионизации, анализатор массы и детектор ионов.  Некоторые приборы комбинируют ввод образца и ионизацию, в других объединены анализатор массы и детектор. Однако все молекулы образца претерпевают одинаковые воздействия независимо от конфигурации прибора. Молекулы образца вводятся через систему впуска. Попав внутрь прибора, молекулы преобразуются в ионы в устройстве ионизации, а затем электростатически переносятся в анализатор массы. Ионы затем разделяются соответственно их m / z . Детектор преобразует энергию ионов в электрические сигналы, которые затем поступают в компьютер. Тема 7. Ядерно-физические методы анализа Радиометрический анализ Радиометрический анализ — метод определения качественного и количественного состава вещества, основанный на использовании радионуклидов, обычно вводимых в реагенты или образующихся в анализируемом веществе под действием ядерных частиц или жестких γ-лучей. Результаты радиометрического анализа получают по данным измерений радиоактивности продуктов реакции с помощью радиометрических приборов. Различают несколько способов радиометрического анализа. Прямое радиометрическое определение основано на осаждении определяемого иона в виде нерастворимого осадка избытком реагента известной концентрации, содержащего радиоактивный изотоп с известной удельной активностью. После осаждения устанавливают радиоактивность осадка или избытка реагента. Радиометрическое титрование основано на том, что определяемый в растворе ион образует с реагентом малорастворимое или легко экстрагируемое соединение. Индикатором при титровании служит изменение, по мере введения реагента, радиоактивности раствора (в 1-м случае) и раствора или экстракта (во 2-м случае). Точка эквивалентности определяется по излому кривой титрования, выражающей зависимость между объемом введенного реагента и радиоактивностью титруемого раствора (или осадка). Радиоактивный изотоп может быть введен в реагент или определяемое вещество, а также в реагент и определяемое вещество. Метод изотопного разбавления основан на тождественности химических реакций изотопов данного элемента. Для его осуществления к анализируемой смеси добавляют некоторое количество определяемого вещества m0, содержащего в своем составе радиоактивный изотоп с известной радиоактивностью I0. Нейтронно-активационный анализ Нейтронно-активационный анализ представляет собой метод качественного и количественного определения элементов, основанный на измерении характеристик излучения радионуклидов, образующихся при облучении материалов нейтронами. Методика нейтронно-активационного анализа основана на измерении параметров излучения, испускаемого при распаде радиоактивных ядер, образовавшихся в результате облучения материала нейтронами. Наиболее подходящим источником нейтронов для такого применения, как правило, является исследовательский реактор. Образцы, которые могут быть проанализированы с помощью этого метода, связаны с рядом различных областей, включая медицину, питание, биологию, химию, криминалистику, охрану окружающей среды и добычу полезных ископаемых. Нейтронно-активационный анализ может проводится различным образом. Это зависит от элемента и соответствующих уровней излучения, подлежащего измерению, а также от характера и степени помех от других элементов, присутствующих в образце. Большинство используемых методов являются неразрушающими и основываются на регистрации гамма-излучения, испускаемого облученным материалом после или во время облучения. Нейтронно-активационный анализ является наиболее широко используемым после образования и обучения применением исследовательских реакторов. Практически любой реактор, работающий в режиме тепловой мощности 10-30 киловатт, способен создавать поток нейтронов, достаточный для облучения образцов, используемых в некоторых применениях этого метода анализа. Затраты на создание установки для нейтронно-активационного анализа относительно невелики по сравнению с затратами на инструментальные средства рассеяния нейтронов. Так как многие из применений определения микроэлементов (идентификация элементов при их низкой концентрации, например, используется в пищевой промышленности и анализе воды, медицине и т.д.) могут быть непосредственно связаны с потенциальными экономическими выгодами, нейтронно-активационный анализ рассматривается в качестве ключевого компонента большинства стратегических планов в отношении исследовательских реакторов. Тема 8. Биохимические методы анализа Капиллярный электрофорез Методы биохимических исследований В биохимии широко применяют диализ, центрифугирование, оптические методы, различные виды хроматографии и др. Оптические методы В основу абсорбционной спектроскопии положен принцип измерения поглощения света, проходящего сквозь раствор исследуемого вещества, вследствие его абсорбции. Измерение спектров осуществляют на специальных спектральных аппаратах, в которых пробу вещества помещают между источником света и фотоэлементом, регистрирующим свет. Каждое вещество имеет характерный свет поглощения. Для аналитических целей используют длину волны, соответствующую максимуму поглощения исследуемого соединения (λmax). Фотоэлектроколориметрия – это измерение поглощения видимой части спектра окрашенными растворами. Собственно спектрофотомерия – это измерение поглощения (пропускания) прозрачных растворов в ультрафиолетовой, видимой и инфракрасной зонах спектра (220-1100 нм). Нефелометрия – метод измерения интенсивности рассеянного света. К приборы, базирующимся на измерении светопоглощения веществ, относятся фотоэлектроколориметры (ФЭК) и спектрофотометры (СФ). ФЭК позволяют проводить измерения поглощения в видимой части спектра. СФ дают возможность проводить измерения в широком диапазоне длин волн – от ультрафиолетового до инфракрасного (210-1100 нм) и исследовать окрашенные и бесцветные растворы в узкой зоне спектра, на участке максимального поглощения монохроматического потока света. В основе абсорбционной спектрофотометрии лежат общие принципы способности веществ поглощать световую энергию по законом Бугера-Ламберта и Бера: D = k c d; где D – оптическая плотность раствора; k – молярный коэффициент поглощения (экстинкция), который равен оптической плотности 1 М раствора при толщине слоя в 10 мм; с – концентрация раствора, моль/л; d – толщина слоя жидкости, см. Электрофорез Явление электрофореза – это перемещение заряженных частиц в электрическом поле. Поведение частицы в электрическом поле описывается тремя основными характеристиками: скоростью движения частицы v, электрокинетическим потенциалом и электрофоретической подвижностью U. -потенциал прямо пропорционален свободному (не скомпенсированному ионами среды) заряду частицы (Q) и обратно пропорционален ее радиусу (r). Скорость заряженной частицы прямо пропорциональна -потенциалу. Электрофоретическая подвижность U равна отношениюскорости частицы к напряжению электрического поля. г – диэлектрическая постоянная среды, – вязкость среды. Наиболее часто метод используют для аналитических целей – для разделения смеси заряженных веществ на фракции с последующим качественным и количественным их определением. Таким способом удается разделить, например, белки сыворотки крови на 5 фракций: альбумин и 4 фракции глобулинов. Эту задачу часто решают в клинической биохимии, так как соотношение фракций закономерно изменяется при многих патологических процессах. Метод подразделяется на фронтальный или свободный электрофорез (электрофорез в жидкой среде) и зональный или электрофорез в поддерживающих средах. В качестве поддерживающих сред применяются различные инертные пористые природные либо синтетические материалы: бумага, ацетилцеллюлоза, крахмал в виде влажных зерен и в виде геля, гель агара либо агарозы, полиакриламидный синтетический гель – ПААГ. Задача поддерживающей среды – стабилизировать жидкость, уменьшить диффузию, а в ряде случаев – создать дополнительный механизм разделения. Например, в некоторых вариантах метода разделение по электрофоретической подвижности можно сочетать с разделением по молекулярной массе (наилучшим образом это достигается в ПААГ). Одной из высокоразрешающих разновидностей метода является диск-электрофорез (от английского «discontinuos» - прерывистый, неоднородный). В этом методе движение молекул проходит вначале через концентрирующий крупнопористый гель, где разделяемая смесь концентрируется благодаря движению между 2-мя сортами ионов. Движущиеся впереди пробы ведущие ионы (принадлежат сильному электролиту) и находящиеся позади пробы замыкающие ионы (принадлежат слабому электролиту) создают разную напряженность поля по обе стороны зоны, занятой пробой. Вследствие этого «фронт» пробы тормозится, а «тыл», напротив, подгоняется. Таким путем достигается эффект концентрирования. Затем проба переходит в разделяющий гель с иным значением рН буферного раствора. Вследствие изменения рН (а значит, и степени диссоциации слабого электролита) замыкающие ионы опережают пробу, которая перемещается теперь на фоне замыкающих ионов - оказывается в однородной по рН мелкопористой среде. В этом втором, разделяющем геле происходит обычный электрофорез. Повышение разрешающей способности метода достигается за счет того, что перед разделением проба концентрируются в виде очень узкой стартовой зоны, и таким образом удается разделить даже вещества, мало отличающиеся друг от друга по свойствам. Хроматография Хроматографические методы основаны на динамическом разделении смеси веществ. Общий принцип хроматографии состоит в том, что непрерывный поток подвижной фазы, содержащей анализируемый образец, направленно проходит через стационарную фазу, которая в зависимости от своей природы, взаимодействует в различной степени с компонентами образца. Распределение соединения между двумя несмешивающимися фазами определяется коэффициентом распределения, который для каждого конкретного вещества в системе из двух фаз при данной температуре постоянен и выражается отношением концентрации вещества в подвижной фазе к его концентрации в стационарной фазе. Фазы для хроматографического разделения выбирают так, чтобы коэффициенты распределения компонентов смеси в них были различными. В зависимости от агрегатного состояния подвижной фазы хроматографические методы делят на газовую и жидкостную хроматографию; в зависимости от геометрической формы стационарной фазы – на колоночную и плоскостную (бумажную или тонкослойную). В зависимости от механизма разделения веществ выделяют следующие виды хроматографии: Адсорбционная хроматография основана на различной адсорбируемости компонентов разделяемой смеси на поверхности раздела фаз. Эти различия связаны главным образом с различиями в дипольных моментах (в полярности) разделяемых веществ, а также подвижной и неподвижной фаз хроматографической системы. Так, из полярной подвижной фазы на неполярном адсорбенте лучше адсорбируются неполярные вещества. Примером неполярного адсорбента может служить активированный уголь, сажа; полярного – окислы металлов, гидроокиси, некоторые соли, силикагель, полисахариды. Абсорбционная или распределительная хроматография основана на различной абсорбируемости (поглощении всем объемом стационарной жидкой фазы, растворимости в ней) компонентов разделяемой смеси. В основе метода также лежит соотношение дипольных моментов разделяемых веществ и компонентов хроматографической системы. Примером распределительной хроматографии может служить разделение аминокислот в системе бутанол-вода либо фенол-вода. Стационарная полярная фаза – вода - удерживается инертным пористым твердым телом – бумагой, силикагелем и т.п.. Бутанол – неполярная подвижная фаза содержит компоненты разделяемой смеси и движется относительно воды, удерживаемой твердой пористой подложкой. Хемосорбционные методы основаны на использовании хемосорбции. Наиболее распространенным из них является ионообменный метод, в котором используются различия в константах диссоциации разделяемых веществ-электролитов. Разделяемые вещества в виде катионов или анионов обратимо обмениваются на катионы или анионы, содержащиеся в стационарной твердой фазе (катионите или анионите, соответственно). Подвижная фаза – полярный растворитель (обычно буферный или солевой водный раствор). В качестве твердого пористого тела, содержащего прикрепленные к нему обмениваемые ионы, служат природные или синтетические полимеры – ионообменные смолы (целлюлоза, декстран, агароза, полиакриламид, полистирол). Гель-хроматография или молекулярно-ситовая хроматография основана на разделении веществ в соответствии с их размерами (молекулярными массами). В этом методе используются те же пористые тела, что служат основой для ионообменной хроматографии, но без прикрепленных к ним ионогенных групп. Материал стационарной фазы представляет собой сферические гранулы определенного размера, внутри которых имеются поры. Размер пор также стандартен и выбирается так, чтобы обеспечить хорошую разрешающую способность метода. Наиболее крупные молекулы не могут проникнуть во внутренние мелкие поры и передвигаются только по промежуткам между гранулами. Они идут с наибольшей скоростью. Более мелкие частицы движутся с разными скоростями, в зависимости от того, какая доля объема внутренних пор доступна для них в соответствии с их размерами. Медленнее всех движутся самые мелкие молекулы. Аффинная хроматография. Метод основан на специфическом сродстве (affinity) некоторых биологически активных веществ друг к другу. Один из партнеров – аффинант – обездвиживают (иммобилизуют) на твёрдой пористой подложке, вместе с которой он образует стационарную фазу. Второй партнер содержится в подвижной фазе. Аффинная хроматография позволяет выделить его из смеси любой степени сложности. Так, при пропускании через крахмал был выделен из панкреатического сока только один из его компонентов – фермент амилаза, для которого крахмал является субстратом. Наиболее распространенные пары веществ: фермент и субстрат, фермент и ингибитор, фермент и кофермент, антитело и антиген, рецептор и сигнальная молекула, транспортный белок и транспортируемое им вещество, комплементарные друг другу нуклеотиды. В связи с чем аффинная хроматография широко используется для очистки антигенов и антител, гормонов, рецепторов, транспортных белков, ферментов и т.п. Метод центрифугирования Разделение и исследование веществ с помощью центрифугирования основано на разной скорости оседания (седиментации) в центробежном поле частиц, имеющих разную плотность, форму или размеры. Коэффициент седиментации зависит от молекулярной массы и формы частицы, а также от плотности и вязкости среды выделения, что используется для определения молекулярной массы. |