Иммунология,ответы на тесты. Тесты коллоквиум 2 Верно Возможный ответ Неверно Выберите характеристики, относящиеся к ртга (рзга)
 Скачать 2.49 Mb. Скачать 2.49 Mb.
|
Определение напряженности гуморального иммунного ответа. ИФА методы постановки и учетаТема. Метод иммуноферментного анализа ( )В настоящее время ИФА является самым распространенным методом. Простота постановки, высокая чувствительность, автоматизированная процедура анализа, компьютерная обработка данных – именно эти возможности и привлекают практиков и исследователей. Предложенный в 70-х годах независимыми группами исследователей: Engvall и Perlmann в Швеции, Van Weeman и Schuurs в Нидерландах и Rubenstein с совт. в США он нашел широкое применение в практике. В качестве метки используются ферменты: пероксидаза, щелочная фосфатаза и др. Индикатором реакции является способность ферментов вызывать цветные реакции при действии на соответствующий субстрат. Например, субстратом для пероксидазы является раствор ортофенилдиамина. Наиболее широко применяется твердофазный ИФА (рис. 11, 12,13). Сущность ИФА аналогична РИА. Результаты ИФА можно оценить визуально и измерением оптической плотности на спектрофотометре. К преимуществам ИФА следует отнести: - отсутствие контакта с радиоактивными веществами; - простота методов оценки реакции; - стабильность конъюгатов; - легко поддаётся автоматизации. ИФА применяют в двух направлениях: 1) Обнаружение специфических антител в сыворотках крови (при оценке эпизоотической ситуации, ретроспективной диагностике) с диагностической целью и для контроля напряженности поствакцинального иммунитета. В этом случае из двух компонентов реакции неизвестными являются антитела. Поэтому постановка реакции требует исследования с заведомо известными антигенами; 2) Выявление и идентификация микроба или вируса (установление родовой, видовой и типовой принадлежности). В этом случае неизвестным компонентом реакции является антиген. Исследование проводят с заведомо известными иммунными сыворотками, которые получают путем гипериммунизации животных (кролики, морские свинки и др.) соответствующими антигенами. Иммуноферментный анализВ качестве антигенов при серологической диагностике применяют живые или инактивированные вирусы. С этой целью используют аллантоисную, амниотическую жидкость, суспензии хорион-аллантоисных оболочек и желточных мешков куриных эмбрионов, культуральную жидкость и клетки (экстракт) тканевых культур, гомогенаты из органов животных, зараженных определенными инфекционными агентами. При обнаружении антител для правильного ответа желательно иметь парные образцы сыворотки (т.е. сыворотка, полученная при появлении первых признаков болезни и через 2-3 недели после ее начала). Отобранные пробы хранят в морозильной камере бытового холодильника и доставляют одновременно. При этом необходимо иметь в виду, что тесты обычно не могут показать разницу между антителами на вакцинные штаммы, или на полевые вирусы. Для определения напряженности поствакцинального иммунитета в лабораторию доставляют сыворотки крови от вакцинированных животных спустя 3-4 недели после применения вакцины. Сущность метода ИФАИФА основан на выявлении специфического комплекса “антиген-антитело” с помощью ферментного маркера, фиксированного на антителах или антигенах (коньюгатах), активность которого проявляется хромогенным субстратом, изменяющим цвет при положительной реакции. На практике самое широкое применение нашел твердофазный способ постановки, при котором антиген или антитело адсорбируют на твердые носители: макропористые – стекло, биогель, сефароза и др.; непористые – полихлорвинил, полистерол, дакрил, нейлон и др. Для ферментативной метки коньюгата могут быть применены разнообразные ферменты: пероксидаза хрена, щелочная фосфотаза, бета-галактозидаза, глюкозооксидаза и др. В качестве субстрата чаще всего применяют 5-АСК (5-аминосалициловая кислота, пероксидазу хрена, щелочную фосфатазу, или ортофенилендиамин (ОФД)). Постановка реакции. Постановка твердофазного иммуноферментного анализа включает несколько этапов, последовательность которых зависит от намеченных целей исследования. Обнаружение антигена (метод двойных антител “сэндвич”)Сенсибилизация планшетов. Гамма-глобулины, выделенные из иммунной сыворотки, в концентрации 10-20 мкг/мл вносят по 0,1 см3 в каждую лунку. Планшет закрывают крышкой и оставляют в холодильнике при 4°С на 18-24 ч., или в термостате на 3-4 ч при 37°С. После инкубации раствор иммуноглобулинов сливают, планшет подсушивают (постукиванием о фильтровальную бумагу) в течение 1-2 мин и промывают трехкратно по 3-5 минут буферным раствором с рН 7,4, содержащим 0,05% твина 20. Для блокировки свободных поверхностей твердой фазы в лунки вносят по 0,1 см3 1% раствора бычьего сывороточного альбумина (БСА) (нейтральный белок), или 1% лошадиной сыворотки и планшет оставляют на 30 мин при 37°С. После 30 мин экспозиции лунки промывают трехкратно по 3-5 мин и подсушивают. Внесение компонентов. Из исследуемого материала, готовят ряд последовательных разведений и вносят по 0,1 мл в лунки планшета, который затем инкубируют в термостате в течение 1 ч. Содержимое лунок выливают, лунки отмывают промывным буферным раствором трехкратно по 3 мин. Затем в лунки вносят специфическую сыворотку и рабочее разведение конъюгата (специфические антитела меченые ферментом), который готовят на 0,1 М ФБР рН 7,4 с твином-20 (0,05%). Планшеты инкубируют в течение 1 ч в термостате при 37°С. Промывают 3-4 раза по 3 минуты и в каждую лунку планшета вносят рабочий раствор субстрата. После 30 минутной инкубации реакцию останавливают добавлением 0,05 см3 «стоп-раствора». Контроли реакции: 1. Положительный контроль. Реакция с заведомо известным антигеном. S+ (позитивная сыворотка) + Аг+ (положительный антиген). 2. Отрицательный контроль. Реакция с заведомо отрицательным антигеном. S+ (позитивная сыворотка) + Аг- (отрицательный антиген). 3. Контроль субстрата. В сенсибилизированную лунку вносят только рабочий раствор субстрата. Содержимое лунки должно оставаться без изменения. Обнаружение антител (метод с использованием меченых вторичных антител и иммобилизованных антигенов)1. Разведение исследуемых сывороток. Образцы исследуемых проб сывороток крови разводят 0,01М калий-фосфатным буфером с 0,5М хлоридом натрия (рН 7,2-7,4) и твином-20 (раствор №1) до конечной концентрации 0,05% в плексигласовых плашках. С этой целью к 0,01см3 (10 мкл) сыворотки крови добавляют 1,0 см3 раствора, перемешивают и получают разведение 1:100. 2. В три лунки планшета вертикального ряда А1, В1, С1 вносят по 0,1 см3 положительной сыворотки крови (положительный контроль), а в три следующие лунки D1, E1, F1 вносят по 0,1 см3 отрицательной сыворотки крови (отрицательный контроль). Лунки G1, H1 служат для контроля раствора конъюгата и субстратно-индикаторной смеси (фоновый контроль), в которые вносят по 0,1 см3 раствора №1. 3. В остальные лунки планшета рядов В2-В12…Н2-Н12 вносят по 0,1см3 раствора №1, а в лунки горизонтального ряда А2-А12 – по 0,2см3 исследуемых проб сыворотки крови, подготовленных по п.1. и проводят раститровку по вертикальным рядам начиная от разведения 1:100 до 1:12800. С этой целью из лунок А2-А12 отбирают по 0,1см3 разведенных исследуемых проб сывороток крови и переносят в лунки В2-В12 соответствующего ряда, пипетируют и проводят двукратные последовательные разведения сывороток переносом по 0,1см3 в очередную лунку вертикального ряда, удаляя из последних лунок Н2-Н12 по 0,1 см3 содержимого. 4. Планшет осторожно встряхивают для перемешивания содержимого, закрывают крышкой и переносят в термостат (370С) на 30 мин. Затем лунки планшета освобождают от содержимого путем вытряхивания, трехкратно промывают (по 3 мин.) раствором №1 и подсушивают (путем постукивания планшетом по фильтровальной бумаге). 5. Готовят антивидовой конъюгат и вносят во все лунки планшета по 0,1 см3, затем помещают в термостат на 30 мин. После этого содержимое удаляют, лунки трехкратно промывают и подсушивают. 6. Во все лунки планшета вносят по 0,1см3 раствора субстратно-индикаторной смеси: ортофенилендиамина или 5-аминосалициловой кислоты (для пероксидазы), и p-нитрофенилфосфата (для щелочной фосфотазы) оставляют при комнатной температуре в темном месте на 10-15 мин. 7. Выявление специфических антител можно проводить и без раститровки исследуемых сывороток. В этом случае вначале проводят раститровку контрольных образцов сывороток: положительной и отрицательной. Предварительно в лунки планшета от В11 и В12 до Н11 и Н12 вносят по 0,1см3 раствор №1, а затем в лунки А11 и А12 вносят по 0,2см3 соответственно положительной и отрицательной сывороток в разведении 1:100 и проводят последовательную двукратную раститровку контрольных сывороток из набора по вертикальным рядам от 1:100 до 1:12800, удаляя из последних лунок по 0,1 см3 содержимого. Для визуального или спектрометрического учета результатов реакции образцы исследуемых (испытуемых) проб сывороток крови берут в разведении 1:100 и вносят по 0,1см3 в свободные лунки планшета, используя по одной лунке на каждую пробу. Остальные этапы постановки анализа проводят аналогично п.п. 4; 5; 6. При спектрометрическом учете результатов анализа во все лунки планшета, для остановки реакции, необходимо внести по 0,05см3 «стоп-раствора» в рабочем разведении (2н.серная кислота – для пероксидазы и 3М NAOH - для щелочной фосфатазы). Контроли реакции: 1. Положительный контроль. Реакция с заведомо положительной сывороткой. Аг+ (положительный антиген) + S+ (позитивная сыворотка). 2. Отрицательный контроль. Реакция с заведомо отрицательной сывороткой. Аг+ (положительный антиген) + S- (негативная сыворотка). 3. Контроль субстрата. В сенсибилизированную лунку вносят только рабочий раствор субстрата. Содержимое лунки должно оставаться без изменения Учет результатов анализа проводят через 10-15 минут одним из способов: визуально по интенсивности окрашивания содержимого лунок планшета или инструментально - с помощью спектрофотометра с вертикальным лучом света путем измерения оптической плотности при длине волны 492 нм. В положительном случае в лунках планшета появляется окрашивание от слабо желтого до коричневого цветов. В отрицательных пробах содержимое лунок бесцветное. Визуальная оценка результатов1. При визуальной оценке результатов первоначально проводят учет реакции по контрольным лункам планшета: в лунках с положительной сывороткой (лунки А1, В1, С1 и ряд А11…Н11) окрашивание должно быть от светло-желтоватого до интенсивно-желтого цвета. С разведением положительной сыворотки интенсивность окрашивания уменьшается. Окрашивание содержимого лунок с отрицательной сывороткой и без сыворотки (фоновый контроль) должно отсутствовать или иметь незначительную бледно-желтую окраску (лунки D1, E1, F1, G1, H1 и ряд А12…Н12). Реакция учитывается при правильных показаниях контролей. Это дает основание считать, что компоненты набора соответствуют требованиям ТУ и можно приступить к учету реакции с пробами испытуемых сывороток. 2. Визуальный учет результатов основан на сравнении интенсивности окраски содержимого лунок планшета испытуемых проб сывороток крови с окраской лунок контрольного положительного образца (вертикальный ряд А11…Н11). Интенсивность цветной реакции прямо пропорциональна количеству антител в исследуемых пробах сыворотки крови. Чем выше интенсивность окраски содержимого лунок (от желтоватого до интенсивно-желтого), тем выше титр антител в исследуемых пробах. 3. При постановке реакции без раститровки, титр сыворотки определяют по интенсивности окрашивания различных разведений испытуемых проб положительной и отрицательной контрольных сывороток (ряды А11,12…Н11,12), которые являются как бы эталонной шкалой для оценки результатов. 4. В случае необходимости точного определения титра сыворотки ее раститровывают. Раститровка проб испытуемых сывороток крови дает возможность количественно оценивать титр специфических антител. За титр испытуемой сыворотки крови принимают ее последнее разведение, при котором еще достаточно четко видна разница цветового окрашивания по сравнению с сывороткой отрицательного контроля (лунки планшета А12…Н12). Положительными считаются пробы сывороток, имеющие окраску разной степени интенсивности, содержимое лунок которых сравнимо с окраской положительной контрольной сыворотки (лунки планшета А11…Н11). Инструментальный – спектрофотометрический учет результатов Инструментальный – спектрофотометрический учет результатов анализа позволяет количественно оценить титр специфических антител в исследуемых пробах путем измерений оптической плотности (ОП) при длине волны 492 нм с одновременной записью результатов с каждой лунки планшета на листе бумаги или специальной бумажной ленте. При спектрофотометрическом учете результаты оптической плотности выражают в оптических единицах. О результатах реакции судят по коэффициенту соотношений между показателями оптических плотностей исследуемых проб сывороток к таковым отрицательного контрольного образца. Для положительной реакции коэффициент соотношений должен превышать более чем в 2,01-2,1 раза оптическую плотность отрицательного контроля, что свидетельствует о выявлении специфических антител в исследуемой пробе. Для отрицательной реакции коэффициент соотношений между показаниями оптических плотностей должен быть меньше 2,0, что свидетельствует об отсутствии специфических антител в исследуемой пробе сыворотки. Если коэффициент соотношений оптических плотностей равен 2,0, то реакция оценивается как сомнительная, а испытуемая проба сыворотки крови подлежит повторному исследованию и при подтверждении первоначального результата считается положительной. Пример спектрофотометрического учета ИФА с использованием системы AIDEX. Количество искомого в пробе материала определяется по заранее построенной стандартной кривой в зависимости от оптической плотности пробы. В настоящее время зарубежными фирмами для крупных клинических лабораторных центров разработаны полностью автоматизированные установки, которые позволяют проводить несколько тысяч анализов в день. Принцип считывающего (регистрирующего) устройства основан на спектрофотометрической регистрации процессов изменений продукта ферментативной реакции. Измеряемым параметром при этом служит оптическая плотность продукта реакции энзим-субстрат, образовавшегося за определенный промежуток времени. Данные представлены в форме гистограммы. А – идентификация стада, количество знаков в кодовом номере может доходить до 16 и описывать исследуемое стадо. В – заболевание, на которое стадо исследовалось. С – дата проведения исследования. Д – количество взятых в стаде образцов. Е – средний титр по исследованным образцам. F – коэффициент корреляции (К.В.) – статистический параметр, показывающий колебания в стаде. Стадо с К.В. менее чем 35% - это стадо, в котором все животные имеют одинаковую чувствительность. Высокий коэффициент вариации указывает на то, что в стаде большие отклонения в чувствительности, чем обычно ожидается. G – фактор разведения исследованных образцов. Н – номера титрогрупп. I – количество образцов, попадающих в определенную группу титров. Титры могут колебаться от 0 и до более чем 32000 Интерпретация результатовПо результатам ИФА определяют напряженность иммунитета путем деления количества проб с титром антител 1:400 и выше к общему количеству исследованных сывороток и выражают в процентах. Животных считают иммунными при напряженности иммунитета 80 и более процентов (т.е. если в 80 и более процентах проб сывороток крови титр антител достигает значения 1:400 и выше). Животных вакцинируют (ревакцинируют) при напряженности иммунитета менее 80%. Обнаружение высокого уровня антител свидетельствует о возможной циркуляции в стаде полевого вируса. В таких случаях через 21-30 дней проводят повторное исследование проб сывороток крови, полученных от этих же животных. Снижение или стабилизация уровня антител и (или) уменьшение количества животных с высоким уровнем антител при повторных исследованиях проб сывороток крови свидетельствует об отсутствии циркуляции в хозяйстве эпизоотического вируса и является следствием поствакцинальных реакций. Обнаружение антител к вирусу у не вакцинированных животных, без клинических и патологоанатомических признаков заболевания свидетельствует о циркуляции природно-ослабленных или вакцинных штаммов вируса. Реакция иммунофлюоресценции (РИФ) В качестве метки используются светящиеся флюорохромные красители (изотиоционатфлюоресцеина и др.). Существуют различные модификации РИФ (рис.9). Методы флуоресцирующих антител (МФА). Относятся к иммунологическим методам основанными на принципе специфического взаимодействия антигена со специфическими антителами, предварительно окрашенными флуорохромами (чаще всего с этой целью используют флуоресцеинаизотиоцианат (ФИТЦ). Эта краска имеет салатно-зеленый свет. Свечение антигена происходит не за счет непосредственного его окрашивания, а за счет связавшихся с ним окрашенных специфических антител. Образовавшийся комплекс «антиген-антитело-флуорохром» позволяет быстро обнаруживать разные антигены (вирусы, риккетсии, бактерии), а также выявлять специфические белки, ферменты, полисахариды в клетках и тканях. МФА являются по своей сущности разновидностью серологических реакций, но ставятся они не в пробирках, а на предметном стекле (в мазках). Широкое применение метод нашел при диагностике многих вирусных болезней - бешенство, грипп, болезнь Аусеки, вирусный гепатит и чума плотоядных, оспа, ИРТ, ИЛТ и многие др. Достоинства: быстрота выполнения (за два-три часа возможно обнаружить антиген непосредственно в патологическом материале, без выделения в чистой культуре; высокая чувствительность и специфичность; относительная дешевизна. Недостатки: отсутствие инструментального учета; субъективность оценки результатов; необходимость обучения и опыта работы. Все методы флуоресцирующих антител можно разделить на 2 варианта: 1) Прямой МФА; 2)Непрямые МФА: а) с использованием антивидовой флуоресцирующей сыворотки или иммуноглобулина; б) с использованием антикомплементарной флуоресцирующей сыворотки или иммуноглобулина. 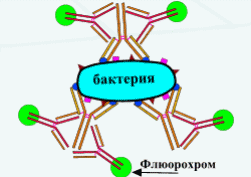 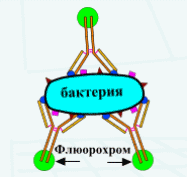 а б Рис. 9. Реакция иммунофлюоресценции: а - прямая; б – непрямая Прямой МФА. На предметное стекло с фиксированным на нем мазком (или мазком-отпечатком) из вируссодержащего материала наносят небольшое количество (2-3 капли) специфической предполагаемому антигену (вирусу) флуоресцирующей иммунной сыворотки и выдерживают во влажной камере (в чашке Петри с кусочком ваты, смоченной водой) в термостате в течение 30-40 минут при 37°С, а затем промывают буферным солевым раствором и дистиллированной водой, высушивают на воздухе и просматривают под иммерсионной системой в люминесцентном микроскопе. Если антиген и антитела специфичны, образуется комплекс «антиген + антитело», который не смывается при промывании мазка, а при микроскопии препарата будет отчетливо видно яркое салатно-зеленое свечение антигена за счет адсорбированных на нем флуоресцирующих антител. Если же антитела были неспецифичны антигену, то свечения не будет, так как не связавшиеся антитела удаляются при промывании. Недостаток прямого метода: в лаборатории на каждый вирус необходимо иметь специфическую флуоресцирующую сыворотку или глобулины, а они сравнительно дорогие и имеют короткий срок хранения. Непрямые МФА. Сущность метода -флуоресцирующие антитела адсорбируются не на сам вирусный антиген, а на посредника, в качестве которого может быть специфическое вирусному антигену неокрашенное антитело (при антивидовом методе) или комплемент (при антикомплементарном методе). Непрямой МФА с использованием антивидовой флуоресцирующей сыворотки. Постановка: на фиксированный мазок или отпечаток наносят специфическую предполагаемому в мазке антигену (вирусу) иммунную неокрашенную сыворотку или иммуноглобулин, и выдерживают во влажной камере в термостате при 37°С 30-40 минут, затем промывают буферным раствором. Если в мазке имеется антиген специфичный антителам сыворотки, образуется комплекс «антиген + антитело» (Аг + Ат), который не смывается при промывании мазка, но и не светится в люминесцентном микроскопе. Поэтому мазок дополнительно обрабатывают флуоресцирующей антивидовой сывороткой или глобулином (антивидовую сыворотку или глобулин получают путем гипериммунизации кроликов или других видов животных сывороткой или глобулинами того вида животных, на которых получают специфическую для вируса гипериммунную нефлуоресцирующую сыворотку и такую антивидовую сыворотку обрабатывают флуорохромом, обычно ФИТЦ). Антивидовую флуоресцирующую сыворотку наносят на мазок и выдерживают во влажной камере при 37°С 30-40 минут, затем промывают водой или буфером и водой, высушивают на воздухе и микроскопируют. Антитела из флуоресцирующей антивидовой сыворотки, если они специфичны глобулинам неокрашенной иммунной противовирусной сыворотки, адсорбируются на комплексе Аг + Ат и образуется новый комплекс «Аг(вируса) + Atпротивовирусной неокрашенной сыворотки (они же являются Аг для антивидовой сыворотки) + Ат (флуоресцирующие) антивидовой сыворотки». При просмотре под люминесцентным микроскопом образовавшийся комплекс будет светиться ярко салатно-зеленым цветом за счет флуоресцирующих антител антивидовой сыворотки. Если же в первом этапе обработки компоненты были неспецифичны или в мазке не было антигена, комплекс «Аг + Ат» не образуется, а антивидовые флуоресцирующие антитела, при промывании мазка смоются и поэтому свечения не будет. Антивидовую сыворотку получают гипериммунизацией кроликов или другие виды животных сывороткой того вида животных, на которых получают специфическую для вируса гипериммунную нефлуоресцирующую сыворотку и обрабатывают флуорогромом, обычно ФИТЦ . Непрямой МФА с использованием антикомплементарной флуоресцирующей сыворотки. Сущность. Этот метод по своей сущности и технике является разновидностью РСК, но реакция ставится на предметном стекле. Вместо гемолитической системы используют флуоресцирующую антикомплементарную сыворотку, которую получают путем гипериммунизации кроликов нативной свежей сывороткой крови морской свинки (комплемент). Образующиеся у кролика антикомплементарные антитела, будут специфичны только белкам сыворотки крови морской свинки (комплементу), их обрабатывают флуорохромом, обычно ФИТЦ. Постановка. Мазок обрабатывают в два этапа: вначале наносят специфическую предполагаемому в мазке антигену (вирусу) нефлуоресцирующую иммунную сыворотку и комплемент в рабочих титрах, контактируют в термостате при 37°С во влажной камере 30-40 минут (реакция проходит в баксистеме), а затем промывают водой. В случае, если, как и в пробирочной РСК, антиген в мазке будет специфичен нанесенным антителам, образуется комплекс «Аг вируса + Ат», на который адсорбируется комплемент и весь этот комплекс «Аг вируса + Ат иммунной неокращенной сыворотки + комплемент» не смоется, но свечения под люминесцентным микроскопом не будет. Чтобы обнаружить этот комплекс, на мазок дополнительно наносят антикомплементарную флуоресцирующую сыворотку и вновь контактируют во влажной камере термостата 30-40 минут, после чего промывают, высушивают на воздухе и смотрят под люминесцентным микроскопом. Флуоресцирующие антитела из антикомплементарной сыворотки адсорбируются на комплексе и весь вновь образовавшийся комплекс «Аг вируса + Ат специфической неокрашенной противовирусной сыворотки + комплемент + антикомплементарное Ат» в результате будет ярко светиться салатно-зеленым цветом. Достоинство метода: для обнаружения в мазке любого антигена достаточно иметь в лаборатории лишь одну антикомплементарную флуоресцирующую сыворотку и наборы специфических гипериммунных неокрашенных сывороток. Антикомплементарную сыворотку получают путем гипериммунизацией кроликов свежей сывороткой морской свинки (комплемент) и у кролика образуются антикомплементарные антитела, которые будут специфичны белкам сыворотки крови морской свинки (комплементу) и в реакцию будут вступать только с сывороткой крови морской свинки, которая является комплементом в РСК. Антикомплементарную сыворотку обрабатывают флуорохромом ФИТЦ-ем и получается флуоресцентная антикомплементарная сыворотка. Радиоиммунологический анализ (РИА) В качестве метки используются радиактивные изотопы (131I, 125I, или 3H и 14C). В зависимости от техники постановки выделяют два способа РИА: 1) техника «жидкая фаза» (классический РИА). Недостаток этой техники постановки – необходимость специального разделения свободного и связанного меченного антигенов (или антител); 2) техника «твёрдая фаза». АГ или АТ известной специфичности связываются на сорбентах (твёрдой фазе) – стенках полистироловой лунке или пластиковой пробирки. На иммобилизованный АГ (АТ) последовательно сорбируются остальные компоненты ИК. В зависимости от характера реакции различают следующие методы: а) конкурентный метод – метод, основанный на конкуренции антигенов (определяемого и меченного) за присоединение с адсорбированными на сорбенте антителами или антител (определяемого и меченного) за присоединение с адсорбированными на сорбенте антигенами. Компоненты реакции: 1) определяемый АГ (исследуемый материал – кровь, мокрота и др.) или АТ (сыворотка крови); 2) идентичный к исследуемому АГ-у антиген или исследуемому АТ анти-тело, меченые радиоизотопом; 3) специфические АТ или АГ известной концентрации, связанные на сорбенте; 4) стандартный АГ или АТ (контрольный); 5) буферный раствор. Сначала в реакцию вводят исследуемый АГ (или АТ). Происходит образование комплекса АГ-АТ на поверхности сорбента. Сорбент отмывают, затем вводят меченый АГ (или АТ). Чем больше содержание исследуемого АГ (или АТ), тем меньше меченного АГ (или АТ) связывается с АТ (АГ) на поверхности сорбента. Концентрацию меченного АГ (или АТ) определяют измерением радиоактивности реакции с помощью счетчиков. Величина радиоактивности реакции будет обратно пропорциональной количеству АГ (АТ) в исследуемой пробе. б) неконкурентный метод. Компоненты реакции: 1) определяемый АГ; 2) специфические АТ известной концентрации, связанные на сорбенте; 3) идентичные к связанному антителу антитела, меченые радиоизотопом; 4) стандартный АГ; 5) буферный раствор. К связанным АТ добавляют исследуемый АГ. В процессе инкубации на сорбенте образуются комплексы АГ-АТ. Сорбент отмывают от свободных компонентов и добавляют меченые АТ, которые связываются со свободными валентностями АГ в составе комплекса. Величина радиоактивности пропорциональна концентрации исследуемого АГ. в) «Сэндвич-метод» (непрямой метод) – наиболее распространённый метод. Компоненты: 1) исследуемая сыворотка (или исследуемый АГ); 2) АГ, связанные на сорбенте (или АТ, связанные на сорбенте при определении АГ). 3) диагностические АТ против иммуноглобулинов, меченные радиоизотопами; 4) контрольные сыворотки (или АГ); 5) буферные раствор. Исследуемые АТ (или АГ) реагируют с твёрдофазными АГ (АТ), после чего инкубат удаляется и в реакцию вводят меченые антиглобулиновые АТ, которые связываются со специфическими комплексами АГ-АТ на поверхности сорбента. Величина радиоактивности реакции прямо пропорциональна количеству исследуемого АТ (или АГ). Достоинства РИА: - высокая специфичность и чувствительность; - простота техники постановки; - точность количественной оценки результатов; - легко поддаётся автоматизации; Недостаток: использование радиоактивных изотопов. Реакция иммуноблотинга (РИ) РИ разработана на основе ИФА. Является самым специфичным и чувствительным методом иммунохимического анализа. Иммуноблотинг (от англ. blot – промокать, пятно) сочетает ИФА с электрофорезом. Применяют в случаях, когда из-за использования сложных смесей антигенов не удается получить специфический результат серологической реакции. При проведении иммуноблодинга на первом этапе сложную смесь антигена разделяют на фракции методом иммуноэлектрофореза в агарозном геле. На втором этапе гель помещают на лист нитроцеллюлозы (фильтр) и при помощи электрического поля переносят фракции антигенов на фильтр. Далее нитроцеллюлозу используют в качестве твердого носителя известного микробного или вирусного антигена и проводят все манипуляции, как и при тведофазном ИФА. Затем блоты обрабатывают антителами к специфическому антигену, меченными ферментом, т.е. проводят ИФА блота. Положительный результат- появление одной или нескольких окрашенных полос на фильтре. Иммуноблоттинг используют в диагностике инфекций. Моноклональные антитела широко применяются в научных исследованиях, частности в высокочувствительном методе иммуноблоттинга (рис. 10). 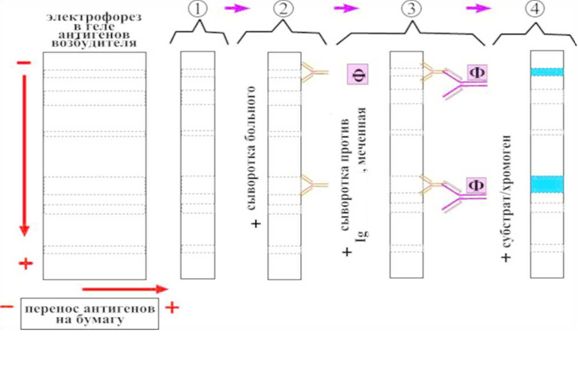 |
