фарм. Фармакология 3 часть. Учебник Д. А. Харкевич. 12е изд., испр и доп. К кредиту 3
 Скачать 4.44 Mb. Скачать 4.44 Mb.
|
|
29.5. ПРОТИВОСИФИЛИТИЧЕСКИЕ СРЕДСТВА Основное место в лечении сифилиса занимают препараты бензилпенициллина. Для этой цели используют как короткодействующие (бензилпенициллина натриевую или калиевую соль), так и длительно действующие (новокаиновую соль бензилпенициллина, бициллины) препараты. Бензилпенициллин оказывает быстрое и выраженное трепонемоцидное действие. Развития к нему устойчивости бледной трепонемы не отмечено. Препараты бензилпенициллина эффективны при сифилисе на всех его стадиях. Назначают их курсами, длительность которых определяется формой и стадией заболевания. При непереносимости бензилпенициллина (например, в связи с аллергическими реакциями) для лечения сифилиса можно использовать другие антибиотики — тетрациклины, а также эритромицин, азитромицин, цефтриаксон. Однако по эффективности они уступают препаратам бензилпенициллина. Помимо антибиотиков, при лечении сифилиса применяют препараты висмута. К ним относятся бийохинол (8% взвесь йодовисмутата хинина в нейтрализованном персиковом масле) и бисмоверол (взвесь основной висмутовой соли моновисмутвинной кислоты в нейтрализованном персиковом масле). В отличие от антибиотиков спектр действия препаратов висмута ограничивается возбудителем сифилиса. По активности они уступают бензилпенициллину. Трепонемостатическое действие их связывают с угнетением ферментов, содержащих сульфгидрильные группы. Терапевтический эффект препаратов висмута развивается значительно медленнее, чем бензилпенициллина. Из желудочно-кишечного тракта препараты висмута не всасываются, в связи с чем их вводят внутримышечно. Выделяются они преимущественно почками, а также в небольших количествах кишечником и потовыми железами. Применяют препараты висмута при всех формах сифилиса. Побочные эффекты наблюдаются относительно редко. Типично для действия этих препаратов появление темной каймы по краю десен (так называемая висмутовая кайма). Возможно развитие гингивита, стоматита, колита, диареи, дерматита. Редко наблюдаются поражения почек и печени. При применении препаратов висмута необходимо следить за состоянием слизистой оболочки полости рта, функцией почек и печени. В поздних стадиях сифилиса для ускорения рассасывания гумм назначают соединения йода (калия йодид).
29.6. ПРОТИВОТУБЕРКУЛЕЗНЫЕ СРЕДСТВА В комплексе медикаментозной терапии туберкулеза основное место занимают химиотерапевтические средства. К ним относятся следующие препараты: А. Синтетические средства Изониазид Этионамид Этамбутол Протионамид Натрия пара-аминосалицилат (ПАСК) Пиразинамид Бепаск Тиоацетазон Б. Антибиотики Рифампицин Циклосерин Стрептомицина сульфат Канамицина сульфат Стрептомицин-хлоркальциевый комплекс Флоримицина сульфат По противомикробному спектру указанные группы средств различаются весьма существенно. Синтетические средства действуют только на микобактерии туберкулеза (отдельные соединения эффективны и в отношении микобактерии проказы). На прочие микроорганизмы они не влияют. В то же время антибиотики, применяемые при лечении туберкулеза, характеризуются широким противомикробным спектром действия (рис. 29.5). Противотуберкулезные средства в основном оказывают бактериостатическое действие. Однако некоторые препараты в определенных концентрациях вызывают и бактерицидный эффект (изониазид, рифампицин, стрептомицин). Механизм противотуберкулезного действия препаратов изучен недостаточно. 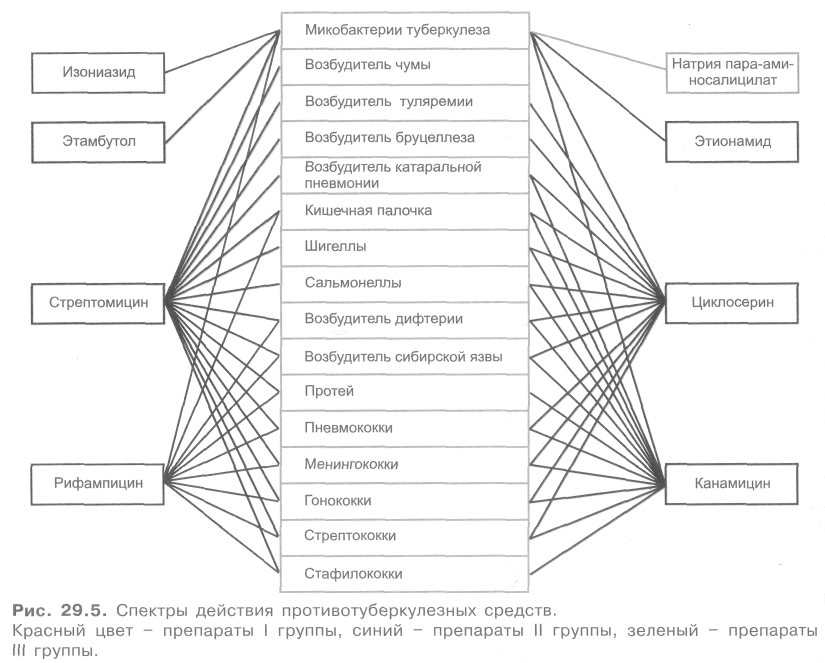 С учетом длительности химиотерапии туберкулеза (12-18 мес и более) особенно важное значение приобретает проблема лекарственной устойчивости возбудителя. В принципе устойчивость микобактерий туберкулеза развивается ко всем препаратам, однако к одним она возникает быстро (рифампицин, стрептомицин), к другим — относительно медленно (например, к натрия пара-аминосалицилату). Для уменьшения скорости развития резистентности обычно комбинируют 2-3 препарата. В начале лечения одновременное применение ряда противотуберкулезных средств имеет смысл еще и потому, что чувствительность возбудителя у данного больного к определенным препаратам неизвестна и может быть установлена лишь через несколько недель. Вместе с тем чем раньше начато лечение, тем оно успешнее. Поэтому химиотерапию начинают, не дожидаясь результатов бактериологических исследований. Как правило, это дает необходимый лечебный эффект, так как штаммы микобактерий туберкулеза, устойчивые одновременно к 2-3 препаратам, встречаются относительно редко.
Осложняющим моментом лекарственного лечения туберкулеза являются также побочные эффекты. Они могут быть как аллергической, так и неаллергической природы (табл. 29.10). Кроме того, при применении антибиотиков возможна суперинфекция. К сожалению, побочными эффектами обладают все известные противотуберкулезные средства, варьируют лишь их характер и частота. Некоторые носят угрожающий характер (гепатотоксичность, нефротоксичность, угнетение кроветворения, нейротоксичность) и являются показанием к отмене препаратов. Предложена следующая классификация противотуберкулезных средств: I. группа — наиболее эффективные препараты: изониазид и рифампицин; II группа — препараты средней эффективности: этамбутол, стрептомицин, этионамид, пиразинамид, канамицин, циклосерин, флоримицин; III группа — препараты с умеренной эффективностью: ПАСК, тиоацетазон. Поиски новых противотуберкулезных средств продолжаются. Задача заключается в создании высокоактивных и малотоксичных препаратов, лишенных побочных эффектов. Важно, чтобы устойчивость к ним микобактерий туберкулеза развивалась возможно медленнее. Следует учитывать и экономическую сторону. Такие препараты должны быть доступны для широкого применения в медицинской практике, тем более что курс лечения ими весьма продолжителен. 29.6.1. ПРОТИВОТУБЕРКУЛЕЗНЫЕ СРЕДСТВА I ГРУППЫ а) Синтетические средства Основным представителем группы гидразидов изоникотиновой кислоты (ГИНК) является изониазид (тубазид, изоницид). Он обладает высокой активностью в отношении микобактерий туберкулеза (превосходит стрептомицин). В отличие от стрептомицина воздействует и на внутриклеточно расположенные микобактерий туберкулеза. Оказывает угнетающее влияние на возбудитель проказы. Другие микроорганизмы к изониазиду нечувствительны. На микобактерий туберкулеза изониазид оказывает бактериостатическое или бактерицидное действие, механизм которого до сих пор не выяснен. Имеются данные, что изониазид угнетает синтез миколевых кислот, являющихся важнейшим структурным компонентом клеточной стенки микобактерий туберкулеза. С этим связывают и высокую избирательность действия изониазида на микобактерий, так как в тканях макроорганизма, а также у других микроорганизмов миколевых кислот нет. Не исключено, что определенное значение имеет угнетение синтеза нуклеиновых кислот. Устойчивость микобактерий туберкулеза к изониазиду развивается значительно медленнее, чем к стрептомицину и рифампицину. Изониазид хорошо всасывается из желудочно-кишечного тракта. Через 1-2 ч он накапливается в плазме крови в максимальных концентрациях. Препарат легко проникает через тканевые барьеры и относительно равномерно распределяется по всем тканям. Обнаруживается в бактериостатических концентрациях в ликворе и серозных полостях. Большая часть изониазида подвергается химическим превращениям с образованием метаболитов и конъюгатов. Одним из важных путей инактивации изониазида в организме является ацетилирование. Установлено, что скорость этого процесса генетически обусловлена. У одних людей происходит медленная инактивация изониазида, при этом его концентрация в организме снижается более постепенно, чем в случае быстрой инактивации препарата. Скорость снижения содержания изониазида в плазме на 50% (t1/2) в этих группах может различаться в 2,5 раза. Естественно, что отмеченные особенности следует учитывать при дозировании изониазида, так как от этого зависит не только поддержание бактериостатических концентраций вещества, но и развитие побочных эффектов. Основное количество изониазида и продуктов его превращения выделяется в течение 1-х суток. Выводятся они главным образом почками.  Используют изониазид при всех формах туберкулеза. Вводят препарат обычно внутрь, иногда ректально. При необходимости его можно назначать внутривенно (он хорошо растворяется), внутримышечно. Растворы изониазида используют также для промывания серозных полостей и свищевых ходов. Применение изониазида может сопровождаться разнообразными побочными эффектами. Основным отрицательным свойством изониазида является его нейротоксичность. Проявляется она главным образом невритами, в том числе иногда отмечается поражение зрительного нерва. Возможны неблагоприятные эффекты со стороны ЦНС (бессонница, судороги, психические нарушения, расстройства памяти, нарушение равновесия). У некоторых больных отмечаются сухость в полости рта, тошнота, рвота, запор, легкая анемия. Аллергические реакции относительно редки. В ряде случаев возникают кожные реакции, лихорадка, эозинофилия. Многие из побочных эффектов изониазида связаны с угнетением процесса образования пиридоксальфосфата (схема 29.2), который является коэнзимом, необходимым для разнообразных превращений аминокислот. В связи с этим для предупреждения побочных эффектов (например, невритов) одновременно с изониазидом назначают пиридоксин (витамин В6). Аллергические реакции устраняют противоаллергическими средствами. 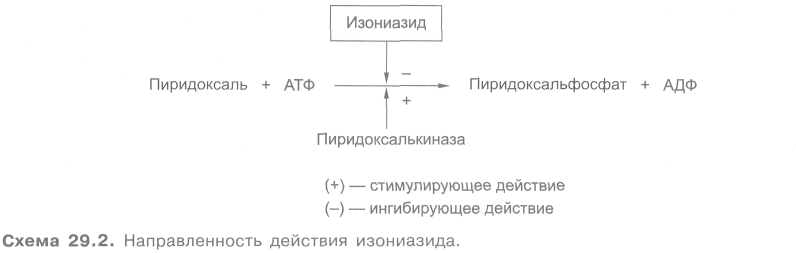 К производным гидразида изоникотиновой кислоты относятся также фтивазид, метазид, салюзид растворимый. Все они менее активны, чем изониазид, и никаких преимуществ по сравнению с ним не имеют. Применяют их редко, обычно при непереносимости изониазида. б) Антибиотики Группа рифамицина Рифамицин (рифоцин) является антибиотиком, продуцируемым Streptomyces mediterranei. Он представляет собой сложную макроциклическую структуру. К этой же группе относится полусинтетический препарат рифампицин (рифампин, рифадин, римактан). Оба соединения оказывают выраженное действие на микобактерии туберкулеза и лепры, а также на грамположительные бактерии. В высоких концентрациях активны в отношении грамотрицательных микроорганизмов (кишечной палочки, капсульных бактерий, отдельных штаммов синегнойной палочки, шигелл, сальмонелл) и некоторых видов протея. Механизм противомикробного действия антибиотиков группы рифамицина связан, по-видимому, с угнетением синтеза РНК (очевидно, за счет ингибирования ДНК-зависимой РНК-полимеразы). Они оказывают бактериостатическое, а в больших концентрациях бактерицидное действие. Особенно интересен рифампицин, который при приеме внутрь по активности приближается к изониазиду. Рифампицин хорошо всасывается из желудочно-кишечного тракта. Максимальная его концентрация в крови определяется через 2-4 ч. Он легко проникает через тканевые барьеры, в том числе через гематоэнцефалический барьер. Терапевтический эффект сохраняется до 8-12 ч. Выделяется препарат с желчью, частично с мочой, бронхиальными и слезными железами. Основное применение — лечение всех форм туберкулеза. Однако к рифампицину довольно быстро развивается устойчивость микобактерии туберкулеза, в связи с чем его целесообразно комбинировать с другими противотуберкулезными средствами. Рифампицин используют также в случаях, когда другие препараты неэффективны. Рифампицин назначают внутрь и внутривенно, рифамицин — внутримышечно, внутривенно и местно. Препараты группы рифамицина могут оказывать отрицательное влияние на функцию печени (особенно на фоне имеющегося заболевания или при длительном использовании препаратов). Возможна лейкопения. У ряда больных наблюдаются диспепсические нарушения. Иногда отмечаются аллергические реакции. Не рекомендуется применять эти антибиотики в первые 3 мес беременности (не исключено неблагоприятное влияние на плод). Следует учитывать, что рифампицин окрашивает мочу, мокроту и слезную жидкость в красный цвет. Одним из недостатков рифампицина является его высокая стоимость. 29.6.2. ПРОТИВОТУБЕРКУЛЕЗНЫЕ СРЕДСТВА II ГРУППЫ а) Синтетические средства Высокой противотуберкулезной активностью характеризуется этамбутол (диамбутол, миамбутол). По экспериментальным данным, при энтеральном введении этамбутол аналогичен по активности изониазиду. На другие микроорганизмы не влияет. Механизм действия этамбутола связывают с угнетением синтеза РНК. Устойчивость микобактерий к этамбутолу развивается относительно медленно. Из желудочно-кишечного тракта препарат всасывается не полностью (примерно 3/4), но в достаточном для обеспечения бактериостатического эффекта количестве. Максимальные концентрации в плазме крови создаются через 2-4 ч; снижение их на 50% происходит примерно через 8 ч. Выделяется в основном почками в течение 1-х суток. В моче обнаруживаются неизмененный этамбутол (90%), а также его метаболиты. Небольшая их часть выводится кишечником (около 20%). Этамбутол назначают при разных формах туберкулеза, обычно в сочетании с другими препаратами (например, рифампицин + этамбутол + изониазид; рифампицин + этамбутол; изониазид + этамбутол). Из побочных эффектов для этамбутола наиболее характерны нарушения зрения (в том числе расстройство цветового восприятия, особенно способность различать зеленый и красный цвета). Если возникает неврит глазного нерва, это осложнение принимает тяжелое течение. Нарушения зрения возникают обычно через 2—6 мес после начала лечения этамбутолом и зависят от дозы вещества. При своевременной отмене препарата зрение постепенно восстанавливается. В связи с возможностью развития такого побочного эффекта лечение этамбутолом проводят под систематическим контролем функции зрения. Аллергические реакции этамбутол вызывает редко. Спектр действия этионамида (тионид, трекатор) включает микобактерий туберкулеза и возбудитель проказы. Привыкание к нему микобактерий туберкулеза возникает быстро, поэтому его всегда применяют в сочетании с другими препаратами. Из желудочно-кишечного тракта всасывается хорошо. В максимальной концентрации накапливается в плазме примерно через 3 ч. Этионамид довольно хорошо проникает через гематоэнцефалический барьер. Быстро инактивируется в печени и выводится с мочой, главным образом в виде метаболитов. Вводят препарат внутрь и ректально. Для внутривенных инъекций применяют этионамида гидрохлорид. Этионамид часто вызывает побочные эффекты. Наиболее выражено у него раздражающее действие. Так, возникающие при приеме внутрь диспепсические явления (иногда тяжело протекающие) наблюдаются примерно у 50% больных. Для их уменьшения назначают никотинамид. Отмечаются также аллергические реакции. Иногда развиваются гепатит, ортостатический коллапс, нарушения со стороны центральной и периферической нервной системы и многие другие побочные эффекты. Аналогичным препаратом является протионамид (тревентикс). Есть данные, что он несколько менее токсичен, чем этионамид. Пиразинамид по туберкулостатической активности превосходит ПАСК, но уступает изониазиду, рифампицину и стрептомицину. На другие микроорганизмы не влияет. При применении только пиразинамида к нему быстро развивается устойчивость микобактерий туберкулеза. Хорошо всасывается из желудочно-кишечного тракта и накапливается в максимальных концентрациях в плазме крови через 1-3 ч. Проникает через гематоэнцефалический барьер. Основное количество пиразинамида и его метаболитов выводится почками. Применяется в сочетании с другими препаратами. Пиразинамид назначают энтерально 3-4 раза в день. Из побочных эффектов наиболее серьезным является гепатотоксичность. В связи с этим при использовании пиразинамида необходим систематический контроль за функцией печени. Нарушение функции печени является основанием к отмене препарата. У ряда больных наблюдаются также диспепсические явления. Задержка в организме мочевой кислоты под влиянием пиразинамида иногда приводит к появлению приступов подагры. Могут возникать аллергические реакции (лихорадка, дерматиты, эозинофилия и др.). б) Антибиотики Группа стрептомицина (см. 29.1) Разные антибиотики Циклосерин продуцируется различными видами актиномицетов: Actinomyces orchidaceus, Actinomyces garyphalus, Actinomyces lavendulae. Получен также синтетическим путем. В качестве лекарственного препарата используется D-изомер циклосерина. Обладает широким спектром действия. Наиболее эффективен в отношении вне- и внутриклеточных микобактерий туберкулеза (уступает по активности изониазиду, рифампицину, стрептомицину). На другие микроорганизмы влияет только в больших концентрациях. Циклосерин действует бактерицидно, нарушая синтез клеточной стенки. Это связано с тем, что, обладая химическом сходством с D-аланином, циклосерин способен по конкурентному принципу угнетать активность ферментов D-аланинрацемазы и D-аланинсинтетазы. В результате нарушается образование дипептида D-аланил-D-аланина, необходимого для построения клеточной стенки ряда бактерий. 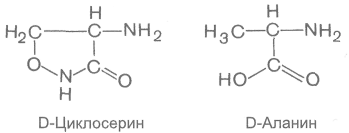 Устойчивость микобактерий туберкулеза к циклосерину развивается относительно медленно. Из желудочно-кишечного тракта циклосерин всасывается хорошо. Через 2-4 ч в плазме крови определяются максимальные концентрации препарата. С белками плазмы циклосерин не связывается. Хорошо проникает в ликвор, где его концентрации близки к таковым в плазме крови. Около 1/3 введенного циклосерина подвергается химическим превращениям. Выделяется препарат почками (в 1-е сутки около 50%). Показанием к назначению циклосерина является непереносимость или неэффективность прочих противотуберкулезных средств. Наилучший результат наблюдается при комбинированном применении циклосерина с другими препаратами I или II группы. Вводят его внутрь. При использовании циклосерина часто наблюдаются побочные эффекты. В основном это нервно-психические нарушения: головная боль, головокружение, тремор, судороги, возбуждение или депрессия, психозы. Иногда отмечаются диспепсические расстройства. Аллергические реакции возникают редко. Для коррекции изменений со стороны функций ЦНС вводят пиридоксин, глу-таминовую кислоту, препараты АТФ. Продуцентом канамицина является Streptomyces kanamyceticus. Препарат относится к антибиотикам группы аминогликозидов. Выпускается в виде сульфата. Канамицин обладает широким спектром действия, включающим микобактерии туберкулеза, многие грамположительные и грамотрицательные бактерии. К нему малочувствительны стрептококки (за исключением энтерококков), пневмококки. Он не действует на синегнойную палочку, анаэробы, спирохеты, патогенные грибы и истинные вирусы. Механизм его противомикробного действия связывают с угнетением синтеза белка у бактерий. Канамицин оказывает как бактериостатическое, так и бактерицидное действие. Привыкание бактерий к канамицину развивается довольно быстро. Из желудочно-кишечного тракта препарат всасывается в незначительной степени. Для резорбтивного действия его назначают внутримышечно. При этом пути введения максимальные концентрации канамицина в плазме определяются примерно через 1 ч. Антибактериальный эффект сохраняется до 6-12 ч. Через гематоэнцефалический барьер канамицин практически не проникает. Выделяется почками. В медицинской практике канамицин используют в качестве противотуберкулезного препарата II группы, а также при инфицировании грамотрицательными микроорганизмами (кишечной палочкой, капсульными бактериями и др.), протеем, золотистым стафилококком и прочими возбудителями, чувствительными к канамицину. Основанием для применения канамицина является неэффективность других антибиотиков. Помимо внутримышечных инъекций, препарат может быть введен в полости тела. Кроме того, его иногда назначают внутрь (для подавления кишечной микрофлоры). Канамицин храктеризуется высокой токсичностью. Так, он обладает большей ототоксичностью, чем гентамицин и стрептомицин (но меньшей, чем неомицин). Появление шума в ушах является поводом к отмене препарата, так как он может вызвать в результате повреждения слухового нерва необратимое снижение слуха вплоть до полной глухоты. Ототоксический эффект канамицина особенно опасен при длительном использовании антибиотика (при лечении туберкулеза). Вестибулярные нарушения возникают относительно редко. Канамицин обладает и отчетливой нефротоксичностью. В связи с этим в процессе лечения необходимо регулярно контролировать не только состояние слуха, но и функцию почек. Кроме того, возможно его отрицательное влияние на печень. Иногда отмечаются аллергические реакции. Противопоказания и меры предосторожности такие же, как при применении неомицина и гентамицина. К противотуберкулезным средствам II группы из числа антибиотиков относятся также капреомицин и флоримицина сульфат (виомицин). 29.6.3. ПРОТИВОТУБЕРКУЛЕЗНЫЕ СРЕДСТВА III ГРУППЫ а) Синтетические средства Эта группа резервных противотуберкулезных средств представлена соединениями различного химического строения. К ним относятся ПАСК и тиоацетазон (см. структуры веществ). Каждое из этих веществ применяют в комбинации с другими препаратами. Натрия пара-аминосалицилат (ПАСК) оказывает бактериостатическое действие на микобактерии туберкулеза. Механизм его действия обусловлен конкурентными взаимоотношениями с пара-аминобензойной кислотой, необходимой для роста и размножения микобактерии туберкулеза. На другие микроорганизмы он не влияет. Активность натрия пара-аминосалицилата невысокая. В связи с этим применяют его только в комбинации с другими, более активными препаратами. Как уже отмечалось, устойчивость к ПАСК развивается медленно. Натрия пара-аминосалицилат хорошо всасывается из пищеварительного тракта. Максимальная концентрация в плазме крови определяется через 1-2 ч. Значительная часть препарата (около 50%) связывается с белками плазмы крови. В серозных полостях накапливается в достаточных количествах. Через гематоэнцефалический барьер проникает в небольшой степени. Через 6 ч в плазме крови обнаруживается в незначительной концентрации. Из организма выводится почками в неизмененном виде, а также в виде метаболитов и конъюгатов (в основном ацетилированное производное пара-аминосалициловой кислоты). За 6 ч выделяется около 60%, а за 24 ч — примерно 90% от введенной дозы. Применяют при всех формах туберкулеза. Назначают обычно внутрь, иногда прибегают к внутривенному введению. Из побочных эффектов наиболее часты диспепсические расстройства, связанные с раздражающим действием препарата. При этом наблюдаются тошнота, рвота, диарея, боли в области живота, нарушается аппетит. Редко возникают агранулоцитоз, гепатит, кристаллурия. У ряда больных отмечается развитие зоба с явлениями гипотиреоза. Возможны осложнения аллергического происхождения, которые проявляются кожными реакциями, лихорадкой, артритами, эозинофилией и др. Спектр противомикробного действия тиоацетазона (тибон, контебен) ограничивается микобактериями туберкулеза и возбудителем проказы. По противотуберкулезной активности тиоацетазон уступает препаратам I и II групп. Устойчивость микобактерии туберкулеза к тиоацетазону развивается относительно медленно. Препарат хорошо всасывается из желудочно-кишечного тракта. Частично инактивируется в печени. Выделяется из организма в течение 1 -х суток. Большая часть препарата выводится почками. Применяют тиоацетазон внутрь, главным образом при внелегочных формах туберкулеза (при туберкулезе слизистых и серозных оболочек, лимфатических узлов и др.). В ряде случаев тиоацетазон назначают при проказе. Тиоацетазон обладает значительной токсичностью. Он относительно часто вызывает тяжелые осложнения со стороны кроветворения (анемию, лейкопению, агранулоцитоз), почек (альбуминурию, цилиндрурию) и печени (вплоть до желтой атрофии печени). Кроме того, при его использовании отмечаются диспепсические расстройства, аллергические реакции и другие побочные эффекты. Применение тиоацетазона требует постоянного контроля состояния кроветворения, функций печени и почек.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
