мфтв васнецова. Учебник для медицинских и фармацевтических вузов и медицинских специалистов
 Скачать 4.23 Mb. Скачать 4.23 Mb.
|
цепное и нецепное ингибирование.хз 2 S ХЗ С
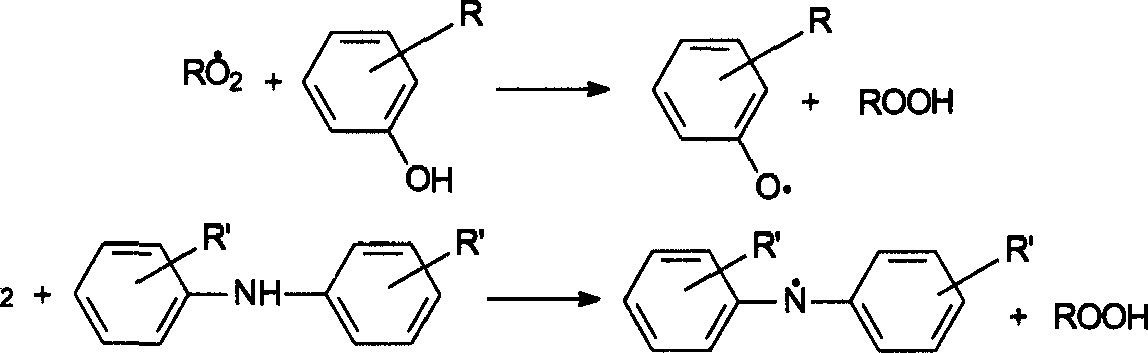
| 1 | 2 | 3 | 3. Реакция слабых связей и активных группировок примесного характера R„-Y-Y-R„^RmY + RD+Y -X, -Rn + Y2 —» R' + продукты (гдеХ=>С = С^-С = С- И др.; Y2 — химический агент) | а) Цепное ингибирование R + Z —» инертные продукты б) Нецепиое ингибирование Rm-X, -Rn + Z, -> инертный продукт Y2 + Z2 —» инертный продукт | Z'— стабилизатор (1пН, стабильный радикал) Zj — стабилизатор (#2,^2 и т. п.) Z2 — акцептор химического агента | 4. Инициирование промежуточными продуктами RmOOH->Rm6 + OH | а) Цепное ингибирование RmO + Z' инертные продукты б) Нецепное ингибирование RmOOH + Z2 —> инертные продукты | Z'— стабилизатор (1пН) Z2 — разрушитель гидропероксида (сульфиды и т. п.) RH, a R02 ROOH + InH RO— I n + H2O где InH — цепной ингибитор; a — стехиометрический коэффициент. Особенностью стабилизации в присутствии фенолов является заметное протекание вторичных процессов, приводящих к образованию хинолинных пероксидов: R02 + In —> R02ln. При повышенных температурах эти пероксиды распадаются по связям — О—О— с образованием радикалов, способных инициировать цепные процессы. Высокой ингибирующей активностью обладают многие полисопряженные соединения, в том числе образующиеся в результате химических превращений антиоксидантов. Так, при окислительной дегидрополимеризации вторичных ароматических аминов образуются полидифениламины, обладающие более высокой ингибирующей активностью, чем исходные амины. При стабилизации высокомолекулярных соединений в присутствии щелочей, например КОН, по-видимому, протекают реакции, которые можно представить следующим образом: 4КОН + 302 4КОО* + 2Н20 КОО* + ROO* ->KOOR + 02 KOOR + R'O' —> ROR'+KOO' и т.д. Перекиси типа MOOR аналогичным образом должны генерироваться из основных солей щелочных металлов. Однако детали этого интересного механизма требуют экспериментальной проверки. Следует отметить, что существует корреляция между стабилизирующей активностью гидроксидов щелочных металлов и способностью этих металлов образовывать перекиси; исключение составляют гидро- ксиды кальция и стронция. Гидроксиды щелочных металлов являются также эффективными стабилизаторами деструкции ряда полимеров. Следует заметить, что при сравнительно невысоких температурах ингибирую- щее действие КОН наблюдается в случае термического разложения полиэтилена. При этом уменьшается разветвленность полимера, снижается концентрация слабых связей в макромолекулах, предотвращается образование фрагментов с ненасыщенными концевыми группировками. Изменение механизма действия солей с изменением температуры обнаружено при окислении силоксановых жидкостей в присутствии соединений железа и церия. Оказалось, что при температурах ниже 150 °С соединения Fe3+ ускоряют термоокислительную деструкцию. При более высоких температурах эти же соединения оказывают стабилизирующее действие, причем каждой температуре соответствует определенная концентрация Fe3+, обеспечивающая минимальную скорость окисления. Использование стабильных свободных радикалов и непредельных соединений в качестве ингибиторов окислительной деструкции обычно не дает большого эффекта, поскольку при этом образуются неустойчивые продукты и константы скорости взаимодействия радикала RO* с полимером RnH и непредельным соединением часто имеют одинаковый порядок. 23.2. Нецепное ингибирование Нецепное ингибирование связано с дезактивацией веществ, участвующих в любых реакциях, приводящих к деструкции полимера. В случае цепных процессов разрушения полимеров нецепное ингибирование связано с дезактивацией веществ, инициирующих зарождение цепей или участвующих в реакциях их продолжения. Этот метод был предложен в процессе совместной работы кафедры маркетинга и товароведения в здравоохранении ММА им. И.М.Сеченова с лабораторией термостойких полимеров ИХФ АН в 80-х годах прошлого века. В 1980—1990-х годах развитием этого метода занимались на кафедре высокомолекулярных соединений Кабардино-балкарского государственного университета. В результате этих работ был установлен механизм стабилизации в присутствии акцепторов кислорода, генерируемых в полимерных композициях или изделиях. В дальнейшем удалось показать, что применение метода нецепного ингибирования может оказаться эффективным при стабилизации полимерных материалов, разрушающихся при действии не только кислорода, но и других химических агентов. Приемы связывания активных низкомолекулярных продуктов деструкции используются в полимерной химии давно. Классическим примером может служить связывание хлористого водорода — активного продукта термической деструкции поливинилхлорида — добавками трехосновного сульфата свинца, дилаурата кадмия, ди- фенил-мочевины. Для удаления муравьиной кислоты, образующейся при старении полиацеталей, используют основные агенты — карбамид, меламин, полиамиды и др. Блокирование активных центров макромолекул, концевых групп (слабых связей), участвующих в процессах инициирования, находит применение при стабилизации ряда полимеров. Эти процессы обычно рассматривают как модификацию полимеров. Использование нецепного ингибирования в сочетании с генерированием высокоактивных акцепторов кислорода непосредственно в полимерных системах позволяет существенно повышать температуру переработки изделий и увеличивать сроки их эксплуатации. При гидротермической деструкции полимеров инициирующим агентом часто является диффундирующая из окружающей среды в полимер вода, которая может поглощаться различными оксидами типа СаО и другими веществами, используемыми в качестве осушителей. Если кроме гидролиза полимера протекают конкурирующие реакции взаимодействия воды с легко гидролизующейся добавкой, то это также приводит к удалению воды и стабилизации полимера. Например, некоторые 1,3-дикетрны могут легко гидролизоваться по схеме: О О п и О II II II НгО * R-C—СН3 + R'COOH R—О—ОН2—С— R о II , ч.О — С --!-- Н А м;; / \ М Ао-с н о о / 0 II , -> МО + СО + СО, + н, wO — с —{-- н м X о-^ с--!-- Н II 1 М + 2СО, + Н, О II о —с-н о-с-н II о о тогда как формиаты щелочных металлов распадаются с образованием оксалатов и карбонатов: -> м2с2о4 + н2 2НСООМ -> м2со3 + н2 + со При распаде этих веществ в результате побочных реакций типа зн2 + СО сн4 + н2о 2Н2 + СО СН3СОН Н2 + СО нсно 2HCHO HCOOCH3 образуются другие продукты. Однако роль побочных реакций при распаде формиатов Со, Ni, Си, Pb, Fe мала и основными продуктами являются М, МО, СО, С02 и Н2. Металлы и их оксиды легко генерировать при разложении окса- латов. Процесс можно описать следующей схемой: М(СОО)х м +со +со2 + MnOm Эта схема предполагает протекание различных процессов типа М(СОО)2 М +2С02 м + со2 МО + СО М(СОО)2 МО +со + со2 MO +CO М+ С02 и т. п. Оксалаты переходных металлов, например железа и никеля, распадаются с образованием пирофорных продуктов r->Fe + 2C02 FeC204 -> L->FeO + CO + CO. NiC204 -> Ni + 2C02 тогда как оксалаты щелочных и щелочноземельных металлов, разлагаясь, превращаются в стабильные оксиды, например: MgC204 -» MgO + СО + С02 Металлы и их оксиды можно также генерировать при распаде других соединений металлов. При этом наряду с металлами выделяются различные газообразные продукты, например при распаде формиатов образуются Н2 и СО, которые при высоких температурах могут участвовать в реакциях обрыва цепи при термической деструкции. Кроме того, водород способен регенерировать металл, а также гидрировать «слабые места» примесного характера. Все это обусловливает улучшение исходных свойств изделий из полимерных материалов и увеличивает продолжительность эксплуатации изделий из них. 23.3. Применение метода нецепного ингибирования для стабилизации изделий медицинского назначения 23.3.1. Стабилизация физиологически активных веществ Хорошо известно, что физиологически активные вещества, входящие в состав различных лекарственных средств или лекарственных препаратов, подвергаются интенсивному окислению на воздухе в условиях синтеза, переработки, хранения и применения. Один из самых надежных способов защиты этих лабильных веществ связан с их приготовлением, переработкой и хранением в условиях, исключающих доступ кислорода. Однако создание таких условий не всегда возможно, особенно в случае применения легкоокисляю- щихся композиций при доступе атмосферного кислорода. Так, многие физиологически активные соединения являются компонентами медицинских препаратов накожного действия, например мазей, хирургических клеев, жидких пластырей и др. В этих случаях возникает проблема стабилизации легкоокисляющихся веществ. До недавнего времени защита от окисления композиций указанного типа при необходимости осуществлялась, как правило, путем введения классических антиоксидантов (или их композиций) «цепного» типа, которые препятствуют развитию процесса окисления, часто обрывая или разрушая перекиси — промежуточные продукты реакции. В конце прошлого века был предложен другой путь защиты легко окисляющихся веществ, входящих в состав препаратов, контактирующих с кислородом воздуха, — использование принципа нецепного ингибирования. Решение соответствующей макрокинетической задачи показало, что можно создать такие условия, когда принцип не цепного ингибирования легко реализовать при стабилизации полимеров и других органических композиций. Приближенная теория позволяет получить простое соотношение для времени жизни xz многих реальных стабилизированных композиций, кислород в которые поступает путем молекулярной диффузии: тг = kL2 [Z]0/P (23.1) где к — коэффициент, определяемый формой образца и стехиометрией реакции Z + 02 -» инертный продукт, L — характерный размер образца (например, толщина пластины), Р — проницаемость. В зависимости от природы композиции наибольшая эффективность стабилизации в случае пленок и пластин при комнатных температурах достигается при L Ю-2 — 1 см. Необходимо также иметь в виду, что параболическая зависимость типа тн =f(L2) часто выполняется для нестабилизированных образцов органических композиций. Однако это уже является следствием окисления органических соединений в диффузионном режиме, когда L » 10з. Другими словами, такая зависимость реализуется в существенно большем масштабе толщин, нежели зависимость (23.1), справедливая для сравнительно тонких стабилизированных образцов. В данном разделе проведен анализ возможности стабилизации легко окисляющихся физиологически активных соединений в полимерных, олигомерных и других вязких композициях и проверка теоретических предсказаний. Защита вещества Я2Н от окисления в вязкой среде (например, пленке) в присутствии акцептора кислорода в простейшем случае возможна, когда ®r2h+o2 , ©R.H+0, « ©z+o2 . (23.2) где C0R H+o — скорость окисления активного вещества; C0R н+0 — скорость окисления основы (например, полимера, жира и т.п.), C0z+O2 — скорость окисления акцептора кислорода. Нас прежде всего интересует случай, когда стабилизатор неподвижен, основа практически стабильна (т.е. характерное время ее окисления t „ « »tn TI — характерного времени окисления RjH-H^ R2H+O2 R2H), а концентрация [R{H] » [R2H]. Далее, если активное вещество окисляется в кинетическом режиме, а акцептор кислорода — в диффузионном, имеет смысл стабилизировать образец (возможны и другие случаи, целесообразные с точки зрения стабилизации). Более лаконично, — нас, прежде всего, интересует случай, когда выполняется следующий ряд характерных времен: \н+о2 » \н+02 » ^ >> lz+o2 (23.3) где tn — характерное время диффузии кислорода в образец. Ряд (24.3) эквивалентен ряда скоростей: (0D u , « (0D u ri »Ю « Ю7г RJH+02 R2H+02 D Z+02 ^23 4) 02 Рассмотренный общий случай соответствует, например, стабилизированным системам на основе пленок полиакрилатов, жиров и других основ мазей, содержащих быстроокисляющиеся физиологически активные вещества. Системы такого типа представляют интерес с медицинской точки зрения и могут использоваться, например, в качестве лекарственных препаратов. Эффективность стабилизации лабильного вещества в пленке может быть оценена, например, как Х0,5; Z / х0,5; Н (23.5) где т0 5. z — период полупревращения вещества за счет его окисления в пленке с акцептором Z, т0 5. н — период полупревращения вещества за счет его окисления в пленке без акцептора кислорода. (При необходимости S можно отнести к любой конверсии). Если то 5- z >;> то 5- н> то то 5- z может быть оценена с использованием соотношения (23.1). Наибольший интерес для исследования, естественно, представляют легкоокисляющиеся лекарственные вещества с непродолжительными сроками «стабильности». Если известны соответствующие параметры системы, то предварительно легко сделать необходимые предсказания. Для выбора условий, эффективной стабилизации акцепторами кислорода, предварительно целесообразно протестировать систему по следующим критериям: 1. СО »ю z + o2 r2h + o2 2tD =L2/DO2< от что указывает на протекание окисления R2H в кинетическом режиме 3. tx,z = kL![Z]0/[OJ„D0i »тх,н что позволяет использовать простейшую макрокинетическую модель явления и указывает на возможную эффективную стабилизацию. Заметим, что выполнение критерия 2 необходимо для достижения эффективной стабилизации при любом химическом механизме стабилизации. Величины |