Художественное литье. Учебник для технических вузов и художественнореставрационных училищ. Спб. Политехника, 1996. 231 с. ил
 Скачать 2.15 Mb. Скачать 2.15 Mb.
|
Глава 2 ЛИТЕЙНЫЕ СПЛАВЫ8%. Однако в табл. 2.1 приведены усредненные по всей массе земной коры цифры, в то время как для практических целей важно знать степень рассеянности элементов. Она оценивается числом минералов, в которые входит металл. Чем меньше это число, тем выше степень рассеянности. Объем переработки пустой породы при добыче, а значит, и стоимость металла тем больше, чем меньше он распространен и локализован. Существует зависимость между числом минералов и распространенностью всех элементов таблицы Менделеева. Зависимость имеет две области — локализованных (А) и рассеянных (Б) элементов. На рис. 2.2 показана та- 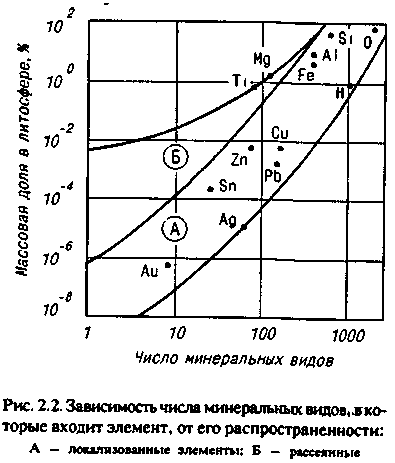 кая зависимость для металлов, которые входят в состав сплавов, используемых в художественном литье, а также (для сравнения) — для кислорода, водорода и кремния. ' Стоимость получения химически чистого металла определяется его химической активностью и может быть оценена по энтальпии его наиболее устойчивого оксида. Энтальпия характеризует изменение внутренней энергии вещества при различных преобразованиях, в том числе при образовании оксида металла, и соответствует энергозатратам, необходимым для его разрушения. Можно выделить четыре группы способов производства металлов. Физические способы. Простейшим из них является прямое извлечение из природных источников. Примером может служить добыча самородного золота. Некоторые металлы (платину, мышьяк и др".) получают разложением природных соединений при нагревании. Физические способы — наиболее дешевые. Они приемлемы для металлов и соединений, имеющих очень низкую отрицательную энтальпию. Восстановление неметаллами. Как правило, реакции восстановления идут при высоких температурах. В качестве восстановителей применяют углерод или оксид углерода (для железа, олова и др.), сернистый газ или сульфиды (для меди, ниобия и др.) или водород (для вольфрама, молибдена, рения и др.). Способ пригоден для получения металлов со сравнительно невысокой энтальпией оксидов и обходится дороже, чем предыдущий. Электролиз. Электролиз в водных растворах (меди, хрома, висмута и др.) или в расплавах солей (алюминия, магния и др.) применяется для получения химически активных металлов и стоит еще дороже. Восстановление металлами (металлотермия). Этот способ требует предварительного получения химически чистых металлов — восстановителей. Металл восстанавливают из оксидов (ванадий, барий, галий и др.) или галогенных соединений (титан, цинк, бериллий и др). Это самый дорогой способ. Общий объем производства металлов изменяется из года в год, но соотношение объемов производства разных металлов остается примерно одинаковым. Так, годовые объемы производства железа (точнее, его сплавов — стали и чугуна) в промышленно развитых странах измеряются миллиардами тонн, алюминия и меди — десятками миллионов, цинка, свинца и хрома — миллионами тонн, никеля, магния и олова — сотнями тысяч тонн, титана, кобальта и кадмия — десятками тысяч тонн, ,| золота и ртути — тысячами тонн, платины — сотнями тонн, рения — десятками тонн. Металлы, так или иначе используемые в художественном литье, можно разделить по стоимости следующим образом: дешевые — алюминий, железо, магний, медь, свинец, цинк; недорогие (в 2—10 раз дороже дешевых) — титан, никель, | хром, кадмий, сурьма; дорогие (в 10—100 раз дороже дешевых) — вольфрам, ванадий, j кобальт, молибден, ниобий, олово, ртуть, цирконий; 36 дорогостоящие (в 100—1000 раз дороже дешевых) — серебро, бериллий, тантал; драгоценные (в 1000 — 10 000 раз дороже дешевых) — золото, платина, рений, осмий, иридий. С течением времени цены на металл меняются под влиянием двух противоположных тенденций — удешевления производства, связанного с техническим прогрессом, и удорожания сырья и энергии вследствие исчерпания доступных запасов. После распада Советского Союза нарушение экономических связей между регионами поставило ценообразование в прямую зависимость от политических и социально-экономических факторов. 2.1.3. ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Плотность. Это — одна из важнейших характеристик металлов и сплавов. По плотности металлы делят на следующие группы: легкие (плотностью не более 5 г/см3) — магний, алюминий, титан и др.; тяжелые (плотностью от 5 до 10 г/сМ3) — железо, никель, медь, цинк, олово и др. (это наиболее обширная группа); очень тяжелые (плотностью более 10 г/см3) — молибден, вольфрам, золото, свинец и др. В табл. 2.2 приведены значения плотности металлов. (Эта и последующие таблицы характеризуют свойства только тех металлов, которые составляют основу сплавов для художественного литья.)  Температура плавления. В зависимости от температуры плавления металлы подразделяются на следующие гр/ппы: легкоплавкие (температура плавления не превышает 600 °С) — цинк, олово, свинец, висмут и др.; среднеплавкие (от 600 до 1600 °С) — к ним относится почти половина металлов, в том числе магний, алюминий, железо, никель, медь, золото; тугоплавкие (более 1600 ° С) — вольфрам, молибден, титан, хром и др. 37 Ртуть относится к жидкостям. При изготовлении художественных отливок температура плавления металла (табл. 2.3) или сплава определяет выбор плавильного агрегата и огнеупорного формовочного материала. При введении в металл добавок температура плавления, как правило, понижается.  Удельная теплоемкость. Это количество энергии, необходимое для повышения температуры единицы массы на один градус. Удельная теплоемкость уменьшается с увеличением порядкового номера элемента в таблице Менделеева. Зависимость удельной теплоемкости элемента в твердом состоянии от атомной массы описывается приближенно законом Дюлонга и Пти: m«Cm = 6, где nv» — атомная масса; ст — удельная теплоемкость (Дж/кг • °С). В табл. 2.4 приведены значения удельной теплоемкости некоторых металлов.  38 Скрытая теплота плавления металлов. Это характеристика (табл. 2.5) наряду с удельной теплоемкостью металлов в значительной степени определяет необходимую мощность плавильного агрегата Для расплавления легкоплавкого металла иногда требуется больше тепловой энергии, чем для тугоплавкого. Например, для нагревания меди от 20 до 1133 ° С потребуется в полтора раза меньше тепловой энергии, чем для нагревания такого же количества алюминия от 20 до 710 ° С. 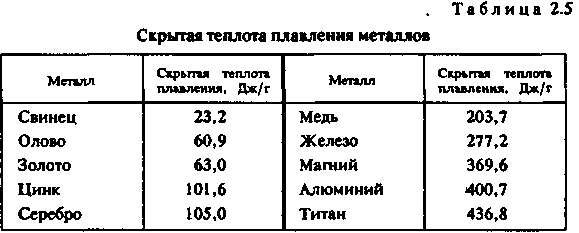 Теплопроводность. Теплопроводность характеризует передачу тепловой энергии от одной части тела к другой, а точнее, молекулярный перенос теплоты в сплошной среде, обусловленный наличием градиента температуры (табл. 2.6)  Качество художественного литья тесно связано с теплопроводностью металла. В процессе выплавки важно не только обеспечить достаточно высокую температуру металла, но и добиться равномерного распределения температуры во всем объеме жидкой ванны Чем выше теплопроводность, тем равномернее распределена температура. При электродуговой плавке, несмотря на высокую теплопроводность большинства металлов, перепад температуры по сечению ванны достигает 70—80° С, а для металлов с низкой теплопроводностью этот перепад может достигать 200 ° С и более. 39 Благоприятные условия для выравнивания температуры создаются при индукционной плавке. Коэффициент теплового расширения. Эта величина, характеризующая изменение размеров образца длиной 1 м при нагревании на 1 ° С, имеет важное значение при эмальерных работах (табл. 2.7). Коэффициенты теплового расширения металлической основы и эмали должны иметь по возможности близкие значения, чтобы после обжига эмаль не растрескивалась. Большинство эмалей, представляющих твердый раствор оксидов кремния и других элементов, имеют низкий коэффициент теплового расширения. Как показала практика, эмали очень хорошо держатся на железе, золоте, менее прочно — на меди и серебре. Можно полагать, что титан — весьма подходящий материал для эмалирования. 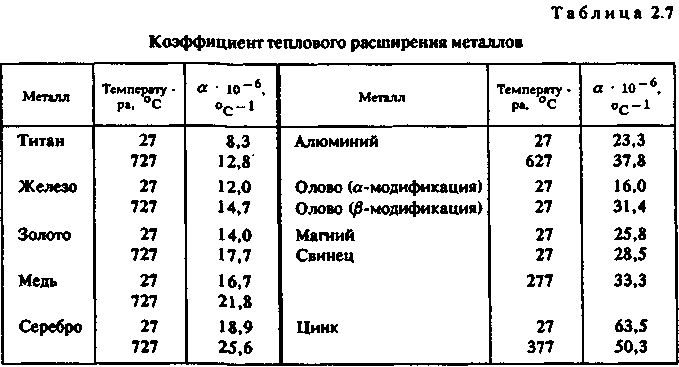 Отражательная способность. Это — способность металла отражать световые волны определенной длины, которая воспринимается человеческим глазом как цвет (табл. 2.8). Цвета металлов указаны в табл. 2.9.  40 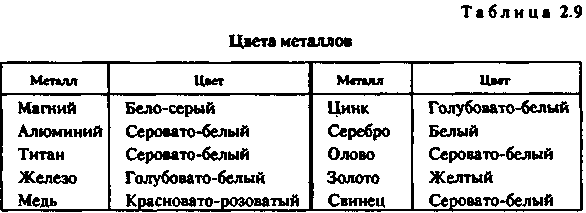 Чистые металлы в декоративно-прикладном искусстве практически не применяются. Для изготовления различных изделий используют сплавы, цветовые характеристики которых значительно отличаются от цвета основного металла. В течение долгого времени накапливался огромный опыт применения различных литейных сплавов для изготовления украшений, бытовых предметов, скульптур и многих других видов художественного литья. Однако до сих пор еще не раскрыта взаимосвязь между строением сплава и его отражательной способностью. 2.1.4. МЕХАНИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Прочность. Прочностью называют свойство твердых тел сопротивляться разрушению, а также необратимым изменениям формы. Основным показателем прочности является временное сопротивление, определяемое при разрыве цилиндрического образца, предварительно подвергнутого отжигу. По прочности металлы можно разделить на следующие группы: непрочные (временное сопротивление не превышает 50 МПа) — олово, свинец, висмут, а также мягкие щелочные металлы; прочные (от 50 до 500 МПа) — магний, алюминий, медь, железо, титан и другие металлы, составляющие основу важнейших конструкционных сплавов; высокопрочные (более 500 МПа) — молибден, вольфрам, ниобий и др. К ртути понятие прочности неприменимо, поскольку это жидкость. Временное сопротивление металлов указано в табл. 2.10. 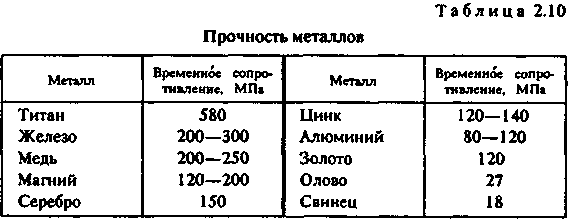 41 Пластичность. Пластичность — это свойство твердых тел сохранять часть деформации при снятии нагрузок, которые их вызвали. В качестве показателя пластичности выбрано относительное удлинение, определяемое при тех же испытаниях, что и временное сопротивление. По степени пластичности металлы принято подразделять следующим образом: высокопластичные (относительное удлинение превосходит 40 %) — металлы, составляющие основу большинства конструкционных сплавов (алюминий, медь, железо, титан, свинец) и «легкие» металлы (натрий, калий, рубидий и др.); пластичные (относительное удлинение лежит в диапазоне между 40 и 3%) — магний, цинк, молибден, вольфрам, висмут и др. (наиболее обширная группа); хрупкие (относительное удлинение меньше 3%) — хром, марганец, кобальт, сурьма. Высокая очистка хрупких металлов несколько повышает пластичность. Сплавы, полученные на их основе, почти не поддаются обработке давлением. Промышленные изделия из них часто получают путем литья. Относительное удлинение металлов характеризует табл. 2.11.  Твердость. Твердость — характеристика материала, отражающая его прочность и пластичность, определяемая путем вдавливания шарика (метод Бринелля) или призмы (метод Виккерса). Количественной оценкой твердости является число твердости НВ, равное отношению нагру-жения (Н) к площади поверхности отпечатка (мм2). Значения твердости металлов по Бринеллю приведены в табл. 2.12.  42  Модуль продольной упругости. Модуль продольной упругости, или модуль Юнга, Е определяет жесткость металла, т. е. интенсивность увеличения напряжения по мере увеличения упругости деформации (табл. 2.13). 2.1.5. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Растворимость. Это — способность вещества растворяться в том или ином растворителе. Металлы растворяются в сильных кислотах и едких щелочах. В промышленном производстве наиболее часто употребляются серная, азотная и соляные кислоты, смесь азотной и соляной кислот (царская водка), а также щелочи — едкий натр и едкое кали. Растворение может быть частичным, затрагивающим только поверхностные слои, или полным, когда металл полностью переходит в раствор. Частичное растворение происходит, например, при травлении изделий для получения гладкой поверхности или для нанесения рисунка на изделие/полное — при растворении цинка в соляной кислоте в целях получения флюса для пайки. Окисляемость. Она характеризует способность металлов соединяться с кислородом и образовывать оксиды. Интенсивность окисления металлов пропорциональна энтальпии их оксидов (табл. 2.14). Для сравнения отметим, что энтальпия монооксида углерода СО составляет 111 кДж/моль.  43 В ряде случаев образование прочной оксидной пленки на поверхности изделия желательно, так как пленка предохраняет металл от дальнейшего окисления. При пайке и сварке алюминиевых сплавов пленка препятствует соприкосновению припоя с чистой поверхностью металла. Коррозионная стойкость. Это — способность металла сопротивляться разрушению, которое вызвано химическим воздействием окружающей среды. Чисто химическая коррозия определяется главным образом окислением, электрохимическая коррозия возникает из-за физико-химической неоднородности металлов в присутствии жидкости, способной проводить электрический ток. Электрохимическая активность металлов характеризуется электродным потенциалом, измеренным относительно водорода (табл. 2.15)  Каждые два металла образуют гальваническую пару. При этом электродвижущая сила будет тем больше, чем дальше друг от друга они стоят в электрохимическом ряду. Взаимодействие металлов с газами. Качество отливки во многом зависит от взаимодействия металлов (особенно их жидких расплавов) с газами. Это взаимодействие представляет собой комплекс сложных физико-химических процессов, направленных в сторону равновесия. В реальных условиях полное равновесие между газообразной и жидкой фазами достигается крайне редко. Поэтому термодинамические расчеты, относящиеся к состоянию равновесия, как правило, показывают лишь направление взаимодействия. Возможны три случая взаимодействия газов с расплавами. /. Полная взаимная инертность. Она наблюдается, например, при плавлении любых металлов в среде инертных газов (аргонп, гелия и др.). 2. Газ практически нерастворим в металле. Образующиеся химические соединения в виде жидких капель, плен или кристаллов, проникая в металл, загрязняют его. 44 3. Газы образуют с металлом растворы. Как известно, растворимость в металле двухатомного газа [Г]ме зависит от давления газа рг и от температуры Т: [Лм. = *Vp7 exp[—ДО/(ЯГ)1, где k — постоянный коэффициент, R — газовая постоянная; АО — теплота растворения 1 моля газа в расплаве. Значение ДО может быть положительным и отрицательным. При ДО > О процесс растворения газа сопряжен с поглощением теплоты и является эндотермическим. В этом случае повышение температуры вызывает увеличение содержания газа в металле (рис. 2.3, кривая 1). При ДО < 0 растворение газа сопровождается выделением теплоты, т. е. является экзотермическим процессом, и повышение температуры вызывает снижение содержания газов в растворе (рис. 2.3, кривая 2). При эндотермическом процессе, когда растворимость,газа снижается по мере охлаждения 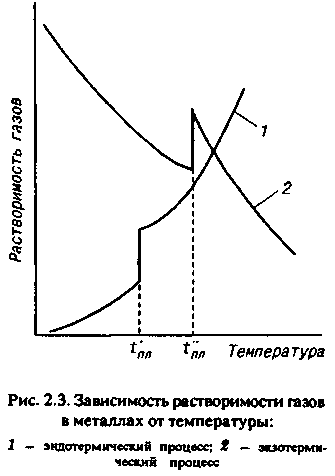 расплавов, в ходе кристаллизации в отливке могут образовываться газовые пузыри. Это происходит из-за избыточного для низких температур количества газа в расплаве. Эти пузыри являются причиной образования газовой пористости. В табл. 2.16 приведены данные о взаимодействии жидких металлов с различными газами (водородом, кислородом, азотом). В таблицу также включены сведения об углероде, поскольку надо учитывать возможность растворения монооксида углерода. Знак « +» указывает на существенную растворимость, знак «—» указывает на незначительную растворимость.  45 Взаимодействие с водородом. Водород составляет основную долю растворенных газов. Он попадает в жидкие металлы вследствие разложения воды или углеводородов: Me + Н2О -• МеО + 2[Н); С„Нт - пС + т[Н]. Растворение водорода в металлах ряда Мд — Fe (см. табл. 2.16) сопровождается поглощением теплоты. Снижение температуры вызывает уменьшение содержания газа в растворе. В этих металлах возможно образование газовой пористости, если расплав содержит большое количество водорода. Растворение водорода в титане является экзотермическим процессом„растворимость растет с понижением температуры и образование водородной пористости невозможно. Взаимодействие с кислородом. Все жидкие металлы взаимодействуют с кислородом. Легкоплавкие металлы — от олова до алюминия (см. табл. 2.16) — практически не растворяют кислород. Взаимодействие этих металлов с кислородом сводится к образованию оксидных плен на поверхности металла. Остальные металлы способны растворять кислород в определенных количествах, после чего начинается образование оксидов. Взаимодействие с азотом. Растворение азота в марганце, никеле и железе является эндотермическим процессом, вследствие чего эти металлы подвержены образованию газовой пористости, вызванной выделением азота из расплава. В титане азот растворяется с выделением теплоты, что исключает образование газовой пористости. Растворение азота в жидких сплавах металлов в общем случае пропорционально содержанию компонентов. Исключение составляют сплавы железа и никеля с добавками алюминия и титана. В этих сплавах образуются твердые нитриды титана и алюминия в виде включений. Для металлов от олова до меди (см. табл. 2.16) азот практически является инертным газом. Взаимодействие с водой. Большая часть металлов в жидком состоянии разлагает воду. Результаты взаимодействия расплава с водой зависят от характера его взаимодействия с водородом и кислородом. Если расплав не растворяет ни водород, ни кислород, то в результате контакта с влагой расплав покроется пленой оксидов, а водород уйдет в атмосферу. Так ведут себя олово, цинк, свинец и все сплавы на их основе. Если же расплав не растворяет кислород, но растворяет водород, происходит окисление поверхности расплава и насыщение его растворенным водородом. Если расплав способен растворять и кислород, и водород, то именно это и будет происходить. Конечное равновесие в системе определяется парциальным давлением паров воды и концентрациями кислорода и водорода в расплаве. 46 Взаимодействие металлов с оксидом углерода. Взаимодействие металлов с оксидом углерода определяется возможностью прохождения реакций: Me + СО - МеО + С; Me + СО -* [Me + О) + С; Me + СО - [Me + С + О]. Свинец, олово и медь с оксидом углерода практически не взаимодействуют, для этих металлов его можно рассматривать как нейтральный газ. Для цинка, магния, алюминия СО является окислительным газом, взаимодействие с ним приводит к образованию нерастворимых оксидов на поверхности расплава. Для остальных металлов, представленных в табл. 2.16, при понижении температуры равновесие между содержанием кислорода и углерода в расплаве сдвигается влево, т. е. в сторону образования СО. Следовательно, расплавы, содержащие растворенные углерод и кислород, при охлаждении и кристаллизации могут поражаться газовой пористостью, образованной оксидом углерода. Подобное, например, происходит в литейных углеродистых сталях в случае недостаточного раскисления. Взаимодействие металлических расплавов с огнеупорными материалами. Огнеупорные материалы, которыми футеруют плавильные печи и из которых изготавливают плавильные тигли, должны быть при высоких температурах механически прочными и химически стойкими, чтобы не вступать во взаимодействие с металлическим расплавом, оксидами,, шлаками, флюсами. Наиболее часто применяют шамот (60—75% SiOj, остальное — АЬОз), динас (более 95% SiOj, остальные — примеси), магнезит (80% МдО, остальное — СаО), хромомагнезит (45—50% МдО, 30—35% СгзОэ, остальное — SiOj), циркон (65% ZrOj, 35% SiOj), высокоглиноземистые огнеупоры (более 50% А12Оз, остальное — SiOj). Самым дешевым и доступным огнеупорным материалом является шамот. Основной характеристикой этих материалов является огнеупор-н о с т ь — температура, °С, при которой материал способен выдержать напряжение сжатия 0,2 МПа (табл. 2.17). (Огнеупорность формовочных смесей оценивается температурой, при которой происходит деформация специальных образцов-конусов — см. гл. 3.)  47 Химическая стойкость огнеупоров определяется возможностью прохождения реакции между жидким металлом и огнеупорным оксидом Me + RO- МеО + [R]Me; Me + RO - [Me + О + R], где R — металл, входящий в состав оксида. В результате этих реакций разрушается футеровка, расплав загрязняется оксидами и примесью R или кислородом и примесью R. Кроме того, возможно взаимодействие оксидов огнеупора и оксидов металла, выражающееся во взаимном растворении. Оценить такое взаимодействие можно по виду диаграммы состояния МеО — RO. Если в системе МеО — RO имеются эвтектики с температурой плавления ниже температуры расплава, то при плавке на воздухе обязательно будет происходить активное разъедание футеровки. Легкоплавкие металлы — олово, свинец, цинк — имеют столь низкие температуры плавления, что для их плавки пригодны любые из рассмотренных огнеупорных материалов. Однако при плавке свинца и его сплавов в шамоте перегревы до 750 ° С приводят к оплавлению футеровки вследствие того, что в системе РЬО — SiO имеется эвтектика с температурой плавления 715° С. ** Поскольку магний при температурах расплава около 850 ° С активно восстанавливает кремний из шамота, магниевые сплавы плавят в печах с магнезитовой футеровкой или в стальных тиглях. При плавке алюминия также происходит восстановление кремния из кремнезема шамота. Поскольку шамот — наиболее дешевый материал, его используют для приготовления алюминиевых сплавов, если примесь кремния допустима в определенных пределах. Медь и многие медные сплавы плавят в шамотной футеровке. Сплавы меди с цирконием, хромом и титаном получают в печах с магнезитовой футеровкой. Для сплавов на основе никеля и железа шамот непригоден из-за недостаточной огнеупорности. Эти сплавы изготавливают в динасе, магнезите, хромомагнезите и цирконе. Иногда металл плавят в графитовых тиглях, но чистый графит пригоден лишь для сплавов, не растворяющих углерод. Кроме того, его применение требует защитной атмосферы, поскольку при температурах, превышающих 600°С, графит на воздухе быстро сгорает. Как добавка в оксидные огнеупоры графит повышает стойкость материала. Широко известен графитошамот (40—50% графита), из которого делают плавильные тигли. Расплавы, рабочие температуры которых не превышают 900 ° С, можно получать в стальных и чугунных тиглях. Главная опасность при этом — возможность насыщения расплава железом. Ее оценивают по диаграмме состояния «железо — расплавленный металл». 48 |