Теория и технология производства стали 1. Учебник для вузов. М. Мир, ООО Издательство act
 Скачать 7.23 Mb. Скачать 7.23 Mb.
|
|
Таблица 8.3. Параметры взаимодействия
8.1.3. Химическое сродство. Способность веществ вступать в химическое взаимодействие называют химическим сродством. Изменение энергии Гиббса используют для определения меры химического сродства веществ. Константа равновесия Крхарактеризует степень протекания реакции в ту или иную сторону. Поскольку ΔG° = При производстве стали протекают процессы окисления железа и его примесей (углерода, кремния, марганца) с образованием соответствующих оксидов (СО, SiO2, MnO). Способность железа и его примесей окисляться, т. е. химическое сродство к кислороду, часто выражают при помощи давления диссоциации оксидов. Давление диссоциации1в данном случае представляет собой давление кислорода РО2 при равновесии системы кислород—оксид: Me + О2 = МеО2, Kp = aMeO2 /(aMe . В случае чистых металла и оксида а Mе02=l иаМе= 1,т. е. Кр=1/р О2 и ΔG º=RТlnPo2. Таким образом, давление диссоциации является мерой прочности оксида: чем меньше эта величина, тем прочнее оксид. Процессы окисления примесей в сталеплавильной ванне с использованием понятия давления диссоциации их оксидов исследованы акад. М. М. Карнауховым. Вычисленные им давления диссоциации оксидов в зависимости от изменения температуры при различных концентрациях того или иного компонента широко используют в металлургической литературе. Если металлы и их оксиды находятся в растворе, а не в свободном состоянии, то давление диссоциации зависит от активности растворенных веществ: 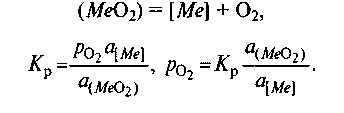 Если металл и его оксид находятся в стандартном состоянии, т. е. активности их могут быть приняты равными единице, то ро2=Кp = рo. Таким образом, в общем случае 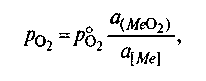 т. е. давление диссоциации прямо пропорционально активности данного оксида в растворе и обратно пропорционально активности растворенного компонента. 8.2. КИНЕТИКА СТАЛЕПЛАВИЛЬНЫХ ПРОЦЕССОВ Кинетика сталеплавильных процессов может быть рассмотрена как частный случай кинетики химических реакций, т. е. учения о законах их протекания во времени. В сталеплавильных агрегатах химические процессы взаимодействия осложняются протекающими одновременно процессами теплопередачи, передачи или подвода реагентов в зону реакции, искусственного или естественного перемешивания реагентов, искусственного отвода продуктов реакции и т. п. Современные представления о кинетике процесса позволяют дать ориентировочный ответ на вопрос о том, каковы скорость данного процесса и ее зависимость от отдельных параметров и стадий процесса. В общем случае процесс, протекающий в сталеплавильной ванне, может быть представлен состоящим из следующих стадий: 1) подвод реагентов к месту реакции;2) акт химической реакции; 3) выделение продуктов реакции в отдельную фазу и их удаление от места реакции. Каждую из стадий можно подразделить на ряд промежуточных. Скорость процесса в целом vr зависит от скорости протекания каждой стадии: v,,v2, v3, ...и т. д., т.е. V∑=1/(1 /V1+ 1/V2+1/V3 + ...). В каждом конкретном случае любая из этих стадий может лимитировать процесс в целом, если скорость ее протекания меньше, чем других. Если, например, скорость V2 снизится до нуля, то значение l/V2 возрастает до 8.2.1. Скорость протекания реакции. В основе кинетики химических реакций как учения о скоростях химических превращений лежит закон действующих масс, согласно которому скорость реакции веществ А, В, С,... пропорциональна произведению их концентраций. Скорость реакции обычно характеризуется уменьшением за единицу времени концентрации какого-либо из исходных веществ или конечных продуктов реакции. Например, скорость вступления в реакцию вещества А (скорость уменьшения его концентрации в единицу времени) выражается уравнением где k —константа скорости реакции; [А], [В], 80 [С],... — концентрации взаимодействующих веществ; минус показывает, что концентоа-ция вещества А убывает со временем. Сумму величин Константа скорости реакции численно равна скорости реакции, если концентрация каждого из исходных веществ равна единице. Практически значения скоростей реакций, протекающих в реальных сталеплавильных процессах, значительно отличаются от определенных в соответствии с законом действующих масс, так как, во-первых, приходится иметь дело с растворами того или иного компонента в шлаке или металле и учитывать влияние растворителя (т. е. неидеальность раствора); во-вторых, реакции в реальных условиях протекают, как правило, в гетерогенных, а не в гомогенных средах, в связи с чем скорости реакций часто определяют для каждого конкретного случая экспериментально. Обычно скорость реакции выражается в изменении концентрации вещества в процентах от массы металла (или шлака) в единицу времени (час или минута); например, скорость окисления углерода составляет -0,5 % С/ч и т. п. 8.2.2. Энергия активации: понятие об активированном комплексе. Влияние температуры на константу скорости химической реакции kвидно из уравнения Аррениуса1 где kf, — константа (так называемый предэкс-поненциальный множитель константы скорости); Е— энергия активации реакции; R— универсальная газовая постоянная. Энергию активации Е обычно определяют экспериментально следующим образом: исследуют кинетику реакции при нескольких температурах и строят график (рис. 8.2) в координатах Ink— 1/Tтангенс угла наклона прямой 1 на этом графике в соответствии с уравнением Аррениуса равен Е. В более сложных случаях зависимость Inkот величины 1/T выражается кривой 2 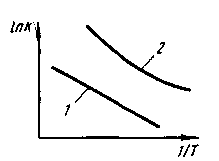 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
