|
|
Теория и технология производства стали 1. Учебник для вузов. М. Мир, ООО Издательство act
9.2. РОЛЬ ШЛАКА
Жидкий металл в процессе плавки и разливки постоянно находится в контакте со шлаком и взаимодействует с ним. Состав шлака, его температура, жидкоподвижность и другие параметры оказывают решающее влияние на процесс плавки и качество металла. Основная задача сталеплавильщика — удалить из металла вредные примеси (обычно это сера и фосфор). Задача решается путем перевода этих нежелательных примесей из металла в шлак и создания условий, препятствующих их обратному переходу из шлака в металл. Изменяя состав шлака, его свойства и температуру, можно также регулировать содержание в металле марганца, кремния, хрома и других примесей. Поэтому сталеплавильщик для выплавки качественной стали должен прежде всего получить шлак необходимых заданных состава и консистенции.
Обычно к сталеплавильному шлаку технологи предъявляют определенные требования.
1. Шлак должен обеспечивать необходимую степень удаления вредных примесей из металла.
2. В окислительные периоды плавки шлак должен обеспечивать интенсивный переход кислорода из атмосферы агрегата через шлак в металл.
3. В другие периоды, а также в ковше после выпуска плавки шлак должен препятствовать переходу кислорода из атмосферы в металл.
4. Шлак должен препятствовать процессам перехода газов (азота и водорода) из атмосферы в металл.
5. Удаляемый из агрегата шлак не должен содержать большого количества железа, так как в этом случае степень использования железа шихты снижается.
6. Во время плавки стали в подовых печах (нагрев сверху) шлак должен хорошо передавать тепло металлу.
7. Во время разливки шлак должен препятствовать охлаждению металла, находящегося в ковше, т. е. сдерживать температуру.
8. Во многих случаях к шлакам предъявляют дополнительные требования (например, к составу шлака, если его используют для изготовления строительных или других материалов, для дорожных покрытий, для известкования или удобрения почвы, для извлечения из металла таких ценных примесей, как ванадий, титан, хром и т.д.).
Из приведенного следует, что требования к шлаку разнообразны. Для получения шлака заданного состава в него вводят расчетное количество добавок (шлакообразующих материалов). В необходимых случаях прибегают к операции скачивания шлака, т. е. определенное количество шлака (иногда почти 100 %) удаляют (скачивают) из агрегата, а затем, вводя необходимое количество требуемых добавок, формируют (наводят) новый шлак заданного состава. Операция скачивания и обновления шлака может проводиться дважды, а в некоторых случаях и трижды.
9.3. МЕТОДЫ КОНТРОЛЯ СОСТАВА И СВОЙСТВ ШЛАКА
Наиболее распространенным методом контроля состава шлака является отбор шлака специальной пробной ложкой для химического или спектрального анализа. Обычно контролируют содержание FeO и основность шлака. Кроме того, когда это требуется, определяют отдельно содержание S1O2, CaO, MgO, MnO и т. п. На практике распространение получил также метод визуального контроля шлака (например, по внешнему виду поверхности и характеру излома шлаковых лепешек, получаемых при наполнении отобранным из печи шлаком специальных открытых изложниц, обычно круглой формы). Если в печи выплавляют сталь одних и тех же марок и технология выплавки стабильна, то такой визуальный контроль позволяет сравнительно легко (и, главное, быстро) выявить происшедшее по какой-либо причине отклонение от обычной технологии. Степень подвижности шлака можно установить путем непосредственного наблюдения за его поведением в печи. Однако для более точного контроля, особенно при проведении научно-исследовательских работ, пользуются специальными приборами. Степень подвижности или обратная ее величина — вязкость шлака — важные показатели процесса взаимодействия шлака и металла, особенно когда скорость всего процесса определяется скоростью диффузии. Коэффициент диффузии и вязкость взаимосвязаны: D-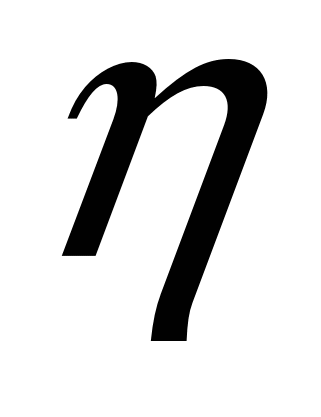
const, т.е. чем меньше вязкость шлака, тем интенсивнее происходит диффузия.
Вязкость шлаков в зависимости от состава изменяется в широких пределах. Наибольшие значения вязкости у кислых шлаков. Вязкость (Па-с): Si02 (в момент расплавления) 15 000, А1203 0,05, СаО 0,05, FeO 0,03. Вязкость силикатов железа и марганца возрастает по мере увеличения содержания Si02 — от 0,058 до 0,4 Па-с. При повышении температуры значения вязкости уменьшаются. Следует иметь в виду, что в специальной литературе приводятся данные о вязкости шлаков, полученных экспериментально исследователями, использовавшими разные методики. Поэтому данные могут различаться, иногда очень сильно. Экспериментаторы, определяя в лабораторных условиях значения вязкости шлаков, принимают специальные меры для обеспечения возможно более полной гомогенности шлакового расплава, выдерживая его длительное время в жидком виде, так как вязкость шлака в значительной степени зависит от его однородности. При этом необходимо учитывать различие составляющих шлак оксидов по плотности: при длительной выдержке в верхних слоях тигля можно зафиксировать повышенное содержание более «легких» оксидов — CaO, SiO2, а в нижних слоях концентрируются более «тяжелые» — FeO, MnO.
В практических условиях в печи или в конвертере шлаки, как правило, не являются гомогенными; они содержат определенное (часто значительное) количество нерастворившихся твердых частиц оксидов, в том числе тугоплавких (например, СаО). Кроме того, в условиях плавки по высоте (толщине) слоя реальных шлаков неравномерными являются и состав, и температура. Если, например, характер газовой фазы над шлаком окислительный, то на границе шлак—газовая фаза содержание высших оксидов железа заметно выше, чем внизу, на границе шлак—металл. Если передача тепла металлу осуществляется сверху вниз (от факела, электрических дуг), то температура шлака в верхних горизонтах заметно выше, чем в нижних. Неравномерность состава и температуры шлака заметно изменяется в зависимости от степени перемешивания ванны, поэтому при оценке вязкости шлака в заводских условиях иногда исггользуют термин кажущаяся вязкость. Для оценки степени подвижности промышленных шлаков используют величину, которую принято называть жидкотекучестью. Для получения данных о жидкотекучести пользуются приборами, называемыми вискозиметрами. Имеется несколько вариантов конструкций вискозиметров1. На рис. 9.1 показана конструкция прибора, предназначенного для определения жидкотекучести шлака в цеховых условиях (так называемого вискозиметра Герти). Небольшую порцию шлака отбирают из сталеплавильного агрегата пробной ложкой и заливают
'От позднелат. viscosus — вязкий и греч. metreo — измеряю.
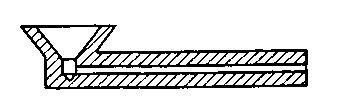
Рис. 9.1. Схема вискозиметра
в приемную воронку разъемного стального вискозиметра. Чем больше жидкотекучесть шлака, тем дальше он затечет в канал. Если обеспечено постоянство отбора пробы, то по длине заполненной шлаком части канала можно судить о жидко-текучести шлака, поэтому жидкотекучесть шлака часто измеряют в сантиметрах.
Имеется также ряд приборов (более сложных в исполнении) для измерения жидкотекучести шлака непосредственно в печи. При помощи таких приспособлений измеряют не абсолютную величину вязкости, а некое значение жидкотекучести реального шлака в конкретном месте отбора пробы.
9.4. СТРОЕНИЕ И СОСТАВ ШЛАКА
После отбора пробы шлака и проведения соответствующего ее анализа мастер, ведущий плавку, получает данные о процентном содержании CaO, SiO2, FeO и т. д. При этом не следует забывать, что в лаборатории анализируют уже застывшую пробу шлака. Существуют различные представления о природе жидкого шлака и о взаимодействии его компонентов, согласно которым в жидких шлаках непосредственно в сталеплавильном агрегате между компонентами шлака возможны и ионная, и ковалентная связи. Преобладающей считается ионная связь. Схематически образование ионов при расплавлении компонентов шлака представляют обычно следующим образом:
FeO->Fe2+ +О2-. СаО->Са2++О2-;
МпО->Мп2++О2-. MgO->Mg2++O2-;
(FeO)2*Si02->2Fe2+ +SiO44-
(MnO)2 *SiO2-> 2Mn2+ +SiO44-;
FeS->F.e2+ +S2-; MnS->Mn2+ +S2-;
CaF2->Ca2++2F-;
(CaO)3*P2O5->3Ca2++3PO43- и т.п.
Какое-то количество этих элементарных структурных единиц (ионов) может входить в состав более или менее сложных комплексов или электронейтральных молекул оксидов. Примеры катионов: Fe2+, Мп2+, Са2+, Mg2+; примеры анионов: О2-, S2-, SiO44-.PO43-, Fe02-,Si2076-.
Состав ионов может изменяться в зависимости от состава шлаков; так, например, в кислом шлаке возможно присутствие следующих сложных ионов, включающих Si44+ и О2-: SiC44- ,Si2O76-,Si3O96-, Si4O128-,Si6O1812-. По мере усложнения размеры (радиусы) ионов увеличиваются (при этом соответственно возрастает вязкость шлаков). Силы взаимодействия ионов в шлаке зависят от отношения величины заряда иона к его радиусу (чем меньше радиус, тем сильнее данный ион при одинаковой величине заряда). Различие в силе ионов приводит к тому, что наиболее сильные катионы соседствуют с сильными анионами. Например, катион Fe2+ соседствует преимущественно с ионами О2-; таким образом, шлак приобретает определенную упорядоченность. Имея в виду ионный характер связей частиц в шлаке, основные реакции между компонентами шлака и металла можно выразить в следующем виде:
(Fе2+)+(02-)↔Fеж+[0];
(Fе2+) + (S2-)↔Fеж+[S]-
в случае железистого шлака;
[0]+(S2-)↔ [S]+(02-)-
в случае маложелезистого шлака;
(Мп2+)+(02) ↔ [Мп]+[0];
5(Fe2+)+2[P]+8(02-) <=> 2(РО43-)+5Fеж.
Для каждой реакции могут быть вычислены соответствующие константы равновесия. Для реальных шлаков, состоящих из многих компонентов, такие расчеты усложняются из-за отсутствия полных данных об активностях компонентов. Решение облегчается, если принять, что шлак представляет собой совершенный ионный раствор, т. е. если принять, что шлак состоит только из ионов, что силы взаимодействия всех анионов и всех катионов равноценны и что ближайшими соседями являются только разноименно заряженные ионы. Тогда активности компонентов шлака равны их ионным долям: aFe2+=xFe2+, aS2-=xS2-, +, aО2-=xО2-
Число молей тех или иных ионов рассчитывают при этом по данным химического состава шлака. Допускается, что nFe2+=n(FeO), nMn2+=n(MnO). nСа2+=n(СаО), nMg2+ = n(MgO), nSiO44- =n(SiO2). nS2- =n(S) и т. д. Присутствие в шлаках Fе2О3, Р2О5 и некоторых других оксидов не учитывается. Однако такой упрощенный подход дает положительные результаты только для ограниченного числа случаев. Предложенные методы расчета активностей компонентов шлака пока имеют частный характер и пригодны для расчетов шлаков лишь определенного состава. Надежные методы объективной оценки активностей компонентов шлака путем непосредственного измерения пока не разработаны (в настоящее время в ряде стран создают приборы для определения активности оксидов железа в шлаке). Для практических целей пользуются полуэмпирическими расчетными уравнениями. Комплекс представлений о характере ионной связи между составляющими жидких шлаков называют ионной теорией шлаков. Большой вклад в создание и развитие этой теории внесли ученые-металлурги О. А. Есин, В. А. Ванюков, П. А. Герасименко, В. А. Кожеуров, А. А. Шварцман, М. И. Темкин, В. И. Явойский и др. Упомянутая выше модель совершенных ионных растворов предложена М. И. Темкиным. В. А. Кожеуров разработал теоретические основы для вычисления коэффициентов активностей компонентов шлака. В. И. Явойский развил представления о механизме передачи газов(водорода, кислорода) из газовой фазы через шлак в металл. Работы в этом направлении продолжаются, так как общая теория строения шлаков еще далека от совершенства. Для отдельных случаев практики разработаны частные решения. Помимо полуэмпирических уравнений можно использовать разработанные специальные диаграммы. Так, для шлаков, состоящих из CaO, SiO2 и FeO (или шлаков близкого состава), активность FeO часто вычисляют по диаграммам Тейлора и Чипмена, Туркдогана и Пирсона, Эллиота и Бодеуорта. Эти диаграммы обычно имеются в справочниках и учебниках (рис. 9.2).
' 1Такое название отличает эту теорию от молекулярной теории шлаков, в соответствии с которой шлаки состоят из молекул, причем одна часть компонентов шлака связана в соединения (силикаты, ферриты и т. п.), а другая часть находится в свободном состоянии. Концентрации свободных компонентов (CaO, MgO, FeO — в основных, SiCb — в кислых шлаках) определяются их избытком по сравнению с количеством, необходимым для образования тех или иных соединений в соответствии со стехиометрическим составом последних. Молекулярную теорию шлаков часто связывают с именем немецкого металлурга Г. Шенка, разработавшего метод расчета концентраций свободных оксидов.
Данные анализа проб шлака металлурги получают с соответствующим пересчетом на массовый состав; при этом приводится содержание компонентов шлака в виде обычных оксидов (FeO, CaO, MnO, SiO2 и т.д.) или в чистом виде [(Fe), (S), (Р) и т.д.]. Составляющие шлак оксиды в соответствии с их химическими свойствами можно разделить на три группы:
1) кислотные (SiO2, P2O5, TiO2, V2O5);
2) основные (CaO, MgO, FeO, MnO);
3) амфотерные (А12О3, Fe2O3, Cr2O3).
Из минералогического анализа шлаков различных вариантов сталеплавильных процессов следует, что наиболее часто встречающимися соединениями в шлаковых пробах являются:
силикаты — FeO-SiO2, (FeO)2-SiO2, MnO-SiO2, (MnO)2-SiO2, (CaO)2-SiO2, (CaO)3-Si02, MgO-Si02, (MgO)2-Si02, Al2O3-SiO2;
фосфаты — (FeO)3-P2O5, (MnO)3-P2O5, (CaO)3-P205, (CaO)4-P205, (MgO)3-P2O5;
алюминаты — FeOA12O3, CaOAl2O3, MgO-Al203;
ферриты — FeO-Fe2O3, CaO-Fe2O3, (CaO)3-Fe203, (CaO)m-(Fe2O3)n.
Из соединений более сложного состава чаще встречаются такие, как монтичеллит СаО-Ж>8Ю2 (где R= Fe, Mn, Mg), мервинит 3 СаО*RO*2 SiO2, силикокарнотит 5 CaOP2O5*SiO2, a также различные шпинели смешанного состава типа алюмоферрита кальция 4CaO*Al2O3*Fe2O3. В хромистых шлаках образуется хромовая шпинель (РеО)n*(Сг2О3)m переменного состава. В высокомагнезиальных шлаках могут присутствовать твердые включения кристаллов периклаза MgO. В высокоосновных шлаках в виде твердых включений может также присутствовать СаО. Все эти соединения обнаружены при минералогическом анализе проб затвердевшего шлака
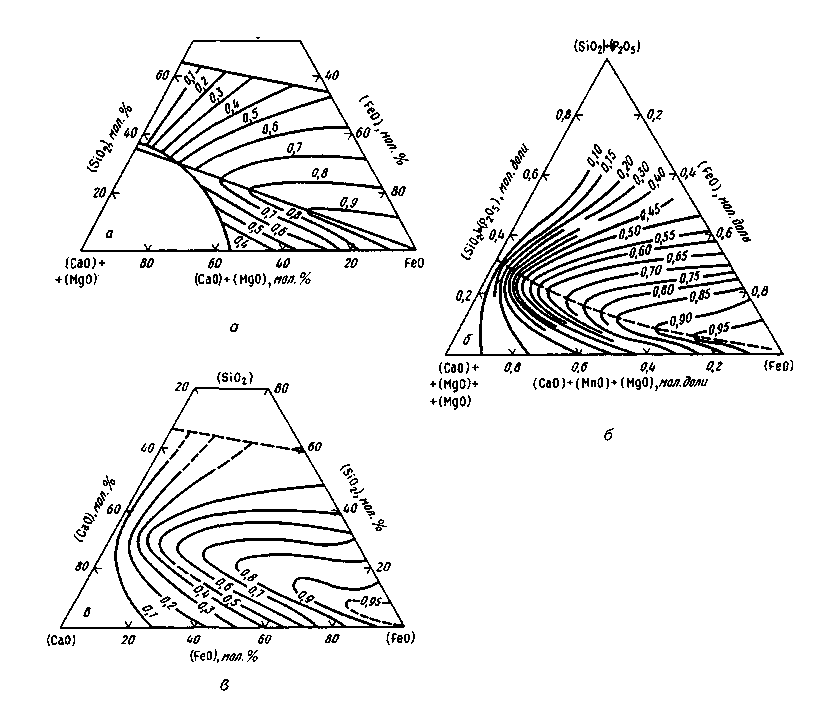
Рис. 9.2. Диаграммы для определения активности монооксида железа FeO в шлаковых расплавах, а:
а —по Тейлору и Чипмену; 6— по Туркдогану и Пирсону; в — по Эллиоту и Бодеуорту
Часто формулы сложных соединений используют при описании процессов, протекающих в сталеплавильных агрегатах, в которых шлак находится в расплавленном состоянии. Необходимо помнить, что по химическим формулам, например FeO или (CaO)2*SiO2 , нельзя установить, находятся ли данные вещества в расплавленном шлаке в виде молекул или ионов. В подобных формулах отражено только соотношение элементов в рассматриваемых шлаках.
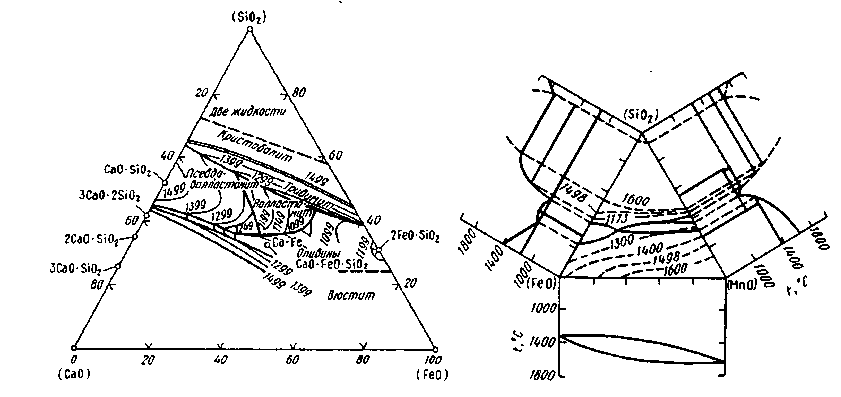
Шлак, в котором преобладают основные оксиды (СаО, MgO, MnO, FeO), называют основным', если в составе преобладают кислотные оксиды, шлак называют кислым. В сталеплавильном производстве работают со шлаками обеих групп: кислыми (45— 60% SiO2, 35-45% (FeO + MnO)) и основными (35-60 % (СаО + MgO), 10-25% FeO, 15-30% SiO2, 5-20% MnO). Диаграммы состояния шлаковых систем показаны на рис. 9.3 и 9.4.
Под основностью шлака понимают отношение массовых концентраций (CaO)/(SiO2) или в случае высоких концентраций фосфора (CaO)/((SiO2) + (Р2О5)). Какой-либо общепринятой градации шлаков в зависимости от их основности нет, однако часто шлаки по признаку основности делят на три группы: низкоосновные — если (CaO)/(SiO2) < 1,5; средней основности - если (CaO)/(SiO2) = 1,6+2,5 и высокоосновные —если (CaO)/(SiO2) > 2,5. Знание основности шлака (для основных процессов) и постоянный контроль за этим параметром очень важны, так как с помощью этой характеристики шлака обычно определяют важнейшее его свойство — способность извлекать из металла вредные примеси (серу, фосфор) и удерживать их в шлаке.
Характеристикой кислых шлаков может служить отношение (SiO2)/(FeO + MnO) или (SiO2)/(FeO + MnO + СаО), которое называют кислотностью шлака.
Важнейшей характеристикой шлака является также величина, называемая окисленностью шлака. Под окисленностью шлака обычно понимают способность шлака передавать металлу кислород. Роль основного окислителя при взаимодействии металла со шлаком принадлежит оксиду железа (FeO). Определенную роль играет также и трехвалентное железо (Fe2O3).
Соотношение двух- и трехвалентного железа в шлаке регулируется по-разному, в том числе составом шлака и окисленностью газовой фазы. Характер влияния этого соотношения на протекание процесса передачи кислорода из шлака в металл достаточно сложен и до конца не изучен. Сложившаяся практика определения окислительной способности шлака свидетельствует об отсутствии полной ясности и единства мнений в этом важном вопросе. Встречаются следующие варианты расчетов окислительной способности основных шлаков на разных заводах (и по данным разных литературных источников).
1. Определение суммарной массовой концентрации FeO в шлаке, рассчитанной по кислороду (%):
∑(FeO) = (FeO) + l,35(Fe2O3).
2. Определение суммарной массовой концентрации кислорода (%), содержащегося в оксидах железа в шлаке:
∑ (0) = 0,222(FeO) + 0,300(Fe2O3).
3. Определение суммарной массовой концентрации оксидов железа в шлаке (%):
∑ (FeO) = (FeO) + (Fe2O3).
4. Определение суммарной массовой концентрации FeO в шлаке (%), рассчитанной по железу:
∑ (FeO) = (FeO) + 0,9(F2O3).
|
|
|
 Скачать 7.23 Mb.
Скачать 7.23 Mb.