Теория и технология производства стали 1. Учебник для вузов. М. Мир, ООО Издательство act
 Скачать 7.23 Mb. Скачать 7.23 Mb.
|
|
8.1.2. Растворы. В сталеплавильной ванне участвующие в реакциях компоненты находятся в виде раствора в металле (железе) и шлаке. Раствором называют однородную смесь, состоящую из двух или большего числа веществ, состав которой в известных пределах может непрерывно изменяться (однородными являются и химические соединения, однако их состав не может изменяться непрерывно, так как они подчиняются законам постоянства состава и кратных отношений). При рассмотрении растворов вообще и растворов, встречающихся в сталеплавильной практике, в частности следует учитывать химическое и физическое взаимодействия компонентов раствора. В одних случаях при образовании раствора никаких химических реакций не происходит, имеет место просто разбавление одного компонента другим; в других случаях одновременно с разбавлением происходит химическое взаимодействие растворителя и растворенного вещества. При этом выделяется (или поглощается) тепло, что важно учитывать на практике. Например, при образовании раствора кремния в железе выделяется значительное количество тепла. Это учитывается, например, при производстве кремнистой стали (динамной, трансформаторной, ЗОХГС и т. п.). Плавку можно организовать таким образом, что перед выпуском металла богатые кремнием ферросплавы в твердом виде можно загружать в ковш без опасения переохлаждения плавки. Вещество, переходя в раствор, становясь компонентом раствора, теряет свою индивидуальность. Значение термодинамических функций для процессов (реакций), происходящих между веществами, находящимися в растворе, существенно отличается от таковых для реакций между чистыми веществами. Например, значения ΔG° для реакции окисления углерода, растворенного в металле, кислородом, находящимся в газообразном состоянии, или кислородом, растворенным в металле, различны: 1/202 + [С] = СОГ, ΔG° = -142 000 -40,79 Т; [О] + [С] = СОГ, ΔG0= -25 000 -37,9 Т. Взаимодействие частиц растворителя и растворенного вещества может быть различным. Количественной характеристикой, учитывающей как концентрацию данного компонента в растворе, так и его взаимодействие с растворителем (или вообще с другими компонентами раствора), является величина, называемая активностью данного компонента в данном растворе. Смысл понятия активность может быть ясен из следующего. Между любой жидкостью и парами этой жидкости устанавливается определенное равновесие (зависящее от температуры). Если в жидкости растворить какой-то другой компонент, то давление пара этой жидкости изменится. Значение подобного изменения широко используют в термодинамических расчетах. Чтобы результаты расчетов можно было сравнивать, необходимо выбрать стандартное состояние, которое является единицей сравнения. В качестве стандартного состояния можно выбрать любое состояние вещества. Обычно в качестве стандартного состояния выбирают либо чистое вещество, либо его однопроцентный раствор. Если р — давление пара компонента, находящегося в растворе, а р° — давление пара компонента в стандартном состоянии, то соотношение р/р° принято называть активностью данного компонента и обозначать а, или р/р° = а. Активность вещества в стандартном состоянии принимают равной единице. Для термодинамических расчетов активность представляет собой вспомогательную расчетную величину, которая характеризует степень связанности молекул, атомов или ионов исследуемого компонента. При образовании данным компонентом в растворе каких-либо соединений его активность понижается и, наоборот, активность возрастает при уменьшении сил взаимодействия между частицами растворителя и растворенного вещества. Теоретически можно представить случай, когда взаимодействие частиц растворителя и растворенного вещества равно взаимодействию частиц растворителя или чистого растворенного вещества. В этом случае при уменьшении концентрации в растворе одного из этих двух компонентов давление пара этого компонента над раствором уменьшается пропорционально уменьшению его концентрации в растворе, т. е. р = р°х, где х — мольная или атомная доля данного вещества в растворе. Это соотношение известно как закон Рауля, согласно которому давление пара каждого из компонентов раствора прямо пропорционально мольной доле данного компонента. В рассматриваемом случае (р = р°х; а = х) активность численно равна мольной доле компонента. Такой раствор принято называть идеальным. Для реальных растворов закон Рауля не всегда соблюдается. Наблюдаемые отклонения от закона Рауля помогают установить природу образования тех или иных растворов. Представим себе раствор, состоящий из компонентов А и В. Частицы А и Л каким-то образом взаимодействуют между собой. Можно принять, что имеются какие-то силы FA.Aвзаимодействия частиц .А между собой, силы FB.Bвзаимодействия частиц В между собой и силы FA.Bвзаимодействия частиц А и В. При этом возможны следующие случаи. 1. Силы взаимодействия частиц А и В равны: FA.A = FA_B = FB.B. В этом случае активности компонентов А и В равны их мольной доле (активности изменяются по мере разбавления раствора): аА = хАи ав = хв. Это идеальный раствор. 2. Силы взаимодействия между частицами Аи В меньше сил взаимодействия между частицами А—А и В—В, т. е. FA.A > FA.B < FB.B, ассоциированные молекулы А—В разъединяются; число молекул (частиц, комплексов) в растворе становится больше их числа в чистых компонентах. Практически наблюдается расширение системы (ΔV> 0), а также поглощение теплоты ( 3. FA_A < FA_B > FB_B, т. е. различные молекулы стремятся ко взаимодействию типа притяжения (комплексо-образование, образование диполей и т. п.). В этом случае образование раствора сопровождается выделением теплоты (ΔН<0) и уменьшением объема (Δ V<0). Уменьшение числа частиц в растворе по сравнению с их числом в чистых растворителях приводит к уменьшению парциальных давлений пара компонентов и общего давления пара системы. Это отрицательное отклонение от закона Рауля. Характерным примером отрицательного отклонения от закона Рауля может служить раствор кремния в железе (рис. 8.1, а). Вид экспериментально полученной кривой свидетельствует о том, что силы взаимодействия кремния с железом FSi.Fe много больше сил .Fsi_si и FFe-Fe. , т.е. FSi-Si « FSi-Fe »F Fe-Fe- Отрицательным отклонением от закона Рауля характеризуются также растворы в железе таких компонентов, как алюминий, ванадий, титан. Если рассмотреть диаграммы состояния этих сплавов, то окажется, что в этих сплавах при охлаждении образуются химические соединения 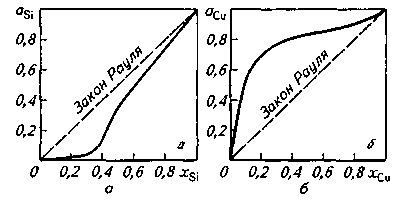 Рис. 8.1. Активность при 1873 К кремния (а) и меди (б) в жидких сплавах с железом железа и растворенного компонента. Однако часто нас интересует не столько характер этих связей, сколько сам факт того, что какие-то связи имеются, значит, активность данного компонента в результате наличия этих связей уменьшается. Примером положительного отклонения от закона Рауля (тенденция к отталкиванию молекул растворенного компонента) может служить раствор меди в железе (рис. 8.1, б). При сильных положительных отклонениях от закона Рауля наблюдается расслоение на две несмешивающиеся жидкости (системы Fe-Ag, Fe-Pb), что также приходится учитывать на практике. Например, для улучшения обрабатываемости, полируемости и других свойств некоторых стальных изделий в сталь необходимо вводить свинец. В связи с трудностью образования однородного раствора свинца в железе применяют специальные, иногда дорогостоящие технологические приемы и получают сталь, содержащую необходимое количество равномерно распределенного по массе металла свинца. На практике чаще приходится иметь дело со сложными растворами (например, в железе одновременно растворены и кремний, и марганец, и углерод и т. д.). Влияние «третьего» компонента может быть различным. Так, например, такие примеси, как марганец или хром, образуют с железом раствор, близкий к идеальному; если же в железе имеется растворенный углерод, то при растворении марганца или хрома имело место отрицательное отклонение от закона Рауля. Большинство компонентов, встречающихся в металлургической практике, образует с железом растворы, далекие от идеальных. Соотношения между составом и свойствами большинства реальных растворов очень сложны и не всегда ясны. Положение облегчается тем, что обычно технологи имеют дело с растворами, содержащими небольшие количества (часто < 1 %) других компонентов. При уменьшении концентрации растворенного вещества свойства реального раствора приближаются к свойствам идеального. Такие растворы принято называть бесконечно разбавленными или просто разбавленными. В этих случаях принято использовать закон Генри, согласно которому в разбавленном растворе давление пара растворенного вещества pjпрямо пропорционально его концентрации Сj, т.е. pj = rCj, где r—коэффициент (константа Генри). Обычно реальные растворы подчиняются закону Генри при изменении концентрации в интервале от долей процента до нескольких процентов1. Для достаточно сильно разбавленного раствора можно принять активность равной концентрации: aj= Сj, или aj — Xj. При повышении концентрации растворенного компонента приходится вводить вспомогательную величину аj = Для ряда компонентов процесс растворения в железе сопровождается выделением (или поглощением) тепла (ΔН #0), а энтропия при растворении изменяется так же, как и в идеальных растворах, — только вследствие изменения концентрации ΔS° = — Rlnx. Это справедливо для растворов кремния, алюминия, меди в железе (такие растворы иногда называют регулярными). Для многих растворов приходится учитывать изменение энтропии не только в зависимости от концентрации, но и вследствие взаимодействия вещества с растворителем ΔS°=—Rlnx+ΔS0 вз. К ним относятся, например, растворы в железе углерода, серы (подобные растворы иногда называют реальными). Уравнения изменения энергии Гиббса при растворении ряда элементов в жидкой стали в числовом виде приведены в табл. 8.2. Для обозначения коэффициентов активности обычно используют символ Inyi =ln где Таблица 8.2. Изменение энергии Гиббса при образовании 1%-ного раствора ряда элементов в жидком железе
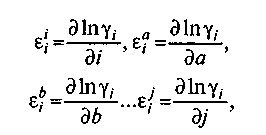 т. е. параметр взаимодействия 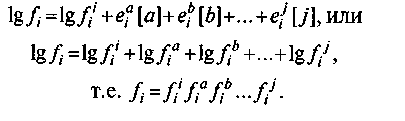 Если компонент а увеличивает величину fi, этому соответствует |
