Теория и технология производства стали 1. Учебник для вузов. М. Мир, ООО Издательство act
 Скачать 7.23 Mb. Скачать 7.23 Mb.
|
|
Часть вторая ТЕОРЕТИЧЕСКИЕ ОСНОВЫ СТАЛЕПЛАВИЛЬНЫХ ТЕХНОЛОГИЙ 8. ПОНЯТИЯ И ЗАКОНЫ ФИЗИЧЕСКОЙ ХИМИИ, ИСПОЛЬЗУЕМЫЕ В МЕТАЛЛУРГИЧЕСКОЙ ПРАКТИКЕ 8.1. ФИЗИКО-ХИМИЧЕСКИЕ ЗАКОНОМЕРНОСТИ СТАЛЕПЛАВИЛЬНЫХ ПРОЦЕССОВ Процессы производства стали представляют собой сложные комплексы физико-химических превращений, происходящих при высоких температурах. В процессах одновременно принимают участие многие компоненты, находящиеся в разных агрегатных состояниях: в твердом (футеровка плавильных агрегатов, добавки и т. п.), жидком (металл, шлак) и газообразном (атмосфера печи, продуваемый через металл воздух или кислород и т. п.). В условиях непрерывного повышения требований к качеству металла, к уровню технико-экономических показателей того или иного процесса необходимо непрерывно углублять знания в области теории металлургических процессов. Достижения физической химии для усовершенствования металлургических процессов применяют начиная с 20—30-х годов XX в. Пионерами использования законов физической химии в металлургии в нашей стране были В. Е. Грум-Гржимайло, А. А. Байков, М. М. Карнаухов. Не только развитие и усовершенствование сталеплавильных процессов, но и обычное ведение плавки с целью получения стали нормального качества невозможны без использования основных положений физической химии. При изучении металлургии стали следует учитывать также тесную связь металлургии стали с химией, физикой, теплотехникой, металлографией и другими науками. Физико-химические явления могут изучаться как опытным путем, путем непосредственного эксперимента, так и на основе выводов и обобщений теоретического характера и учета научных достижений в смежных областях знаний. Существующие методы контроля обеспечивают получение информации о параметрах плавки стали (концентрации взаимодействующих веществ, давлении, температуре и т. д.). При совместном использовании полученной информации и законов физической химии определяют: 1) направление протекания процесса и продукты, которые должны образоваться в результате реакции; 2) конечное состояние системы, пределы, до которых может протекать процесс, состояние системы по окончании процесса; 3)скорость протекания процесса, ее зависимость от отдельных параметров. Первые две задачи решаются методами термодинамики, третья — современными методами исследования кинетики процесса. Основные характеристики процесса (коэффициенты, параметры и т. п.), используемые при решении практических задач, часто получают экспериментально в лабораторных условиях. Однако результаты, полученные в лабораторных условиях (маленькие ванны, маленькие слитки и т. п.), не всегда соответствуют заводским данным. Для заводских условий характерно одновременное действие очень многих факторов, которые не всегда можно учесть в лабораторных установках. Чтобы получить наиболее достоверную информацию о процессе, требуется сочетание, по крайней мере, трех методов: расчетного, экспериментального и опытного. 8.1.1. Основные понятия физической химии, используемые при изучении металлургии стали. Физическая химия как наука оперирует множеством терминов, понятий, имеющих оттенок специального научного значения. Приведем основные из них. Система — группа тел, находящихся во взаимодействии и мысленно или физически выделенных из окружающей среды, например система металл-шлак, футеровка—металл и т. п. На практике чаще приходится иметь дело со сложной системой, например футеровка—металл—шлак—атмосфера агрегата, футеровка (свод)—металл—шлак-атмосфера агрегата—футеровка (под). Исследовать сложные системы трудно, поэтому для получения достаточно полного представления о процессах, происходящих в таких системах, обычно проводят исследования процессов, идущих в частных системах: металл-шлак, шлак—атмосфера и т. д., а затем, совмещая их, пытаются представить полную картину процесса в системе в целом. Такой метод не всегда оправдан, так как на практике процессы, протекающие в частных системах, идут одновременно и оказывают непрерывное взаимное влияние. Так, например, при продувке металла кислородом одновременно имеет место контакт газовой фазы и с металлом, и со шлаком, а также непосредственный контакт металла и шлака, шлака и футеровки и т. д. В связи с этим результаты, полученные при исследовании процессов, протекающих в частных системах, распространять на всю систему нужно с большой осторожностью. В некоторой степени этим объясняется то, что, несмотря на обилие экспериментальных и теоретических работ по исследованию отдельных частных систем, многие вопросы, касающиеся объяснения процессов в реальных сложных системах, до сих пор до конца не ясны. Гомогенная система1— система, химический состав и физические свойства которой во всех частях одинаковы или меняются непрерывно, без скачков (между частями системы нет поверхностей раздела). Гетерогенная система2 — физико-химическая система, состоящая из разных по своим свойствам частей, разграниченных поверхностями раздела. При использовании понятий «металл», «шлак» и т. д. часто подразумевается, что эти части системы гомогенны, однако в большинстве случаев это не так. В металле содержатся неметаллические включения и пузыри газов, в шлаке — нерастворившиеся шлакообразующие, корольки металла, пузыри газов, в атмосфере — частички шлака (плавильная пыль), а иногда и металла. Системы также могут быть однородными и неоднородными. Однородной называется система, в которой все участки объема имеют одинаковые состав (химически однородная) и свойства (физически однородная). В реальных сталеплавильных процессах как состав, так и свойства отдельных частей системы обычно очень неоднородны. Если, например, сделать мгновенный условный вертикальный разрез сталеплавильной печи (во время плавки), то выявится различие таких параметров, как: 1) химический состав подины, химический состав металлической ванны (по глубине), химический состав шлака (по толщине), состав атмосферы (по высоте), химический состав свода (по толщине кирпича); 2) температура (а соответственно и физические свойства) по толщине пода, глубине ванны, толщине шлака, высоте рабочего пространства, толщине свода. Даже в конвертере, несмотря на интенсивное перемешивание, свойственное этому процессу, состав всех частей системы неоднороден. Фаза — совокупность всех гомогенных частей системы, отделенных от других частей системы поверхностью раздела и одинаковых по составу и свойствам. В металлургии имеют дело со следующими фазами: металл, шлак, атмосфера агрегата, дисперсная взвесь неметаллических включений в жидком металле и т. д. На практике фазой называют часть 1 Гомо (от греч. homoios) — подобный, одинаковый. 2Гетеро (от греч. heteros) —другой. системы (металл, шлак и т. д.), не учитывая, что в действительности, например, металлическая фаза на самом деле является также системой, состоящей из нескольких фаз: жидкого металла, взвешенных твердых частиц, неметаллических материалов (футеровка, неметаллические включения), всплывающих жидких неметаллических включений. Из преведенного следует, что для практических целей допустимо условное использование терминов физхимии. Параметры состояния — физические величины, служащие для характеристики состояния системы (давление, объем, концентрация компонентов, температура, плотность и др.). Параметры процесса — величины, характеризующие процесс, т. е. изменение системы, связанное с изменением параметров состояния. Сталеплавильные процессы обычно протекают при практически постоянном давлении (р = const), т. е. являются изобарическим1, поэтому для термодинамических расчетов используют: величины изменения изобарно-изотермического потенциала ΔG, энтальпии2 ΔН, теплового эффекта при постоянном давлении Qp = - ΔН; соотношение между Qpи тепловым эффектом при постоянном объеме Qvимеет вид Qp= Qv-Δ( pV); если в реакции не принимают участие газообразные вещества, то различиями между QpиQv можно пренебречь. В настоящее время не существует методов определения абсолютного значения энтальпии Н. Для проведения термодинамических расчетов условились принимать энтальпию простых веществ (элементов) при 298,15 К (25 °С) равной нулю (Н298 = 0). При образовании из элементов каких-либо соединений определяют не абсолютные значения энтальпии Н, а ее изменение ΔН. Энтропии всех веществ при абсолютном нуле принимают равными нулю (при Т= 0 и s0= 0). Схематически основные термодинамические функции можно представить в их взаимосвязи следующим образом: Произведение TSчасто называют связанной энергией; С—свободная энергия при постоянном давлении (кроме названия изобарно-изотерми-ческий потенциал в технической литературе можно встретить такие ее названия, как потенциал (или энергия) Гиббса2 , свободная энергия при постоянном давлении или просто свободная энергия). Чаще используются названия свободная энергия и изобарный потенциал. Из курса физической химии известно общее уравнение для определения изменения свободной энергии (или энергии Гиббса) при температуре Т: Δ.GT= Δ.HT-T Δ ST. Для проведения практических расчетов и сравнения получаемых результатов оказалось удобным определять изменения свободной энергии для каждого рассматриваемого процесса (реакции) при стандартных условиях. В качестве стандартных обычно принимают условия, при которых парциальное давление3 каждого компонента равно 100 кПа; активность каждого компонента равна единице; конденсированные вещества (жидкости и твердые тела) в жидком виде находятся также под давлением 100кПа. Чтобы показать, что параметры заданы для стандартных условий, используют индекс «°» (например, ΔG0 ,ΔS°, ΔН°,). Стандартное изменение свободной энергии связано с константой равновесия реакции следующим образом: Δ.G° = -RT ln Kp. Это соотношение применимо для любой температуры. В качестве «стандартной» принимают обычно температуру 25 0С, или 298,15 К (в индексе указывают 298). Итак, при стандартных условиях и стандартной температуре параметры процесса обозначают следующим образом: ΔН 0 298, Δ S 0 298 большинстве случаев температура металлургических процессов существенно отличается от стандартной, поэтому величины ΔН и ΔН 0 298 могут существенно различаться. Изменение ΔН в зависимости от температуры связано с изменением теплоемкости: 4 Энтальпия (теплосодержание) (от греч. enthalpo) — нагреваю. 5Тепловой эффект реакции — количество теплоты Q, выделяемой или поглощаемой системой при химической реакции, — равен изменению внутренней энергии системы при постоянном объеме или изменению ее энтальпии при постоянном давлении. 3 Изобарический (изобарный) процесс — термодинамический процесс, протекающий при постоянном давлении в системе. Изо... (от греч. was) —равный, одинаковый и бара (от греч. baros) —тяжесть. 1 Энтропия (от греч. entropid) — поворот, превращение. 2 По имени американского физика-теоретика D. Gibbs (1839—1903), одного из создателей термодинамики и статистической механики, разработавшего теорию термодинамических потенциалов. 3 100 кПа= 1 атм. 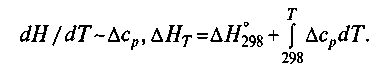 Если в пределах исследуемых температур происходит изменение состояния какого-либо компонента (аллотропическое превращение, плавление, испарение — обычно эти данные также приводятся в специальных таблицах), то тепловой эффект, связанный с этим изменением, (часто используют понятие теплота превращения Lnp или Qпр) должен быть учтен в расчетах: Величина изменения энтропии ΔS0 также зависит от температуры: Если в рассматриваемом интервале температур имеет место какое-то превращение, то 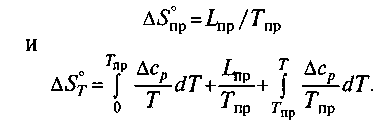 Если же никаких превращений в рассматриваемом интервале температур не происходит, то значение ΔG определяют при помощи выражения Для практических целей чаще используют таблицы, в которых приведены значения термодинамических функций при температурах сталеплавильных процессов, обычно при 1600 "С. На практике температурные условия процесса могут существенно отличаться от 1600 °С; это необходимо учитывать при количественной оценке того или иного процесса. На практике чаще всего используют формулу ΔG= ΔН-ТΔS где ΔН и ΔSблизки к средним значениям ΔН и ΔSдля данного интервала температур. В специальных таблицах значения приводят обычно в виде ΔG =А+ВТ(табл. 8.1). Таблица 8.1. Стандартные энергии Гиббса образования некоторых соединений при температурах сталеплавильного производства (1800-2000 К)
При изменении температуры изменяются | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
