Теория и технология производства стали 1. Учебник для вузов. М. Мир, ООО Издательство act
 Скачать 7.23 Mb. Скачать 7.23 Mb.
|
|
Рис. 8.2. Зависимость константы скорости реакции от температуры Константа скорости реакции k, а следовательно, и скорость реакции значительнее изменяются с изменением температуры в тех реакциях, в которых энергия активации больше. Физический смысл энергии активации сводится к следующему: в реакциях, протекающих с конечной скоростью, число столкновений между молекулами, приводящих к химическому взаимодействию, составляет лишь некоторую (небольшую) часть от общего числа столкновений. Эффективными оказываются лишь столкновения между такими молекулами, между такими конфигурациями атомов, которые в момент столкновения обладают некоторым избытком внутренней энергии по сравнению со средней энергией частиц при данной температуре. Этот избыток энергии определяется энергией активации. На рис. 8.3 по оси ординат отложена энергия рассматриваемой системы молекул, а по оси абсцисс — ход реакции (в единицах времени или массы прореагировавшего вещества). Если прямая реакция (переход из состояния / в состояние II) является эндотермической, то общий запас энергии продуктов реакции меньше энергии исходных веществ, т. е. система в результате этой реакции переходит на более низкий энергетический уровень II. Разность энергий уровней / и // определяет тепловой эффект реакции Q. Уровень М соответствует тому наименьшему запасу энергии, которым должны обладать молекулы, чтобы их столкновения могли приводить к химическому взаимодействию. Разность энергий уровней М и I представляет энергию активации прямой реакции E1, а разность энергий уровней М и // — энергию активации обратной реакции ei. Таким образом, при переходе из исходного состояния в конечноесистема должна преодолеть своего рода энергетический барьер. Иногда помимо истинной энергии активации, определяемой по уравнению Аррениуса, используют понятие кажущаяся энергия активации. Кажущаяся энергия активации может отличаться от истинной, например, на величину тепловых эффектов, сопровождающих процессы адсорбции и десорбции взаимодействующих веществ, и т. п. Другими словами, величина кажущейся энергии активации не учитывает влияние всех факторов на кинетику процесса. В теории скоростей химических реакций широко используют понятие активированный комплекс — это группировка атомов в решающий момент элементарного акта химической реакции. В ходе элементарного акта реакции возникает состояние, являющееся критическим в том смысле, что если оно достигнуто, то дальнейшее движение атомов происходит беспрепятственно, не требуя запаса энергии. Совокупность атомов в этом состоянии принято называть активированным комплексом или переходным состоянием. Если ввести понятие концентрация активированного комплекса прямой реакции Сакт и обозначить продолжительность жизни этих комплексов т, то скорость прямой реакции v представляет собой число соответствующих актов реакции в единице объема в единицу времени, т. е. v = Сакт 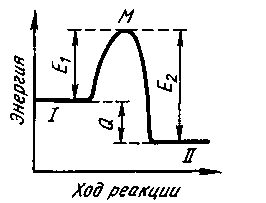 Рис. 8.3. Схема изменения энергии системы в течение реакции Для случая, когда число активных молекул Naсоставляет относительно малую долю от общего числа молекул N, их отношение может быть представлено уравнением Больцмана1 Na/ N= ехр(-E/RT); lnNaa/ N= -E/RT, где Na/ N — относительное число активных молекул. Зная энергию активации, можно определить относительное число активных молекул. Если величина Na/Nзначительно меньше 10-20, то скорость реакции чрезвычайно мала и реакция практически не идет. Если Na/ Nсущественно больше 10-10, то реакция в большинстве случаев происходит практически мгновенно. Значениям Na/ Nот 10-20 до 10-10 соответствует величина Е/Т в пределах от 100 до 50, что для температур сталеварения (порядка 2000 К) соответствует значениям энергии активации от 840 до 420 кДж. По имеющимся данным, значения энергии активации большинства реакций сталеплавильных процессов существенно ниже указанных значений, т. е. акт химического взаимодействия не должен быть лимитирующим для процесса в целом. 8.2.3. Условия зарождения новой фазы. В тех случаях, когда в пределах исходной фазы должна образоваться новая фаза (например, пузырь газа внутри стальной ванны, неметаллическое включение, твердый кристалл металла и т. п.), скорость процесса при прочих равных условиях (давление, температура и т. п.) может лимитировать третья стадия процесса: зарождение и выделение новой фазы. Это связано с тем, что в обычных условиях зародыши любой новой фазы становятся устойчивыми лишь после достижения определенных значительных размеров, а рост зародыша до этих размеров приводит не к уменьшению, а к увеличению энергии Гиббса системы (образование зародыша новой фазы внутри исходной приводит/к созданию поверхности раздела фаз/ а это, в свою очередь, связано с затратой энергии). 1 L. Boltzmann (1844— 1906) — австрийский физик, основатель статистической физики и физической кинетики. Общее изменение энергии Гиббса при протекании процесса ΔGпроц;складывается в данном случае из изменения энергии Гиббса при протекании химической реакции ΔGхр и образовании поверхности новой фазы ΔGпов : ΔGпроц;= ΔGхр+ ΔGпов где ΔGПОВ= f(r зар) Рост зародыша до известных пределов связан с затратой энергии, т. е. свободная энергия системы возрастает. По достижении зародышем определенного размера, называемого критическим, изменение энергии Гиббса достигает максимума; при дальнейшем увеличении зародыша энергия Гиббса системы уменьшается и процесс начинает протекать самопроизвольно. Зародыш новой фазы, имеющий критические размеры, находится в состоянии неустойчивого равновесия с окружающей его средой: если размеры его увеличатся, он будет самопроизвольно расти дальше и суммарная величина ΔGпроц будет уменьшаться; если же размер зародыша немного уменьшится, то последует дальнейшее самопроизвольное его уменьшение, вплоть до полного исчезновения. В соответствии с этим зародыш критического размера называют иногда также равновесным. Значение энергии Гиббса системы до начала процесса G1больше, чем после завершения процесса G2. Таким образом, величина ΔGпр0ц= G2 - G1является отрицательной. При этом слагаемыми ΔGnpou в формуле ΔGnpou = ΔGХр + ΔGnoвявляются: ΔG хр — зависит от количества (объема) вещества, т. е. величина, пропорциональная г3 зар, и ΔGпов—зависит от поверхности (площади) новой фазы, т. е. величина, пропорциональная г2 зар. При очень малых начальных значениях радиуса зародыша г зар величина г3 зар значительно меньше г2 зар (г3 зар < г2 зар ) и роль ΔGnов будет определяющей. Для случая зародыша сферической формы ΔGnов = 4 Самопроизвольное образование зародышей новой фазы внутри исходной связано с явлениями флуктуации1. В результате флуктуации в веществе могут возникать разные сочетания скоплений молекул или атомов, имеющие размеры, достаточные, чтобы служить центрами для выделения новой фазы в данных условиях. Вероятность возникновения зародышей новой фазы зависит от степени пересыщения раствора и от других факторов. Чем выше степень пересыщения (при данной температуре), тем выше вероятность возникновения зародышей. Размер критического радиуса зародыша rзаркрит прямо пропорционален поверхностному натяжению и чем меньше В случае, когда новая фаза уже образовалась, изменение ΔGnов зависит от поверхностного натяжения ΔGnов = где ( На поверхности раздела фаз значение gочень велико и ΔGnов = 0, поэтому наличие готовых поверхностей раздела существенно ускоряет процессы образования новой фазы. Такими поверхностями раздела могут быть, например, границы: металл—футеровка, металл—пузырь газа, металл—взвешенные твердые частички включений и т.д. 8.2.4. Роль диффузии. В большинстве случаев сталеплавильная ванна представляет собой систему, в которой поверхности раздела фаз уже имеются и они достаточно велики (например, при интенсивной продувке ванны), т. е. процессы выделения новой фазы существенно облегчены. В этих случаях, как уже отмечалось, скорость процесса в целом определяется скоростями массопереноса. Напомним, что процессы перемещения компонента внутри фазы обычно называют массопереносом, а через границу раздела фаз — массопередачей. В отдельные периоды конвертерной плавки скорость окисления углерода зависит от того, с какой интенсивностью вдувается через фурму газообразный кислород в ванну. Другими словами, скорость процесса обезуглероживания определяется массопереносом кислорода. Диффузия2 — движение частиц среды, приводящее к переносу вещества и к выравниванию концентраций. В процессе диффузии возможно "взаимное проникновение веществ вследствие теплового движения их частиц. В газах диффузия происходит очень быстро, в жидкостях — медленнее, в твердых телах — весьма медленно. В работах физика-теоретика А. Эйнштейна показано, что средний квадрат смещения частиц при диффузии пропорционален продолжительности диффузии. Коэффициент пропорциональности этого соотношения обозначается обычно латинской буквой Dи называется коэффициентом диффузии. При повышении температуры значения Dвозрастают. Это важно помнить. Если, например, реакция удаления серы из металла в шлак протекает на границе металл—шлак, то чем выше температура, тем более интенсивно идет диффузия серы из объема металла к этой границе, тем скорее удаляется сера из металла. Или, например, если коэффициент диффузии водорода в жидком железе DH = 8 • 10 -3 см2/с, а азота dn = 4 • 10 -5 см2/с, то это значит, что скорость диффузии водорода во много раз больше, чем азота. Немецкий ученый А. Фик в 1855 г. сформулировал закон (I закон Фика), в соответствии с которым диффузионный поток пропорционален градиенту концентраций диффундирующих компонентов (на единицу длины). Диффузионным потоком принято называть поток массы, диффундирующий через единицу площади в единицу времени (размерность — кг/(м2 -с)). При рассмотрении процессов диффузии в жидкой ванне (металле и шлаке) важно учитывать сильное влияние вязкости ( 1 Флуктуации (от лат. fluctuatio — колебание) — случайные отклонения наблюдаемых величин от их средних значений. 2 От лат. diffusio — распространение, растекание, рассеивание. 8.3. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ В СТАЛЕПЛАВИЛЬНЫХ ПРОЦЕССАХ При рассмотрении свойств жидкости (а также и твердого тела) следует иметь в виду, что частицы жидкости, расположенные во внутренних и внешних ее слоях, испытывают разное воздействие со стороны окружающих их частиц, поэтому свойства поверхностных слоев вещества всегда несколько отличаются от свойств его внутренних слоев. При увеличении поверхности изобарный потенциал вещества возрастает, в результате чего увеличивается способность вещества к выделению из данной фазы в любом процессе, т. е. увеличиваются давление насыщенного пара, растворимость, химическая активность и пр. Избыток энергии в тонком слое вещества у поверхности соприкосновения веществ (тел) по сравнению с энергией вещества внутри тела называют поверхностной энергией. Полная поверхностная энергия складывается из работы, затрачиваемой на образование поверхности, т. е. работы, необходимой для преодоления сил межмолекулярного (или межатомного) сцепления (когезии1) при перемещении молекул (атомов) из объема фазы в поверхностный слой, и теплового эффекта, связанного с этим процессом. 1 Сцепление (притяжение) молекул (атомов ионов) в физическом теле. (От лат. cohaesus— связанный, сцепленный.) Обусловлена межмолекулярным взаимодействием. Наиболее сильна в твердых телах и жидкостях. Удельная свободная поверхностная энергия о для подвижных жидкостей тождественно равна поверхностному натяжению. Поверхностное натяжение — важнейшая термодинамическая характеристика поверхности раздела фаз (тел), определяемая как работа, которую необходимо затратить (при данной температуре) для образования единицы площади этой поверхности. В случае жидкой поверхности раздела поверхностное натяжение правомерно рассматривать также как силу, действующую на единицу длины контура поверхности, стремящуюся уменьшить поверхность до минимума при заданных объемах фаз. Поверхностное натяжение выражается в Дж/м2 (энергия на единицу поверхности) или Н/м (сила на единицу длины). Как известно, процессы, связанные с уменьшением потенциала, протекают самопроизвольно. Таким образом, процессы, связанные с уменьшением поверхностного натяжения, будут протекать самопроизвольно. Обычно термин «поверхностное натяжение» применяют при рассмотрении свойств жидкого или твердого тела на границе жидкость—газ или твердое тело—газ, т. е. тогда, когда можно практически пренебречь поверхностным натяжением второй фазы. Для случая поверхностного раздела жидкостей (например, металл—шлак) используют термин «межфазное натяжение». Если поверхностное натяжение одной жидкости При рассмотрении сталеплавильных процессов обычно имеют дело с растворами, в которых силы взаимодействия между их компонентами неодинаковы. Самопроизвольность протекания процессов, сопровождающаяся снижением энергии Гиббса системы (в данном случае связанным с уменьшением поверхностного натяжения), приведет к повышению в поверхностном слое концентрации того из компонентов, поступление которого понижает поверхностное натяжение. Явление изменения содержания данного компонента в поверхностном слое по сравнению с содержанием его во внутренних слоя называют адсорбцией1. Вещества, снижающие поверхностное натяжение растворителя, т. е. вещества, концентрация которых в поверхностном слое выше, чем в растворе, называют поверхностно-активными. Любое вещество в виде компонента жидкого раствора или газа (пара) при соответствующих условиях может проявить поверхностную активность, т. е. адсорбироваться под действием межмолекулярных сил на той или иной поверхности, понижая энергию Гиббса. Однако поверхностно-активными обычно называют лишь те вещества, адсорбция которых уже при очень малой концентрации (десятые и сотые доли процента) приводит к резкому снижению поверхностного натяжения. 1 Поверхностное поглощение, поглощение поверхностным слоем тела или жидкости (адсорбента). Адсорбция —от лат. ad—на, при и sorbeo — поглощаю. Десорбция — явление, обратное адсорбции, т. е. удаление из жидкостей или твердых тел веществ, поглощенных при адсорбции или абсорбции. В соответствии с уравнением адсорбции Гиббса 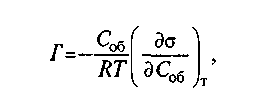 где Г—избыток растворенного вещества в поверхностном слое (обычно выражается в моль/см2); Соб — объемная концентрация растворенного вещества в разбавленном растворе; (d Если о уменьшается с повышением концентрации (d |
