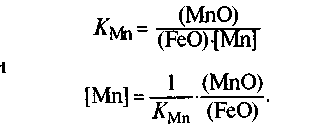|
|
Теория и технология производства стали 1. Учебник для вузов. М. Мир, ООО Издательство act
11.3.1. Влияние температуры. Кремний—легко окисляющийся элемент. Окисление кремния, растворенного в металле, может происходить в результате его взаимодействия с кислородом:
а) растворенным в металле:
[Si] + 2[0] = (Si02),
ΔGo = -542 000 + 202,83 Т;
б) содержащимся в газовой фазе:
[Si] + 02(г) = (Si02),
ΔGo = -775 000 + 198,04Т;
в) содержащимся в оксидах железа шлака:
[Si] + 2(FeO) = (Si02) +2Fe ;
ΔGo =-29 900+98,04T
Во всех случаях при окислении кремния выделяется значительное количество тепла. При точных термодинамических расчетах необходимо учитывать также изменение энергии Гиббса растворения образующейся при окислении кремния SiO2 в шлаке конкретного состава. Из приведенных значений ΔGo следует, что окисление кремния может протекать интенсивно при наличии окислителя во всем интервале температур, характерном для сталеплавильных процессов.
11.3.2. Влияние состава шлака. В агрегатах с основными шлаками реакция окисления кремния протекает практически до конца, так как образующийся кремнезем взаимодействует с основными оксидами и активность SiO2 в основных шлаках ничтожно мала. Кислые шлаки, по крайней мере в конце плавки, насыщены кремнеземом. Активность кремнезема в кислых шлаках близка к единице (аSiО2
l). Если при работе под кислыми шлаками отсутствует интенсивный подвод окислителей (кислорода, воздуха, железной руды), то между насыщенным кремнеземом шлаком и компонентами расплава возможно взаимодействие:
(SiO2) + 2[Mn] = 2(MnO) + [Si],
ΔGo = 32 200 -132,807;
(SiO2) + 2[C] = 2COr+[Si],
ΔGo = 611300 -336,47Т.
Реакции эти идут с поглощением тепла. Значения ΔGoсвидетельствуют о том, что протеканию реакций восстановления кремния способствуют высокие температуры. Кроме температуры на процесс восстановления кремния влияют составы металла и шлака. Влияние температуры для расплава, , тем
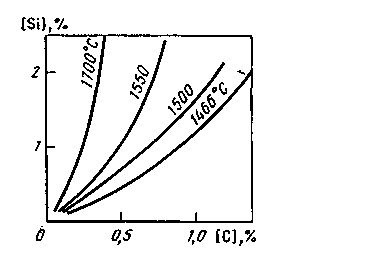
Рис. 11.5. Кривые равновесия реакции SiO2 + 2C ↔ Si + 2CO в расплавах Fe-C
шлака. Влияние температуры для расплава, содержащего кремний и углерод, показано на рис. 11.5. Константа равновесия реакции (SiO2) + 2Fеж = 2(FeO) + [Si] K =а2 (FeO)a[Si]/a(SiQ2); B насыщенных SiO2 шлаках a(SiQ2);=1 и К= а (FeO) * а[Si], откуда а[Si] = К/ а (FeO)
Чем ниже активность оксидов железа в шкале, тем дальше пойдет процесс восстановления кремния. Такие компоненты расплава, как углерод или марганец, понижают окисленность и металла, и шлака, повышая степень восстановления кремния. Основной оксид железа FeO в кислых шлаках связан с кремнеземом в силикаты железа, и его активность мала. Если в шлак ввести более сильный основный оксид, например СаО, то он разрушит силикаты железа, образуя силикаты кальция, и активность оксидов железа в шлаке возрастет, соответственно затормозится процесс восстановления кремния. Таким образом, можно считать, что процесс восстановления кремния из кислых шлаков идет по схеме
(SiO2) + 2Fex = 2(FeO) + [Si],
K =а2 (FeO)a[Si]/a(SiQ2)
а компоненты металла или шлака влияют на а (FeO) смещая равновесие в сторону восстановления или окисления кремния. Если в ванну интенсивно подают окислитель, то имеет место окисление железа, значение а (FeO) возрастает и в металле остаются лишь следы кремния.
11.4. ОКИСЛЕНИЕ И
ВОССТАНОВЛЕНИЕ МАРГАНЦА
Марганец растворяется в железе в любых соотношениях. Имея значительное сходство с железом по атомной массе и другим свойствам, марганец образует с железом раствор, близкий к идеальному. В чистых сплавах Fe-Mn активность марганца изменяется почти полностью в соответствии с законом Рауля. На практике обычно имеется раствор Fe-C-Mn. Углерод уменьшает активность марганца (рис. 11.6), что может быть связано с образованием карбида марганца Мп3С, и наблюдается отрицательное отклонение от закона Рауля.
11.4.1. Влияние температуры. Марганец — элемент, легко окисляющийся, особенно при сравнительно низких температурах; при этом могут образовываться следующие его оксиды: МпО2, Мп2О3, Мп3О4, МпО.
При высоких температурах устойчивым является только МпО. Окисление марганца может происходить как в результате взаимодействия с кислородом, растворенным в металле,
[Мп] + [О] = (МпО)1,
ΔGo= -244 000 +108,78 Т,
так и при непосредственном взаимодействии с кислородом газовой фазы
[Mn] + l/202(r) = (MnO),
ΔGo=-361000 + 106,39T
или с оксидами железа шлака
[Мп] + (Fe)= (МпО) + Fеж
ΔGo= -123000 + 56,40Г.
На основании данных об изменении энергии Гиббса можно сделать следующие выводы: 1) при окислении марганца выделяется тепло; 2) при повышении температуры возможно восстановление марганца из шлака.
Из шлака марганец при благоприятных условиях может восстанавли ваться железом,
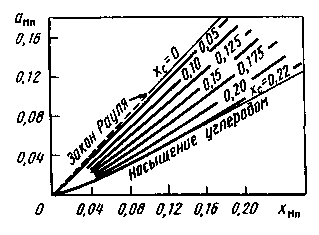
Рис. 11.6. Изменение активности марганца
аМппо мере повышения в стали содержания
углерода (цифры у кривых)
углеродом, кремнием. Константа равновесия реакции (FeO) + [Мп] = (МпО) + Реж, равная
КMn = a(MnO)/a(FeO)*a(MnO), с повышением температуры уменьшается, т. е. равновесие реакции сдвигается в сторону восстановления марганца. Поскольку раствор марганца в железе близок к идеальному, константа равновесия имеет вид:
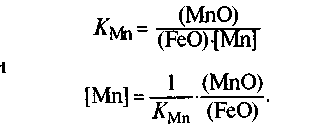
Даже небольшие колебания температуры могут сказаться на изменении содержания марганца.
11.4.2. Влияние состава шлака. Из уравнения для КMn следует, что
[Мn] = (1/KМn) * (a(MnO)/a(FeO) ).
Это означает, что при данной температуре содержание марганца в металле определяется соотношением активностей МпО и FeO в шлаке. Поскольку МпО— основный оксид и в кислых шлаках a(MnO) уменьшается в связи с образованием силикатов марганца, под кислыми шлаками (рис. 11.7) процесс окисления марганца идет более полно (например, в бессемеровском конвертере марганец окисляется практически до следов). При работе под основными шлаками, содержащими МпО, концентрация марганца в металле определяется температурой и a(Fe0)- Введение в ванну большой порции железной руды вызовет повышение a(FeO), содержание марганца в металле при этом уменьшится. Интенсивное протекание реакции (FeO) + [С] = СО + Fеж вызывает некоторое уменьшение a(FeO), что приводит к увеличению содержания марганца в металле.
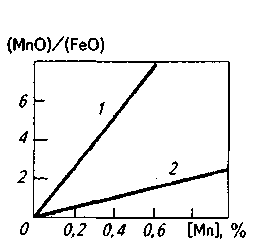
Рис. 11.7. Зависимость отношения (МпО)/(FеО) в кислом (7) и основном (2) шлаках от содержания марганца в металле
Окисленность шлака уменьшается при введении в ванну сильных раскислителей. При этом возрастает содержание [Мп]. В некоторых случаях для повышения a(MnO) в шлак добавляют марганцевую руду или другие материалы, содержащие оксиды марганца. Если ввести в ванну некоторое количество марганца (обычно в виде сплава с железом — ферромарганца), то часть его окислится до содержания, соответствующего соотношению
КMn = a(MnO)/a(FeO) * [Мn],
а часть останется в металле.
11.5. ОКИСЛЕНИЕ И ВОССТАНОВЛЕНИЕ ФОСФОРА
Фосфор растворяется в железе в значительных количествах. При растворении фосфора выделяется некоторое количество тепла:
1/2Р2(г)- [Р], [Р],
ΔG° = -140200-9,62T.
11.5.1. Влияние фосфора на качество стали. Фосфор обычно является вредной примесью в стали, и проведению операции его удаления уделяется большое внимание. Вредное влияние фосфора определяется следующим:
а) значительно расширяется двухфазная область между линиями ликвидуса и солидуса, в результате чего при кристаллизации слитка или отливки возникает сильная первичная ликвация, а также значительно сужается γ-область, что облегчает развитие сегрегации и в твердом состоянии;
б) из-за относительно малой скорости диффузии фосфора в а- и γ-твердых растворах образовавшаяся неоднородность плохо устраняется методами термической обработки (особенно в литой стали, не подвергнутой пластической деформации).
Располагающиеся в межзеренном пространстве хрупкие прослойки, богатые фосфором, снижают пластические свойства металла, особенно при низких температурах (хладноломкость). Вредное влияние фосфора особенно сказывается на стали при повышенном содержании углерода, поэтому в углеродистых конструкционных сталях содержание фосфора не должно превышать 0,035 %, а в некоторых марках —0,030%. В высококачественной стали содержание фосфора не должно быть более 0,020%.
11.5.2. Источники фосфора. В шихту сталеплавильных печей фосфор переходит в основном из чугуна (пустая порода железной руды всегда содержит какое-то количество Р2О5, и в процессе доменной плавки весь фосфор восстанавливается). Некоторое количество фосфора может попадать в шихту из лома, а также ферросплавов. В зависимости от содержания фосфора обычные передельные чугуны разделяют на класс А — чугун, содержащий <0,15%Р, класс Б —<0,20%Р и класс В — < 0,30 %Р. Качественная сталь должна содержать < 0,040 %Р, высококачественная— 0,010-0,020 %Р и ниже. Операция удаления фосфора из металла называется обесфосфориванием или дефосфорацией.
11.5.3. Влияние температуры. Окисление растворенного в металле фосфора может происходить в результате взаимодействия его с кислородом:
а) газовой фазы
4/5 [Р] + O2(г) = 2/5(Р205)
ΔG° = -618 000+ 175,0 T;
б) растворенным в металле
4/5 [Р] + 2 [О] = 2/5(Р205),
ΔG° = -384000+ 170,24 T;
в) содержащимся в оксидах железа шлака
4/5 [Р] + 2 [FeO] = 2/5(Р205) + 2Fеж,
ΔG° = -142 000 + 65,48 Т.
Во всех случаях окисление растворенного в металле фосфора сопровождается выделением тепла. При окислении фосфора газообразным кислородом выделяется значительное количество тепла. В некоторых процессах, связанных с переделом фосфористых чугунов (например, в томасовском процессе), за счет тепла от окисления фосфора происходит нагрев металла. Повышение окисленности шлака способствует процессам окисления фосфора, и, наоборот, снижение активности оксидов железа в шлаке затрудняет протекание этих процессов. Приведенные выше значения ΔG° получены для чистых железистых шлаков. При относительно низкой температуре некоторое количество фосфора может удаляться с сильножелезистыми шлаками. При этом образуются фосфаты железа:
m(FeO) + (Р205) = (FeO)m • (Р2О5), m>3.
`Могут образовываться также такие фосфаты железа, как (Fe2O3) • (Р2О5) и (Fe2O3)2 • (Р2О5). Однако при высоких температурах эти соединения непрочны и фосфор переходит обратно в металл.
11.5.4. Влияние состава металла. Присутствие в металле повышенных количеств легкоокисляющихся примесей (Si, Mn, С и др.) затрудняет процесс удаления фосфора, так как эти примеси взаимодействуют с оксидами железа и окисленность шлака снижается.
11.5.5. Влияние состава шлака. Для удаления фосфора из металла и удержания его в шлаке необходимо снижение активности Р2О5 в шлаке. Это достигается при наведении основного шлака добавками извести (или известняка). Основная составляющая извести СаО взаимодействует с Р2О5, образуя прочные соединения типа (СаО)4 • (Р205) или (СаО)з • (Р2О5). При взаимодействии металла со шлаком, содержащим оксиды железа и кальция, идут реакции:
2[Р] + 5(FeO)+4(СаО)=(СаО)4 • (Р2О5)+5Fe;
2[Р] + 5(FeO)+З(СаО)=(СаО)3 • (Р2О5) + 5Fe.
При продувке ванны кислородом часть железа окисляется и образующиеся оксиды железа (также при наличии основного шлака) взаимодействуют с фосфором. Итоговые реакции могут быть записаны в виде
2[Р] + 2,5O2(г)+4(СаО) = (СаО)4 • (Р2О5);
2[Р] + 2,5O2(г)+З(СаО) = (СаО)3 • (Р2О5).
В качестве характеристики степени дефосфорации часто используют индекс (СаО)4 • (Р2О5)/[Р]2. На рис. 11.8 представлен график, позволяющий получить значение этого индекса, равное 100, при различных окисленности и основности шлака (основность определялась с учетом содержания MgO, МпО и других составляющих шлака). Из рис. 11.9 видно, что при данной основности необходимая степень дефосфорации может быть обеспечена лишь при определенном
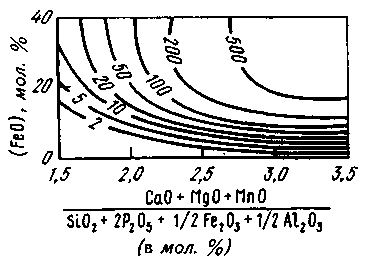
Рис. 11.8. Зависимость индекса дефосфорации от основности шлака и содержания FeO при 1600 °С. Цифры у кривых — величина индекса (СаО)4 • (Р2О5)/[Р]2
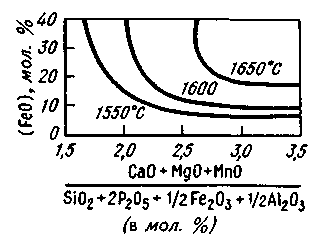
Рис. 11.9. Зависимость индекса дефосфорации от температуры
соотношении между температурой металла и окисленностью шлака. Если температура металла возрастает, необходимо обеспечить более высокую окисленность шлака. Если температура металла остается неизменной, то содержание фосфора в металле определяется основностью и содержанием оксидов железа (рис. 11.9).
Для характеристики дефосфориру-ющей способности шлака используют также более простые соотношения: (Р205)/[Р]2, (Р205)/[Р] или (Р)/[Р]. Возрастание этой величины свидетельствует о повышении дефосфори-рующей способности шлака. Взаимосвязь основности шлака, содержания в нем FeO и показателя (Р2О5)/[Р]2 показана на рис. 11.10. При данной окисленности шлака чем выше его основность, тем больше фосфора перейдет из металла в шлак. При данной основности шлака чем выше содержание в нем FeO, тем лучше условия для удаления фосфора из металла.
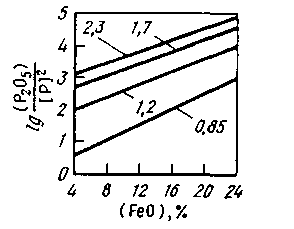
Рис. 11.10. Зависимость величины lg(P2O5)/[P]2
от основности шлака (CaO)/[(SiO2) + (Р2О5)]
(см. цифры у кривых) и содержания FeO
в шлаке при 1600 °С
Оксид FeO играет в процессе дефосфорации двоякую роль, являясь, с одной стороны, окислителем, а с другой — основанием, связывающим Р2О5 в соединение типа (FeO)m • (Р205).
Удаление фосфора обеспечивается протеканием реакции с участием СаО, поэтому конечный результат зависит от активности СаО в шлаке (от основности шлака, рассчитанной с учетом всех компонентов шлака). Поскольку между фосфором, содержащимся в металле и в шлаке, довольно быстро достигается состояние, близкое к равновесному, добиться получения в конце плавки низких содержаний фосфора можно, увеличивая также массу шлака (рис. 11.11). Для этого в агрегат вводят добавки, не содержащие фосфор, т. е. искусственно снижают активность фосфора в шлаке. Однако увеличение массы шлака связано с дополнительным расходом тепла на нагрев этого шлака, а также с дополнительными потерями железа (чем больше масса шлака, тем больше при той же концентрации в шлаке оксидов железа масса железа, которая теряется со шлаком). В связи с этим предпочитают проводить операцию скачивания шлака естественным (при вспенивании шлака) или искусственным (наклоняя сталеплавильный агрегат или с помощью различных гребков) путем — из агрегата удаляют (весь или частично) шлак, содержащий определенное количество фосфора.
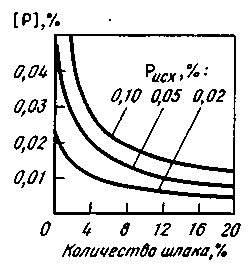
Рис. 11.11. Зависимость содержания фосфора в металле [Р] в конце плавки от количества шлака (% от массы плавки) при разном исходном (первоначальном) содержании фосфора Рисх. Основность шлака (CaO)/(SiO2) = l,8; (FeO) = 15%
После этого в агрегат вводят добавки, не содержащие фосфора (эту операцию называют наводкой шлака). Содержание фосфора в образующемся таким образом шлаке оказывается очень низким, и равновесие реакции сдвигается в сторону дальнейшего протекания процесса окисления фосфора и перехода его в шлак. При необходимости операцию обновления шлака повторяют. Практически для большинства случаев достаточно однократного обновления шлака. Интенсивность образования шлака заданного состава влияет на скорость протекания процесса окисления фосфора. Чем быстрее образуется жидкоподвижный железисто-известковый шлак, тем интенсивнее окисление фосфора.
Если в сталеплавильный агрегат с жидким металлом залить приготовленный в другом агрегате жидкий железисто-известковый шлак, то процесс дефосфорации начнется в момент контакта жидкого шлака с жидким металлом. На этом принципе основана идея обработки металла синтетическим (искусственно приготовленным) шлаком, предложенная в СССР в конце 20-х годов инж. А. С. Точинским. Он предложил при повышенном содержании фосфора в стали смешивать в ковше эту сталь с жидким железисто-известковым шлаком. При этом содержание фосфора в металле удавалось снизить в 3—10 раз (в зависимости от начальной концентрации фосфора).
Возможны несколько способов ускорения шлакообразования. Один из наиболее часто используемых технологических приемов состоит в том, что в самом начале плавки добиваются получения шлака с высоким содержанием оксидов железа. Это достигается различными методами. Например, в кислородном конвертере фурму, через которую поступает кислород, поднимают над поверхностью ванны настолько высоко, что кислородные струи «растекаются» по поверхности металла. В результате интенсивно окисляется железо, быстро формируется активный железисто-известковый шлак и начинается удаление фосфора. Если струю кислорода подать не на поверхность ванны, а в глубь ее, то при прохождении пузырей кислорода через толщу металла быстро окислятся содержащиеся в металле примеси, а на поверхности ванны так и останутся неошлаковавшиеся куски извести.
Другим приемом, к которому приходится прибегать для ускорения шлакообразования, является усиление перемешивания ванны. При переделе чугуна в сталь в конвертерах металл подвергается интенсивному воздействию кислородного или воздушного дутья; создаются настолько благоприятные условия для окисления примесей чугуна (Si, Mn, С), что вся операция продувки продолжается менее 20 мин. Если за короткий промежуток времени продувки шлак не успеет сформироваться, то окажется, что углерод чугуна уже весь окислился, а фосфор еще не удалился. Так и происходит обычно в томасовском процессе, в котором при продувке чугуна воздухом через фурмы, установленные в днище конвертера, шлак не успевает сформироваться и фосфор окисляется в конце операции (когда уже все другие примеси окислились). Такая технология связана с дополнительным окислением железа, насыщением металла газами (азотом) и увеличением продолжительности плавки, что приводит к понижению производительности.
Если воздух, подаваемый для продувки чугуна, частично заменить кислородом, то ускоряются процессы повышения температуры металла, формирования шлака и окисления фосфора. Если вообще воздух заменить кислородом и подавать его сверху на поверхность ванны, то процесс шлакообразования ускоряется еще в большей мере. Процесс пойдет быстрее, если к продувке кислородом добавить операцию искусственного перемешивания.
Еще одним способом ускорения шлакообразования является замена обычного метода загрузки извести вдуванием ее в виде тонкоизмельченного порошка в струе кислорода в металл. Частицы порошка очень быстро прогреваются, а окисление кислородной струей железа обеспечивает образование некоторого количества железистого шлака. В результате формирование железисто-известкового шлака происходит в процессе продувки и соответственно быстро начинает окисляться фосфор.
Ускорить шлакообразование можно также введением в ванну вместе с известью добавок, снижающих температуру плавления СаО и повышающих жидкоподвижность шлака. Этот процесс не должен сопровождаться снижением основности шлака. На практике для ускорения образования активного жидкоподвижного шлака используют боксит с высоким содержанием А12Оз и плавиковый шпат с высоким содержанием CaF2. Таким образом, основными условиями проведения операции дефосфорации являются: 1) наличие окислительной атмосферы и соответственно окислительного шлака, высокая активность оксидов железа шлака (в шлаке должно быть много FeO); 2) высокие основность шлака и активность СаО в шлаке (в шлаке должно быть много СаО и мало SiO2); 3) быстрое формирование железисто-известкового шлака; 4) относительно низкая температура (особенно при средних и высоких концентрациях углерода); 5) малая активность (содержание) фосфора в шкале. На практике для обеспечения этих условий используют такие технологические приемы, как:
1) введение в агрегат оксидов железа в виде железной руды или окалины;
2) введение в агрегат СаО в виде кусковой или порошкообразной извести или известняка;
3) введение в агрегат кислорода или воздуха;
4) максимальное удаление фосфора в начальный период плавки, когда температура металла еще невысока;
5) возможно более раннее формирование активного жидкоподвижного шлака, для чего принимают меры для перемешивания ванны, добавляют в шлак разжижающие его добавки и т. п. В тех случаях, когда это возможно (по условиям производства), в агрегате оставляют жидкий конечный шлак предыдущей плавки, содержащий много СаО и FeO и мало фосфора;
6) обновление шлака (скачивание его с последующим наведением нового, не содержащего фосфор шлака).
|
|
|
 Скачать 7.23 Mb.
Скачать 7.23 Mb.