|
|
Теория и технология производства стали 1. Учебник для вузов. М. Мир, ООО Издательство act
11.5.6. Рефосфорация. Если основные условия дефосфорации в какой-то момент плавки не обеспечиваются, то окислившийся и уже перешедший в шлак фосфор может восстановиться и перейти опять в металл (т. е. происходит рефосфорация). Так, например, бывает в конце плавки, когда температура высока и в металл вводят рас-кислители. Часть раскислителей может попасть в шлак (а не только в металл), что вызовет понижение активности кислорода в металле и оксидов железа в шлаке. Готовую плавку выпускают в ковш; вместе с металлом в ковш попадает конечный шлак. Этот шлак взаимодействует с футеровкой ковша. Если футеровка ковша выполнена из шамота, состоящего из SiO и А12О3, то основность шлака начинает постепенно уменьшаться. Если к тому же в качестве раскислителя используют ферросилиций, то какое-то количество входящего в его состав кремния окислится, образующийся кремнезем перейдет в шлак, также уменьшая его основность. Все это, вместе взятое (высокая температура, уменьшение a(FeO) и CaO/SiO2), создает благоприятные условия для обратного перехода фосфора в металл. В результате последние порции стали, выпускаемой из ковша при разливке, могут содержать фосфора заметно больше, чем первые (за счет рефосфорации).
Если предполагается возможность такого явления, то необходимо в шлак, прикрывающий металл в ковше, ввести некоторое количество кусковой извести с расчетом, что это обеспечит увеличение вязкости, снижение активности и некоторое повышение основности шлака. Учитывая способность фосфора быстро восстанавливаться из шлака, обычно принимают все меры для обеспечения максимального его удаления по ходу плавки. Если, например, в соответствии со стандартом в данной марке стали содержание фосфора должно быть < 0,035 %, то стремятся к концу плавки иметь в металле < 0,010— 0,015 %Р. Лучшим решением проблемы является предотвращение попадания конечного шлака в ковш вообще («отсечка» конечного шлака).
Методы борьбы с фосфором все время совершенствуются, и исследования в этом направлении не приостанавливаются. Важен практический опыт. Например, для получения стали с ультранизким содержанием фосфора (< 0,005 %) необходимо учитывать, что некоторое количество фосфора от предыдущей плавки остается в поверхностном слое футеровки агрегата. Поэтому выплавку сталей с низким содержанием фосфора нельзя проводить непосредственно после плавки (в этом же агрегате) стали с высоким содержанием фосфора.
11.5.7. Дефосфорация в восстановительных условиях. Специально проведенными исследованиями установлена возможность связывания фосфора непосредственно в соединения с щелочноземельными металлами (ЩЗМ) — кальцием, барием с образованием фосфидов типа Са3Р2, Ва3Р2:
ЗСа + 2[Р] = (Са3Р2);
ЗВа + 2[Р] = (Ва3Р2);
З(СаО) + 2[Р] = (Са3Р2).
ЩЗМ имеют высокое химическое сродство к кислороду, поэтому непосредственное образование фосфидов возможно лишь в сильновосстановительных условиях, при исчезающе малых значениях рО2 (менее 10 -п-10 -15 Па). В большинстве сталеплавильных агрегатов трудно создать такие условия. При наличии окислительной фазы или кислорода будут иметь место процессы окисления фосфида (Са3Р2) + 402 = (СаО)3 • (Р2О5) и восстановления фосфора в металл (марганцем, углеродом и др.):
(СаОМР2О5)+5[Мп]=5(МпО)+3(СаО)+2[Р];
(СаО)3 • (Р2О5) + 5[С] = 5СОГ+ З(СаО)+2[Р].
Однако осуществление процесса дефосфорации в восстановительных условиях с удалением фосфора в виде фосфидов позволило бы проводить дефосфорацию высоколегированных сталей без потерь (из-за окисления) таких ценных компонентов, как марганец, хром, титан и др. Исследования в этом направлении продолжаются:
а) хорошо раскисленную сталь обрабатывают смесью карбида кальция и плавикового шпата; в присутствии иона фтора при 1873 К карбид кальция диссоциирует: СаС2 → (Са) + 2[С]; затем происходит образование фосфида: 2[Р] + 3(Са) = (Са3Р2);
б) проводят исследования по организации дефосфорации легированных сталей соединениями типа Na2CO3, К2С03;
в) организуют вдувание порошкообразных силикокальция, карбида кальция или их смесей в токе аргона в металл в восстановительных условиях;
г) организуют фильтрацию жидких сплавов через фильтр из спеченного СаО, покрытого (плакированного) шлаком состава SiCa-CaF2 и др.
1.6. УДАЛЕНИЕ СЕРЫ ИЗ МЕТАЛЛА
11.6.1. Раствор серы в железе. При растворении серы в металле выделяется тепло:
l/2S2(r) →[S],
ΔGº= -72 000-10,25 T,
что является показателем определенных связей между серой и железом в растворе. Несмотря на относительно низкую температуру испарения (445 °С), сера в элементарном виде в газовую фазу практически не переходит, что также свидетельствует о сильных связях серы с железом. Об этом же свидетельствует значительное отрицательное отклонение раствора серы в чистом железе от закона Генри. На диаграмме состояния сплавов Fe-S при 50ат.% S наблюдается максимум, характерный для образования химического соединения (в данном случае FeS), поэтому предполагается наличие сильной ионной связи между ионами Fe2+ и S2-. Косвенным свидетельством образования достаточно прочных группировок Fe-S является также наблюдаемое значительное повышение вязкости железа при увеличении в нем содержания серы. Серу, растворенную в жидком металле, обычно обозначают [S]. Принято считать, что процесс перехода серы из металла в шлак происходит на границе со шлаком:
[Fe2+] + [S2-] ↔ (Fe2+) + (S2-) или
Fеж+[S]↔ (Fе2+) + (82-).
Можно также представить процесс как взаимодействие на поверхности контакта металл—шлак с образованием ионов серы в шлаке и атомов кислорода в металле: [S] + (О2-) = (S2-) +
+ [О]. Иногда это выражение суммируют с уравнением распределения кислорода между металлом и шлаком:
(Ре2+) + (02
) = Fеж+[0],
Реж + [S] = (Fe2+) + (S2-)
[S] + (О2-) = (S2-) + [О].
Для упрощения процесс перехода серы из металла в шлак часто условно обозначают
[S] -»(S).
11.6.2. Влияние серы на качество стали. Сера обладает неограниченной растворимостью в жидком железе и ограниченной в твердом. Предельная растворимость серы в 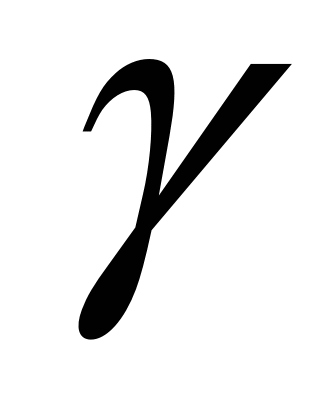 -Fе при 1365 ºС составляет 0,05 %, а при 1000 °С — 0,013%. В -Fе при 1365 ºС составляет 0,05 %, а при 1000 °С — 0,013%. В 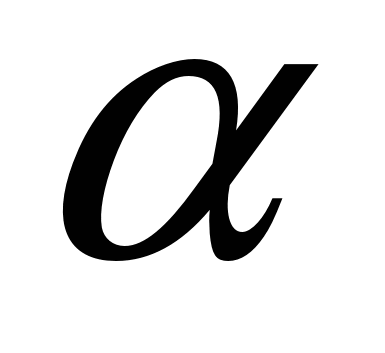 -Fе растворимость серы снижается до 0,002-0,003 % при комнатной температуре. При кристаллизации стали по границам зерен выделяются застывающие в последнюю очередь сульфиды железа. Железо и сульфид железа образуют низкоплавкую эвтектику (температура плавления 988 °С), которая в присутствии кислорода из-за образования оксисульфидов плавится при еще более низких температурах. Межзеренные прослойки (обычно на микрошлифе они имеют вид нитей) фазы, богатой серой, при нагревании металла перед прокаткой или ковкой размягчаются, и сталь теряет свои свойства, происходит разрушение металла (красноломкость)1. Красноломкость особенно сильно проявляется в литой стали (в виде рванин и трещин), так как сульфиды и оксисульфиды в этом случае скапливаются по границам первичных зерен. Если сталь хотя бы однократно подвергалась горячей деформации, то вследствие измельчения зерна и образования при деформации новых зерен красноломкость проявляется в гораздо меньшей степени. Однако и в этом случае стремятся получить в стали минимальное содержание серы, так как вредное влияние серы на механические свойства (в частности, на ударную вязкость) заметно, особенно в направлении, поперечном оси прокатки или ковки. -Fе растворимость серы снижается до 0,002-0,003 % при комнатной температуре. При кристаллизации стали по границам зерен выделяются застывающие в последнюю очередь сульфиды железа. Железо и сульфид железа образуют низкоплавкую эвтектику (температура плавления 988 °С), которая в присутствии кислорода из-за образования оксисульфидов плавится при еще более низких температурах. Межзеренные прослойки (обычно на микрошлифе они имеют вид нитей) фазы, богатой серой, при нагревании металла перед прокаткой или ковкой размягчаются, и сталь теряет свои свойства, происходит разрушение металла (красноломкость)1. Красноломкость особенно сильно проявляется в литой стали (в виде рванин и трещин), так как сульфиды и оксисульфиды в этом случае скапливаются по границам первичных зерен. Если сталь хотя бы однократно подвергалась горячей деформации, то вследствие измельчения зерна и образования при деформации новых зерен красноломкость проявляется в гораздо меньшей степени. Однако и в этом случае стремятся получить в стали минимальное содержание серы, так как вредное влияние серы на механические свойства (в частности, на ударную вязкость) заметно, особенно в направлении, поперечном оси прокатки или ковки.
'Углеродистая сталь приобретает ярко-красный цвет при температуре 900—1000 ºС (цвет каления). Причиной красноломкости может быть также повышенное (более 0,4— 0,5 %) содержание меди; при высоких температурах могут образовываться местные скопления структурно-свободной меди, в результате чего при деформации металла могут возникнуть поверхностные надрывы и трещины.
В катаных или кованых изделиях сульфидные включения обычно вытянуты в виде строчек в направлении горячей пластической деформации, что нарушает сплошность структуры проката или поковки, поэтому в тех случаях, когда нагрузка направлена поперек оси деформации, т. е. перпендикулярно строчкам, стальная матрица разрывается по границам раздела с сульфидами; соответственно снижается пластичность стали в поперечных образцах. Это особенно важно учитывать при изготовлении изделий, подвергающихся знакопеременным нагрузкам или нагрузкам в поперечном (относительно оси прокатки) направлении (трубы для газопроводов высокого давления, резервуары, конструкции для платформ морского бурения и пр.). Степень анизотропии свойств уменьшается по мере снижения содержания серы (рис. 11.12); при снижении содержания серы < 0,003 % степень анизотропии приближается к 1.
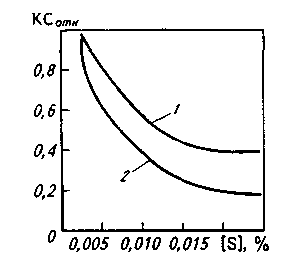
Рис. 11.12. Влияние концентрации серы в стальных бесшовных трубах на относительную ударную вязкость КСОТН, т. е. отношение ударной вязкости на поперечных образцах к ударной вязкости на продольных (Г) и ударной вязкости на вертикальных образцах к ударной вязкости на продольных образцах (2)
Сульфиды отрицательно влияют на результаты испытаний поперечных образцов при пониженных температурах, заметно повышая порог хладноломкости, что, например, особенно важно при разработке технологии производства труб большого диаметра для газопроводов Крайнего Севера. Помимо максимального снижения содержания серы для получения стали с особыми вязкими свойствами принимают специальные меры с целью получить сульфиды в глобулярной форме (а не в виде строчек). Для этого сталь обрабатывают ЩЗМ (кальцием, барием) и РЗМ (лантаном, церием, иттрием и др.).
Для ряда конструкционных сталей основные нагрузки приходятся на продольное, а не на поперечное направление. Для этих сталей такого низкого (< 0,003 %) содержания серы не требуется. Для ряда марок стали, в частности в автомобилестроении, машиностроении, особые требования предъявляют к обрабатываемости стали на станках-автоматах. Для обеспечения высокой обрабатываемости содержание серы регламентировано до 0,02-0,08 %.
11.6.3. Источники серы. К основным источникам относится шихта, и прежде всего чугун. В зависимости от содержания серы обычные передельные чугуны делят на три категории: 1-<0,030%8, II-<0,050 %S, III-< 0,07 % S. Некоторое количество серы может содержаться в стальном ломе и особенно в замасленной стальной стружке. Какое-то количество серы переходит в металл из топлива (при отоплении печи сернистым мазутом или коксовым газом, полученным при коксовании сернистых углей).
Активность серы в жидкой стали зависит от состава расплава. Такие примеси, как углерод, кремний, повышают активность серы в жидком расплаве (рис. 11.13). В связи с этим десульфурация чугуна, содержащего большое количество углерода и кремния, при прочих равных условиях происходит легче, чем десульфурация обычной стали.
Сера является поверхностно-активным элементом, в результате чего на поверхности раздела фаз концент рации серы выше, чем в объеме раствора, поэтому наибольший эффект дают такие методы ведения плавки, которые обеспечивают увеличение поверхности контакта металла с десуль-фурирующей фазой (искусственное перемешивание металла со шлаком, вдувание в металл тонкоизмельченных порошкообразных реагентов и т.д.). Приходится, однако, учитывать, что некоторые другие примеси металла также поверхностно-активны. Если в металле присутствует несколько поверхностно-активных примесей, то между ними происходит как бы «борьба за поверхность». В металле, например, всегда содержится какое-то количество кислорода. Кислород также поверхностно-активен, поэтому в тех случаях, когда в металле много кислорода (металл окислен), на поверхности контакта металла с десульфури-рующей фазой присутствует много кислорода и реакция десульфурации идет с трудом. Если содержание кислорода в металле снизить до определенного уровня (< 0,01 %), то адсорбция серы становится большей, чем адсорбция кислорода, и скорость, и степень удаления серы из металла резко возрастают (рис. 11.14).

Рис. 11.13. Влияние компонентов расплава на активность серы в жидкой стали
11.6.4. Элементы-десульфураторы. Элементы, у которых величина ΔGº при образовании соединений с серой меньше, чем при соединении серы с железом, могут быть десульфуратора-ми. Такими элементами являются Mn, Mg, Na, Ca, а также РЗМ, например церий. Все эти элементы используют на практике: натрий — в виде соды при внедоменной десульфурации чугуна; магний — в чистом виде
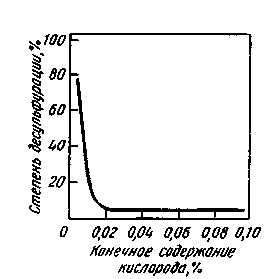
Рис. 11.14. Взаимозависимость окисленнос-
ти металла и десульфурации при продувке
стали известью
или в виде сплавов (лигатур) с другими металлами при модифицировании чугуна, предназначенного для литья, а также при десульфурации передельного чугуна (в тех случаях, когда нужно иметь чистую шихту); кальций — иногда в виде сплавов с другими металлами, а чаще в виде извести (СаО) или известняка (СаСО3); марганец — в виде сплавов марганца с железом, а также в виде марганцевой руды.
Очень большим химическим сродством к сере обладают РЗМ.
11.6.5. Десульфурация в сталеплавильном агрегате. Самым дешевым и доступным десульфуратором является известь (или известняк). Взаимодействие между известью СаО, растворенной в шлаке, и серой, растворенной в металле, может быть представлено как: 1) переход серы из металла в шлак и взаимодействие серы и СаО в шлаке (FeS) + (СаО) = (CaS) + (FeO);
2) взаимодействие на границе металл-шлак Fe + [S] + (СаО) = (CaS) +(FeO),
K= a(CaS) * a(FeO) / a [S] • a (СаО)
или a[s] = a (cas) • a(Fe0)/K- a (СаО).
Чем выше в шлаке активность СаО и ниже активность FeO и серы, тем меньше остается серы в металле.
Для характеристики способности шлака «извлекать» из металла серу часто используют более простое выражение: 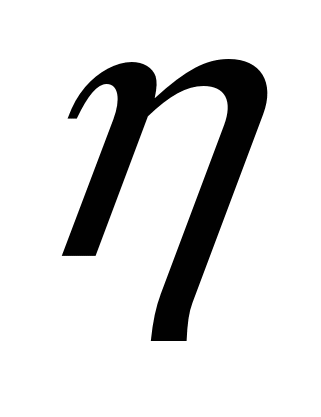 s = (S)/[S]. Величину 4S называют обычно коэффициентом распределения серы, имея в виду, что сера хорошо растворяется и в металле, и в основном шлаке, т. е. в данном случае могут быть использованы положения закона распределения. При повыше- s = (S)/[S]. Величину 4S называют обычно коэффициентом распределения серы, имея в виду, что сера хорошо растворяется и в металле, и в основном шлаке, т. е. в данном случае могут быть использованы положения закона распределения. При повыше-
нии температуры значение 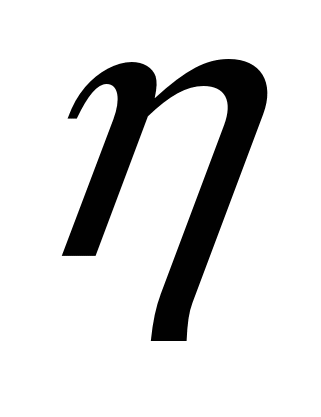 S обычно возрастает, так как при этом улучшается растворение частичек извести, взвешенных в шлаке, а также ускоряется процесс диффузии серы из объема металла к поверхности металл-шлак. S обычно возрастает, так как при этом улучшается растворение частичек извести, взвешенных в шлаке, а также ускоряется процесс диффузии серы из объема металла к поверхности металл-шлак.
Соединение CaS очень прочно. Изменение энергии Гиббса при образовании CaS составляет:
Саж+1/282 (r) = CaST,
ΔGº = -702500 + 193,34Г.
Практически сера, перешедшая из металла в основный шлак, обратно из шлака в металл не переходит (если шлак имеет достаточную основность). В кислых шлаках активность СаО ничтожно мала и в них сера из металла не переходит.
Влияние состава шлака на распределение серы иллюстрирует рис. 11.15, из которого видно, что повысить степень десульфурации (увеличить отношение (S)/[S]) можно двумя способами: либо повысить основность шлака, либо понизить его окисленность. При ведении плавки в окислительных условиях получить малоокисленный шлак (низкие значения a(FеO) ) трудно, поэтому достигаемые значения коэффициента распределения серы в этих условиях обычно малы (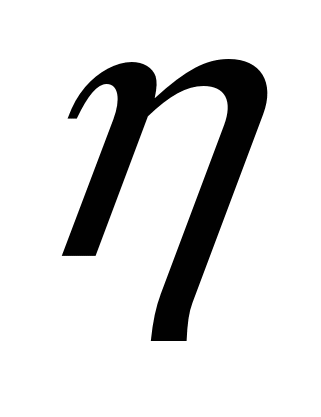 s < 10). s < 10).
11.6.6. Десульфурация синтетическим шлаком в ковше. Десульфурацию металла можно осуществлять в ковше при помощи синтетических шлаков с высокой активностью СаО
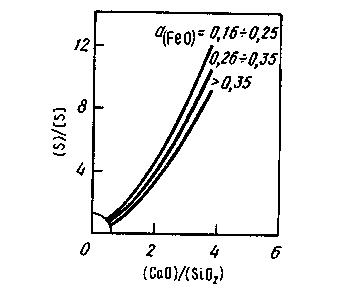
Рис. 11.15. Распределение серы между шлаком и металлом в зависимости от основности шлака и o(Feo)
Шлак выплавляют в отдельном агрегате. Для снижения температуры плавления в состав шлака вводят ряд компонентов (прежде всего А12О3). Основным требованием к химическому составу такого шлака является отсутствие оксидов железа. Удовлетворительные результаты по десульфурации при обработке металла синтетическим шлаком получаются в том случае, если удается при выпуске металла в ковш полностью отсечь (не допустить попадания) тот шлак, который был в агрегате в конце плавки и который содержит большое количество оксидов железа. Для увеличения поверхности контакта металла и шлака, а также степени перемешивания выпуск металла в ковш, в который предварительно залит жидкий синтетический шлак, стремятся организовать с большой высоты. Если условия не позволяют установить отдельный агрегат для приготовления жидкого шлака, то в ковш перед выпуском забрасывают смесь из твердых извести СаО и плавикового шпата CaF2. Расход такой смеси не может быть значительным из-за опасности охладить металл, однако даже небольшое количество смеси (до 1 % от массы металла) приводит к заметному уменьшению содержания серы. При введении в металл раскислителей значения a [O] и a (FeO) снижаются, уменьшается и содержание серы.
Интенсивное перемешивание металла со шлаком при выпуске продолжается всего несколько минут, в течение которых металл выпускают в ковш, поэтому десульфурирующая способность находящегося в ковше шлака при этом полностью не используется. Для более полной десульфурации хорошо раскисленный металл, находящийся в ковше под слоем шлака, подвергают перемешиванию (обычно продувкой инертным газом). Для предотвращения окисления металла атмосферным воздухом (повышения значения a (Feo)) ковш накрывают крышкой.
|
|
|
 Скачать 7.23 Mb.
Скачать 7.23 Mb.