|
|
Теория и технология производства стали 1. Учебник для вузов. М. Мир, ООО Издательство act
Рис. 12.4. Растворимость водорода в сплавах железо-легирующий элемент Rпри нормальном давлении и температуре 1600 °С
(углерод, кремний, алюминий) и имеющие в растворе более сильные связи с железом, чем связи водорода с железом; 3) слабовлияющие на растворимость водорода (никель, кобальт, марганец, молиб-лен, хром); влияние этих элементов на растворимость водорода может проявляться лишь при высоких их концентрациях (высоколегированные стали).
12.2. РАСТВОРЕНИЕ АЗОТА
На основании данных об изменении растворимости азота в железе (рис. 12.5) можно сделать следующие выводы: 1) растворимость азота в 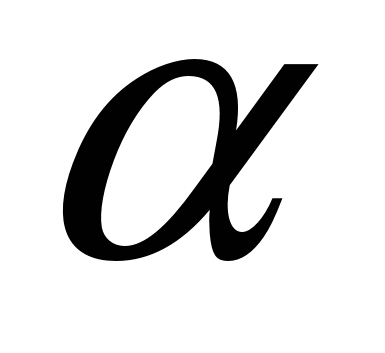 - и - и 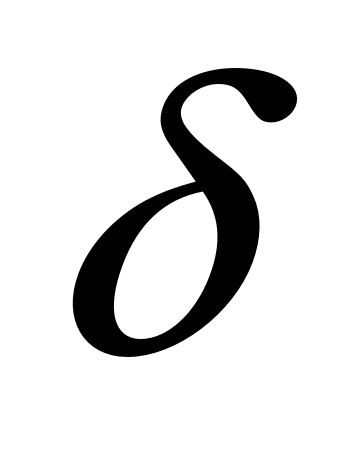 -Fe возрастает при повышении температуры; 2) растворимость азота в -Fe возрастает при повышении температуры; 2) растворимость азота в 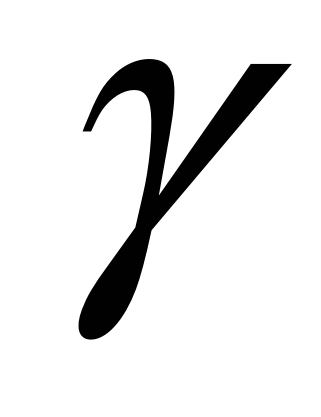 -Fe при повышении температуры снижается, что объясняется снижением прочности нитрида Fe4N; 3) растворимость азота при переходе из жидкого состояния в твердое и из одного аллотропического состояния в другое резко изменяется; 4) растворимость азота в жидком железе с повышением температуры возрастает. Для процесса растворения азота в жидком железе характерны, по крайней мере, две стадии: 1) диссоциация молекулярного азота на атомы N2 → 2N — сопровождается поглощением тепла и 2) растворение атомарного азота N → [N] — сопровождается выделением тепла. Поскольку ΔHцис> Δhраст, суммарный процесс протекает с поглощением тепла. При повышенных температурах наблюдается увеличение содержания азота в металле (например, при продувке техническим кислородом с повышенным содержанием азота, в высокотемпературной зоне дуги при электродуговом обогреве и т. п.). При 1600 °С и pH2=0,1МПа растворимость азота в жидком железе близка к 0,044 %. При этих условиях азот образует с железом раствор, близкий к идеальному. Образование нитридов железа (Fe4N, Fe2N) происходит в процессе охлаждения закристаллизовавшегося металла (в основном в области у?6)- По влиянию на растворимость азота в жидком железе элементы-примеси металла можно разделить на две группы. -Fe при повышении температуры снижается, что объясняется снижением прочности нитрида Fe4N; 3) растворимость азота при переходе из жидкого состояния в твердое и из одного аллотропического состояния в другое резко изменяется; 4) растворимость азота в жидком железе с повышением температуры возрастает. Для процесса растворения азота в жидком железе характерны, по крайней мере, две стадии: 1) диссоциация молекулярного азота на атомы N2 → 2N — сопровождается поглощением тепла и 2) растворение атомарного азота N → [N] — сопровождается выделением тепла. Поскольку ΔHцис> Δhраст, суммарный процесс протекает с поглощением тепла. При повышенных температурах наблюдается увеличение содержания азота в металле (например, при продувке техническим кислородом с повышенным содержанием азота, в высокотемпературной зоне дуги при электродуговом обогреве и т. п.). При 1600 °С и pH2=0,1МПа растворимость азота в жидком железе близка к 0,044 %. При этих условиях азот образует с железом раствор, близкий к идеальному. Образование нитридов железа (Fe4N, Fe2N) происходит в процессе охлаждения закристаллизовавшегося металла (в основном в области у?6)- По влиянию на растворимость азота в жидком железе элементы-примеси металла можно разделить на две группы.
1. Образующие прочные нитриды (ванадий, ниобий, лантан, церий, титан, алюминий). Эти элементы повышают растворимость азота в железе. Такие примеси, как хром, марганец, молибден, обычно нитридов не образуют, но они характеризуются большим химическим сродством к азоту, чем к железу, поэтому также заметно увеличивают растворимость азота.
2. Не образующие нитридов (углерод, никель, медь, фосфор) или образующие с азотом соединения, менее прочные, чем с железом (кремний). Эти элементы заметно снижают растворимость азота в железе.
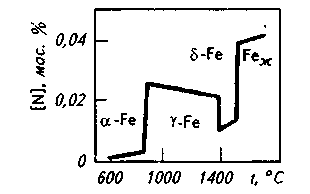
Рис. 12.5. Растворимость азота в жидком железе
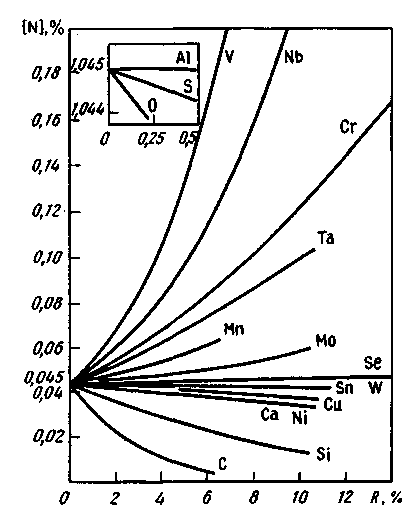
Рис. 12.6. Растворимость азота в сплавах железо—легирующий элемент Rпри нормальном давлении и температуре 1600 °С
Влияние содержания примесей железа на растворимость в нем азота видно из рис. 12.6. При охлаждении стали, содержащей азот, нежелательным является скачкообразное изменение растворимости. При быстром охлаждении азот не успевает выделиться и раствор становится пересыщенным. Процесс выделения избыточного азота протекает во время эксплуатации готового изделия и во многих случаях приводит к ухудшению свойств стали (старение и связанное с этим скачкообразное повышение прочности и понижение пластических свойств). Размеры частиц азота в металле значительно больше, чем водорода, поэтому скорости диффузии азота в железе более низкие. Коэффициент диффузии водорода в жидком железе Dн = = (8,0 + 9,0) • 10
3 см2/с, тогда как для азота D n = 3,77 • 10
5 см2/с, т. е. ниже на два порядка, поэтому при снижении давления (обработка вакуумом) водород удаляется из металла с большей интенсивностью, чем азот.
Наличие в железе поверхностно-активных примесей заметно влияет на процессы растворения (и соответственно выделения) азота. Так, например, кислород является поверхностно-активной примесью. В результате присутствия в расплаве кислорода образуется богатый кислородом поверхностный слой, приводящий к снижению скорости перехода азота через границу газ—жидкий металл, поэтому при малой степени раскисленное™ и небольшом перегреве металла над ликвидусом можно продувать сталь азотом без опасения получить чрезмерно высокое его содержание. Иное развитие у процесса, когда металл хорошо раскислен либо когда в агрегате или в какой-то локальной зоне (например, в зоне электрических дуг или в зоне подачи технического кислорода в ванну) имеют место заметные перегревы металла.
В среднем можно принять, что в кислородно-конвертерной среднеле-гированной стали содержится 0,002— 0,005 % N, в мартеновской стали — 0,004-0,008 % N и в электростали — 0,006-0,012% N.
12.3. РАСТВОРЕНИЕ КИСЛОРОДА
Кислород находится в жидкой стали в виде раствора и в виде оксидных неметаллических включений. При температуре плавления в чистом жидком железе растворяется -0,17% кислорода. При повышении температуры растворимость кислорода в жидком железе возрастает (рис. 12.7). Растворение кислорода газовой фазы в жидком железе может быть описано схемой 0,5О2®→ [О], = [0], K=[0] 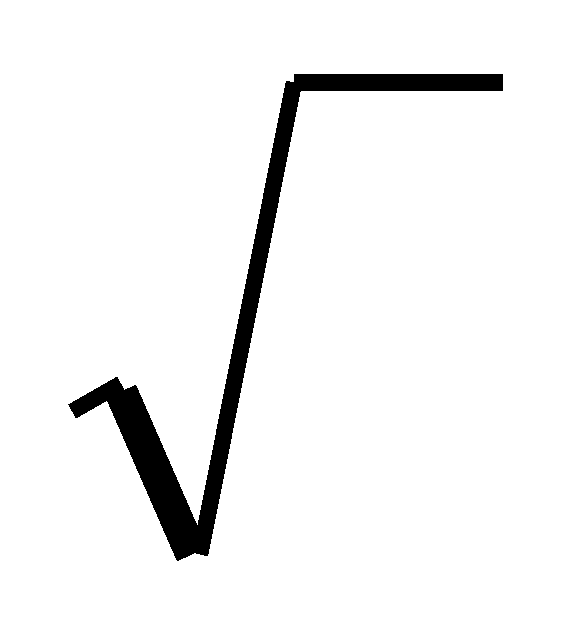 pO2. Константа К характеризует содержание кислорода, растворенного в металле, равновесное с О2 газовой фазы; она может быть выражена формулой pO2. Константа К характеризует содержание кислорода, растворенного в металле, равновесное с О2 газовой фазы; она может быть выражена формулой
lg K=lg[0]/pO21/2=-6100/T + 0,1245.

Рис. 12.7. Растворимость кислорода в жидком железе при равновесии с чистым железистым шлаком
При содержании кислорода, превышающем предел его растворимости в жидком железе при данной температуре, кислород взаимодействует с железом по реакции Fe + [О] = (FeO), образуя обособленную фазу — вюстит. Содержание кислорода, растворенного в жидком железе, равновесное с вюститом, может быть описано уравнением
lg[O]Fe0 = -6320/T+ 2,734,
где [O](Fe0) —содержание кислорода в жидком железе, равновесное с вюститом, маc. %; T—температура.
Расчеты по этим уравнениям показывают, что даже при очень низких парциальных давлениях кислорода в газовой фазе, соприкасающейся с жидким железом, происходит окисление последнего с образованием вюсти-та. Экспериментальное исследование взаимодействия кислорода с расплавленным железом затруднительно, поскольку равновесное давление газа очень низкое (10 -9 — 10 -10 МПа) и измерить его практически затруднительно'.
Растворимость кислорода в  -Fe существенно ниже, чем в жидком железе. В интервале 1400—1500 °С lg[0]S-Fe = -17900/T+7,20. В -Fe существенно ниже, чем в жидком железе. В интервале 1400—1500 °С lg[0]S-Fe = -17900/T+7,20. В  -Fe растворимость кислорода выше, чем в -Fe растворимость кислорода выше, чем в 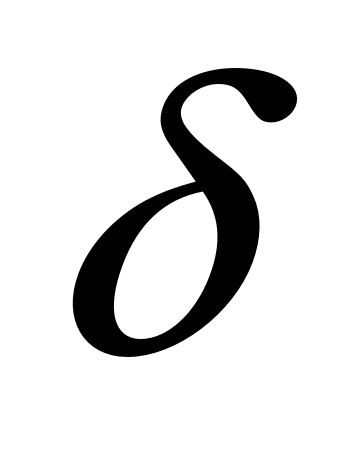 -Fe, что объясняется перестройкой его кристаллической решетки из ОЦК в ГЦК. В -Fe, что объясняется перестройкой его кристаллической решетки из ОЦК в ГЦК. В 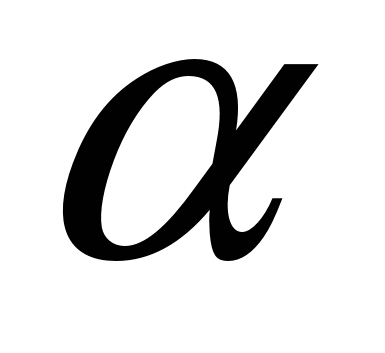 -Fe, так же как и в -Fe, так же как и в 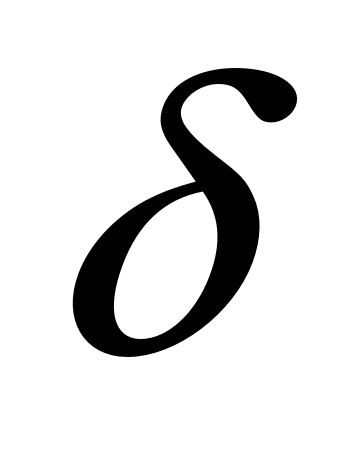 -Fe, растворимость кислорода очень низка (рис. 12.8). При комнатной температуре растворимость кислорода в железе снижается до следов (< 10 -4 %). Уравнение процесса 0,5О2→ [О] условно, так как практически во всех существующих сталеплавильных агрегатах давление кислорода всегда выше равновесного с жидким железом и идет реакция Fеж + 0,5О2 = (FeO). На двойных диаграммах Fe—О левый (железный) угол соответствует -Fe, растворимость кислорода очень низка (рис. 12.8). При комнатной температуре растворимость кислорода в железе снижается до следов (< 10 -4 %). Уравнение процесса 0,5О2→ [О] условно, так как практически во всех существующих сталеплавильных агрегатах давление кислорода всегда выше равновесного с жидким железом и идет реакция Fеж + 0,5О2 = (FeO). На двойных диаграммах Fe—О левый (железный) угол соответствует 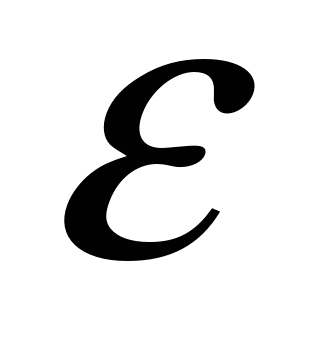 -фазе, -фазе,
1 Обычно процесс растворения кислорода описывают в виде перехода 0,5О2(Г) -> [О].
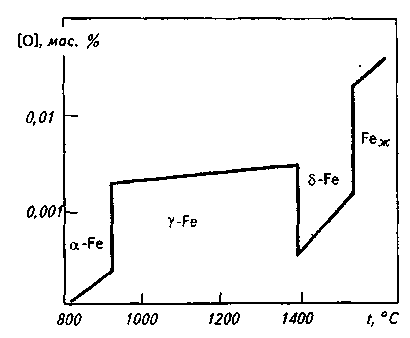
Рис. 12.8. Растворимость кислорода в железе
называемой вюститом (имеет приблизительный состав FeO). Фаза 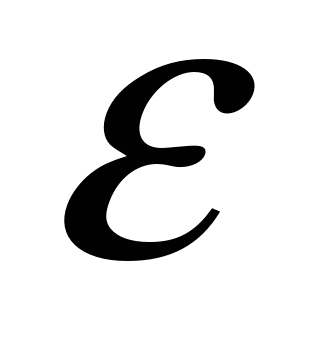 незначительно растворяет железо и в гораздо большей степени растворяет незначительно растворяет железо и в гораздо большей степени растворяет  -фазу, которая соответствует составу Fe3O4 и называется магнетитом. -фазу, которая соответствует составу Fe3O4 и называется магнетитом.
Таким образом, величина [О], характеризующая растворенный в металле кислород, является относительной. В металлургической технике распространение получил метод определения активностей растворенных в железе элементов, основанный на замерах э. д. с. цепи, на одном конце которой находится металл, активность компонента в котором известна (так называемый электрод сравнения), на другом — исследуемый образец. Этот метод в настоящее время широко используется для определения активности кислорода, растворенного в металле. Замеряемое этим методом значение э. д. с. элемента Е пропорционально отношению активностей кислорода в электроде сравнения a[O]c и в исследуемом расплаве а[О]. В соответствии с уравнением Нернста
E=-(RT/nF)ln(a[0]c/a[0]),
где n — число переноса заряда потенциалопределяющего процесса; F— число Фарадея.
В настоящее время метод определения активности кислорода в металле a[О] широко используют на практике для контроля процесса плавки. С помощью выражения a[о] =f [О][О] ПРИ известном коэффициенте активности f[O] можно определить концентрацию кислорода, растворенного в металле (эту величину часто обозначают [О]раст). Полный количественный анализ на кислород (например, методом вакуум-плавления) обеспечивает определение общего содержания кислорода в металле [О]общ. Разность [0]общ - [О]раст = [О]св характеризует количество кислорода, связанного в оксидные включения. Достоверность результатов разделения [О]общ на [0]раст и [О]св зависит от точности определения коэффициента активности f [0] При этом следует учитывать, что системы часто состоят не только из железа и кислорода. Как правило, в жидком металле растворены и другие элементы, которые имеют большее, чем железо, химическое сродство к кислороду. В итоге системы Fe-O-R (R— элемент, растворенный в жидком железе) характеризуются отрицательными отклонениями от идеальности.
В сталеплавильных агрегатах на содержание и активность кислорода по ходу плавки очень большое (как правило, решающее) влияние оказывает углерод (рис. 12.9). Образующиеся в процессе взаимодействия углерода и кислорода пузыри СО выделяются из сталеплавильной ванны, создавая эффект кипения ванны. При содержании углерода <0,10% процесс кипения' ванны замедляется и углерод уже не определяет и не регулирует окислен-ность металла. Начинается проявление преобладающего влияния других факторов на уровень окисленности металла, и
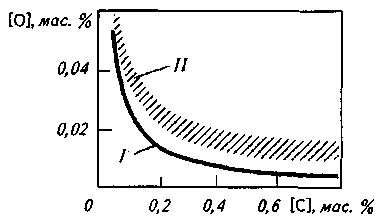
Рис. 12.9. Влияние углерода на окисленность металла в сталеплавильной ванне при ее кипении:
/— кривая равновесных концентраций [С] и [О]; //— область концентраций [С] и [О], фактически наблюдаемых в кипящей сталеплавильной ванне
прежде всего активности оксидов железа в шлаке. При отсутствии кипения обычно соблюдается соотношение a(FeO)/a[O]= const: чем выше активность оксидов железа в шлаке, тем выше окисленность металла. В тех случаях, когда в ванну вводят добавки, содержащие элементы, обладающие большим химическим сродством к кислороду, чем железо (например, кремний, алюминий, марганец), окисленность металла определяется уже уровнем активности этих элементов-раскислите-лей. Некоторые примеси (такие, как никель, молибден, медь), имеющие меньшее химическое сродство к кислороду, чем железо, повышают активность кислорода в стали. При введении в металл элементов-раскисли-телей в нем образуются оксидные неметаллические включения. После кристаллизации в твердой стали практически весь кислород находится не в растворе, а в виде оксидных неметаллических включений, образовавшихся: 1) при введении раскислителей (и взаимодействии их с кислородом, растворенным в металле); 2) во время выпуска и разливки в результате повторного окисления (кислородом воздуха); 3) из шлака, огнеупорной кладки; 4) по ходу плавки как результат поступления в металл вместе с добавками; 5) при затвердевании стали (в результате взаимодействия включений различного происхождения).
12.4. ИСТОЧНИКИ ГАЗОВ,
РАСТВОРЕННЫХ В МЕТАЛЛЕ. УДАЛЕНИЕ ГАЗОВ ИЗ МЕТАЛЛА
К основным источникам газов относятся: 1) шихтовые материалы; 2) атмосфера плавильного агрегата, а также подаваемое на поверхность или в глубь ванны дутье (технический кислород или воздух); 3) ферросплавы и различные добавки, вводимые в металл или в шлак по ходу плавки и разливки; 4) атмосфера, окружающая жидкий металл при выпуске и разливке. Большое количество газов вносится в металл с шихтой. Несмотря на то что эти газы в значительной мере удаляются из металла по ходу плавки, на насыщенность шихтовых материалов газами технологи обращают особое внимание. Лом содержит обычно 0,0004-0,0008 % Н и 0,003-0,005 %N. Содержание кислорода в скрапе зависит от его состава, а также от степени окисленности поверхности. С ржавым скрапом вносится также много и водорода. Содержание водорода в мелком скрапе, покрытом слоем ржавчины толщиной 0,1 мм, повышается до 0,122%, т.е. подобный скрап неприемлем при выплавке качественной стали. В некоторых случаях для производства сталей и сплавов особо ответственного назначения поверхность скрапа, используемого в качестве шихты, тщательно очищают, например в дробеструйной установке.
Чугун содержит обычно 0,0010— 0,0025 % Н и
0,005 % N. Содержание водорода в чугуне в случае повышенной влажности воздуха дутья, а также при подаче в доменную печь природного газа может быть существенно выше. Во все периоды плавки металл в большей или меньшей мере соприкасается с печными газами. Площадь поверхности соприкосновения металла с газами зависит от типа процесса и периода операции; во время продувки металла в конвертере, при завалке легковесной шихты в мартеновские или электродуговые печи, при выпуске металла из печи и при его разливке площадь поверхности соприкосновения металла с газом больше, чем в те периоды плавки, когда металл покрыт шлаком.
Содержание любого газа в металле зависит от его парциального давления в окружающей металл атмосфере. Практика показывает, например, что содержание азота в стали, полученной при продувке чугуна воздухом, выше, чем при продувке чистым кислородом; содержание водорода в мартеновской стали при отоплении печи природным газом выше, чем при отоплении мазутом, содержащим меньше водорода. Принимая во внимание это обстоятельство, наиболее чистую по содержанию газов сталь можно получать при плавке и разливке в вакууме. В этом случае металл не только не насыщается газами из атмосферы, но и, наоборот, содержащиеся в металле газы экстрагируются из него. В обычных условиях роль, аналогичную воздействию вакуума, играют пузыри СО, которые образуются при окислении углерода. Водород и азот, растворенные в металле, стремятся выделиться в пузырь СО, поскольку их парциальные давления в нем равны нулю.
В тех случаях, когда металл кипит, изменение содержания газов в нем зависит от двух действующих в противоположном направлении факторов: насыщения металла газами в результате влияния атмосферы агрегата и выделения газов из металла вместе с пузырями монооксида углерода. В момент, когда кипение по каким-либо причинам прекращается, прекратится и очищающее действие пузырей СО. Так, например, в восстановительный период электроплавки (см. ниже) содержание азота в стали возрастает в результате прекращения окисления углерода и сопутствующего ему удаления азота (при непрерывном поступлении азота из атмосферы печи и шлака в металл). Такое же, как и кипение ванны, очищающее воздействие оказывает продувка металла инертным газом (например, аргоном) или разливка стали в атмосфере инертного газа. В ряде случаев, когда металл не содержит нитридообразующих примесей и температура металла невелика, аргон для продувки заменяют более дешевым азотом. Содержание азота в металле при этом почти не изменяется, а содержание водорода уменьшается. Продувка металла в ковше и защита струи металла при разливке инертным газом получили самое широкое распространение в сталеплавильном производстве. Кроме указанных факторов на содержание газов в металле влияют также вводимые по ходу плавки добавки (известь, руда, ферросплавы и т. д.).
Особое внимание необходимо уделять контролю состава извести. Основная составляющая извести СаО взаимодействует с содержащейся в воздухе влагой СаО + Н2О = Са(ОН)2. В результате получается рассыпающаяся в рыхлый порошок так называемая пушонка. Получаемая при обжиге известняка известь должна немедленно использоваться, длительное ее хранение недопустимо. Если по условиям производства это трудновыполнимо, известь заменяют известняком, так как он малогигроскопичен. Много влаги (особенно зимой) могут содержать железная руда и боксит. Некоторые виды ферросплавов и легирующих добавок содержат значительные количества азота и водорода. В виде гидроксила ОН- некоторое количество водорода содержится в шлаке. Содержание водорода в шлаке, так же как и в металле, пропорционально квадратному корню из давления паров влаги в атмосфере агрегата (H)= 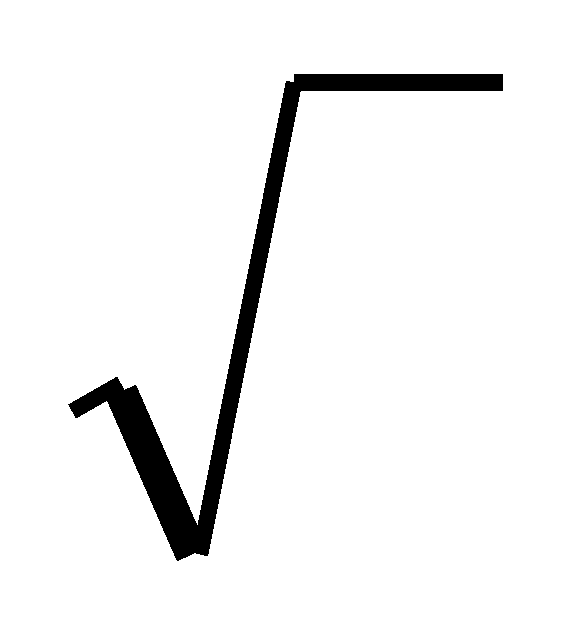 pH2O. Если в шлаке много водорода, то во время выпуска плавки при перемешивании такого шлака с металлом часть водорода может перейти в металл. Учитывая, что водород в металле находится в основном в виде протона Н+, а в шлаке — в виде иона гидроксила ОН-, можно определенным образом воздействовать на процесс удаления водорода посредством электрического поля. При этом на катоде идет процесс выделения водорода: pH2O. Если в шлаке много водорода, то во время выпуска плавки при перемешивании такого шлака с металлом часть водорода может перейти в металл. Учитывая, что водород в металле находится в основном в виде протона Н+, а в шлаке — в виде иона гидроксила ОН-, можно определенным образом воздействовать на процесс удаления водорода посредством электрического поля. При этом на катоде идет процесс выделения водорода:
H+ + e = Hг, Нг+Нг = Н2(г),
а на аноде образуется вода:
4ОН- = 2Н2Ог + О2(г) +4е.
Однако для практических целей это явление использовать сложно.
Таким образом, получению металла с минимальным содержанием водорода и азота способствуют следующие мероприятия: 1) использование чистых шихтовых материалов; 2) ведение плавки в атмосфере с минимальным содержанием водорода и азота; 3) организация по ходу плавки кипения ванны; 4) обработка металла вакуумом; 5) продувка металла инертными газами. Вредное влияние водорода и азота снижается при введении в металл примесей, связывающих водород и азот в прочные гидриды и нитриды, например при введении редкоземельных металлов (РЗМ) — церия, лантана и др. или при введении значительных количеств алюминия при выплавке нестареющей стали и т. д.
|
|
|
 Скачать 7.23 Mb.
Скачать 7.23 Mb.




