Теория и технология производства стали 1. Учебник для вузов. М. Мир, ООО Издательство act
 Скачать 7.23 Mb. Скачать 7.23 Mb.
|
|
11.9. УДАЛЕНИЕ ПРИМЕСЕЙ ЦВЕТНЫХ МЕТАЛЛОВ Поскольку металлолом (обычно содержащий некоторое количество примесей цветных металлов) становится основной составляющей метал-лошихты, содержание примесей цветных металлов, которые переходят в металл из шихты, возрастает. Во многих случаях, особенно при производстве качественных конструкционных сталей, присутствие даже сотых и тысячных долей процента нежелательных примесей цветных металлов заметно ухудшает свойства стали. Низкие температуры плавления и склонность ряда примесей к ликвации усугубляют положение. В качестве иллюстрации приведем результаты проведенного ЦНИИЧМ сравнения состава канатной стали, полученной из обычной шихты и из шихты с использованием чистого по примесям губчатого железа:
Сравнение качества и механических свойств показало следующее: прочность, пластичность и результаты испытания проволоки для канатов на перегиб и скручивание из стали, содержащей меньше примесей цветных металлов, оказались существенно выше. Сталеплавильные процессы характеризуются окислительным характером газовой фазы. По химическому сродству с кислородом примеси цветных металлов можно расположить в следующий ряд: Bi, Cu, Pb, Sb, Ni, Co, W, Sn, Mo, Fe, Zn, Cr, Mn, V, Si, Ti, B, Zr, Al, Mg, Ca. Все элементы, размещенные справа от железа, в процессе плавки стали окисляются. По химическому сродству к кислороду и температуре испарения примеси цветных металлов, поступающие в сталеплавильные агрегаты вместе с металлоломом, можно разделить на четыре группы: 1. Si, Al, Ti, Zr, В, V— обладают высоким химическим сродством к кислороду и окисляются до следов в первые периоды плавки. 2. Мп, Сг — химическое сродство к кислороду близко к таковому для Fe; эти элементы распределяются между шлаком и металлом в зависимости от активности их оксидов в шлаке. 3. Си, Ni, Sn, Mo, Co, W, As, Sb -химическое сродство к кислороду меньше, чем таковое у Fe; эти элементы почти полностью остаются в стали в растворенном состоянии; удаление их из стали затруднительно. 4. Zn, Pb — удаляются из агрегата вследствие своей легкоплавкости и летучести. Во время плавления шихты цинк (температуры плавления 419,5 °С, кипения 906 °С) улетучивается, окисляется и удаляется с отходящими газами; встречаясь на пути со сравнительно холодными поверхностями, оксид цинка на них конденсируется. В результате при переработке цинксодержащей шихты (например, пакетов из кровельного железа, бытовых отходов и т. п.) на поверхности насадок регенераторов и в боровах мартеновских печей, на трубках котлов-утилизаторов конвертеров и т. п. откладывается слой оксида цинка, снижая стойкость и футеровки, и оборудования. Для исключения этих нежелательных явлений необходима предварительная высокотемпературная обработка цинксодержащих отходов с одновременным улавливанием цинка. Свинец (температуры плавления 327,4 °С, кипения 1750°С) или улетучивается из агрегата при воздействии высоких температур (что вредно для здоровья), или, быстро расплавляясь, стекает вниз. Обладая при повышенных температурах высокой жидкоте-кучестью, он просачивается в малейшие неплотности кладки. Образованные свинцом каналы могут привести к уходу металла через кладку. «Зараженная» свинцом футеровка может стать источником попадания свинца в металл во время последующих плавок. Решением проблемы может быть организация предварительного подогрева лома. Наиболее трудной задачей является удаление из металла элементов группы 3. Такие элементы, как Ni, Co, Мо, W, Си, используют для легирования некоторых сталей. Если в перечне марок, которые включены в заказ цеху, имеются стали, содержащие данные элементы, то, получив пробу металла с указанием на наличие этих элементов, можно выбрать соответствующую марку из общего пакета заказов. Если соответствующей марки в пакете заказов нет, то плавку или бракуют, или проводят выпуск с полученным содержанием этих элементов. Способы удаления их из стали не разработаны. Во многих случаях содержание в стали рядовых марок небольших количеств таких примесей, как Ni, Mo, Co, W, невредно (иногда даже полезно). Постепенное, но неуклонное повышение содержания в стали меди, попадающей в металл вместе с ломом, стимулирует поиск методов ее удаления, поскольку медь ухудшает качество стали таких групп, как электротехнические, инструментальные, пружинные, высокопрочные, для глубокой вытяжки и т. д. Эффективные пути и методы снижения содержания меди пока не разработаны. Одним из возможных вариантов является перевод содержащейся в металле меди в сульфид. Источником серы может быть такой минерал, как пирротин (магнитный колчедан), состоящий в основном из Fe1-nS (n = 0,1-0,2). При попадании пирротина в сталеплавильную ванну при определенных условиях возможна реакция между сульфидом железа и растворенной медью с образованием сульфида меди, который переходит в шлак: 2 [Си] + (FeS) = (Cu2S) + Fe. При этом возрастает содержание в металле серы, определяемое значением коэффициента распределения серы Таким образом, уменьшение содержания меди при этом методе обработки сопровождается повышением содержания серы, вследствие чего полученный после операции декупрации (удаления меди) металл должен подвергаться обессеривающей обработке. Упомянутый способ на практике пока не используют, и задача разработки рациональной технологии декупрации остается нерешенной. Не менее сложной задачей является организация удаления таких примесей, как As, Sn, Sb и др. Одним из перспективных путей является организация продувки металла порошками (например, на основе извести и плавикового шпата) в струе кислорода. Интерес представляет способ рафинирования стали от примесей цветных металлов, основанный на использовании их испарения в вакууме. Возможность и интенсивность испарения определяются давлением пара примеси /' над раствором Pi=PºiXiYi, где Pºi — давление пара чистого элемента; xtи у/ — мольная доля и коэффициент активности элемента в расплаве. Значение давления пара колеблется в широких пределах. Например, давление пара железа 13,3, марганца 2600, а цинка 5,3 • 106 Па. По возрастанию давления пара чистые элементы (при 1600° С) можно расположить в следующем порядке: W, Та, Mo, Zr, В, V, Ti, Со, Fe, Ni, Si, Cr, Cu, Al, Be, Sn, Mn, Pb, Sb, Bi, Mg, Zn. Отсюда следует, что при выдержке металла под пониженным давлением можно достичь уменьшения содержания (вследствие испарения) таких трудноудаляемых примесей, как Си, Sn, Pb, Bi и др. Действительно, удаление этих примесей происходит (например, при вакуумном переплаве). Обычно концентрации примесей цветных металлов невелики, поэтому парциальные давления пара р/ очень малы. Соответственно для испарения необходимо обеспечить глубокий вакуум и длительную выдержку, что при массовом производстве затруднительно. Однако и в случае обработки глубоким вакуумом больших масс металла при его внепечной обработке какое-то количество примесей цветных металлов удаляется вследствие их испарения, особенно при дополнительном перемешивании расплава. В целом же проблема рафинирования стали от примесей цветных металлов еще ждет своего решения. 12. ГАЗЫ В СТАЛИ В любой стали в некоторых количествах содержатся элементы, в обычных условиях являющиеся газами. К ним в первую очередь относятся кислород, азот и водород, в значительной степени влияющие на качество стали. Процесс, в результате которого газы оказываются в металле в атомарном, ионном состоянии или в виде химических соединений, в металлургической практике обычно называют процессом растворения газов в металле. Условно в этом процессе можно выделить несколько стадий: 1) массоперенос газа к поверхности металла; 2) адсорбция газа на поверхности металла; 3) переход через границу газ—металл; 4) диффузия газа в тонком неперемешиваемом (диффузионном) слое жидкости; 5) массоперенос в толщу металла. Лимитирующей стадией процесса растворения газов в металле, как правило, является либо внешняя диффузия (подвод газа), либо внутренняя диффузия (массоперенос в металле). Иногда лимитирующим является ад-сорбционно-кинетическое звено (адсорбция на поверхности и переход через граничный слой). Чаще лимитирует процесс растворения газов внутри-диффузионная составляющая, однако кроме железа и растворяющегося газа в металле всегда содержится большее или меньшее количество примесей. Если поверхностная активность третьего компонента достаточна, он может существенно влиять на интенсивность перехода газа через границу газ—металл. Обычно под растворимостью газа понимают его количество, перешедшее в раствор в металле при нормальном парциальном давлении газа. Растворимость газов в металле сильно зависит от температуры. В соответствии с уравнением изобары Вант-Гоффа зависимость растворимости газа sot температуры может определяться следующим уравнением: S= Сехр(-ΔH5/2RT), где С—постоянная интегрированная; ΔH 5 — изменение энтальпии при растворении и образовании раствора данного газа; R — универсальная газовая постоянная; T—температура. С учетом логарифмической формы этого уравнения lnS=lnC-bHs/2RT= =C-bHs/2RT*1/T изменение растворимости газов графически удобно представлять в координатах InS— (1/T). В прямоугольных координатах зависимость InSот 1/Т обычно представляет собой прямую линию. В общем случае ΔHS одновременно зависит от изменения: 1) энтальпии диссоциации этого газа у поверхности металла ΔH дис; 2) энтальпии растворения ΔH раст; 3) энтальпии взаимодействия, которое может иметь место между растворяющимся газом и растворенными в железе примесями ΔH В3. В результате ∑ ΔH S= ΔH дис + ΔH раст+ ΔH В3 В зависимости от суммарного (результирующего) изменения энтальпии ДЯ5 растворимость газов повышается или понижается с повышением температуры металла (рис. 12.1). В случае растворения в чистом железе двухатомных газов установлена четкая связь между парциальным давлением р этих газов в атмосфере над распла вом и растворимостью газа в металле:S=K 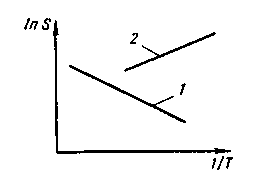 Рис. 12.1. Влияние температуры на растворимость газов S: 1 — увеличение растворимости; 2— уменьшение растворимости Это соотношение называют законом квадратного корня или законом Сивертса (по имени ученого, установившего это соотношение). Согласно этому закону в процессе растворения двухатомные молекулы диссоциируют на атомы, например H2(г) → 2[Н], при этом константа равновесия Кн=[Н]2/рН2, [Н]= Для реакции N2(г)→ 2[H] КN=[N]2/PN2, [N]=К" Если при растворении водорода или азота в металле образуются соединения, содержащие более одного атома газа (например, ZrH2, TiH2, Si3N4 и т. п.), то закон квадратного корня недействителен. Однако такие случаи являются исключением; они чаще всего имеют место в конце плавки, после того как в металл вводят такие добавки, как цирконий, титан и др. Обычно по ходу плавки металл не содержит значительного количества гидридо- или нитридообразующих примесей; в заметных количествах содержится лишь углерод, а для железоуглеродистого расплава закон квадратного корня по водороду и азоту выполняется. В тех случаях, когда растворы газов в сплавах далеки от идеальных и связи между растворяющимися газами и железом и его примесями настолько сильны, что образуются достаточно прочные соединения (гидриды, нитриды, оксиды), соединения эти имеют общее название неметаллические 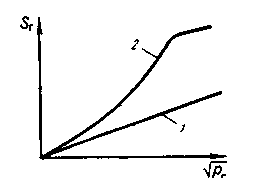 Рис. 12.2. Изменение растворимости (поглощения) газов в металле при образовании раствора (1) и химического соединения (2) включения. Характер зависимости растворимости от давления газа Sr=f(pr) различен в случаях образования раствора, близкого к идеальному, или химического соединения. При образовании соединения на кривой растворимости Sr — prнаблюдается перелом (рис. 12.2). 12.1. РАСТВОРЕНИЕ ВОДОРОДА На основании данных об изменении растворимости водорода в железе (рис. 12.3) можно сделать следующие выводы: 1) растворимость водорода возрастает при повышении температуры и уменьшается при ее снижении; 2) растворимость в различных модификациях железа неодинакова; 3) при переходе железа из жидкого состояния в твердое и из одного аллотропического состояния в другое растворимость изменяется скачкообразно. В реальных производственных условиях чистый водород Н2 в атмосфере практически отсутствует, но всегда имеется какое-то количество паров Н2О в атмосфере и влаги в шихтовых и добавочных материалах. Экспериментально установлено, что содержание водорода в металле по ходу плавки зависит от парциального давления Н2О в атмосфере: [H]=К' Водород в жидком железе находится в виде протона Н+, т. е. в виде частиц очень малых размеров. Скорость миграции таких частиц в расплавленном железе очень велика. В жидком металле скорость растворения водорода выше, чем в твердом. В твердом состоянии проницаемость металлов для газов определяется кристаллической структурой металла. Например, 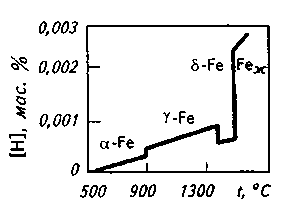 Рис. 12.3. Растворимость водорода в жидком железе более проницаемо для водорода, чем По влиянию на растворимость водорода в жидком железе элементы-примеси металла можно разделить на три группы: 1) повышающие растворимость водорода (титан, неодим, цирконий, торий, церий, лантан, ванадий (до 6 %)) и образующие с водородом соединения, прочные при низкой температуре; 2) снижающие растворимость водорода 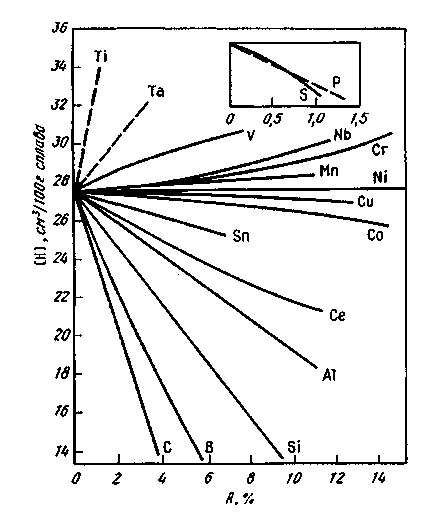 |
