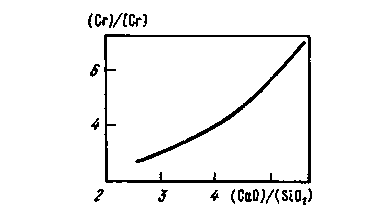|
|
Теория и технология производства стали 1. Учебник для вузов. М. Мир, ООО Издательство act
11.6.7. Удаление серы в газовую фазу. Некоторое количество содержащейся в металле серы в процессе плавки может быть окислено и удалено в газовую фазу. Окисление серы может идти по следующим реакциям:
1) между серой и кислородом, растворенными в металле:
[S] + 2[0] = S02(r);
2) между оксидами железа шлака и серой в шлаке
(S) + 2(FeO) - S02(r) + 2Fеж;
3) на поверхности шлака при взаимодействии с окислительной газовой фазой
(S) + 02 (r) = S02(r);
4) в случае проникновения кислородной струи в глубь металла
[S] + 02(г) = S02(r).
Большого развития эти реакции не получают. В расчетах обычно принимают, что 5—10 % серы от исходного ее содержания в шихте переходит в газовую фазу. В тех случаях, когда в газовой фазе также содержится сера (обычно в результате использования сернистого топлива), может иметь место не удаление, а поглощение ванной серы. Сера может удаляться в газовую фазу также в вакууме (в результате ее испарения). Однако процесс идет очень медленно и может быть ускорен при содержании в расплаве компонентов, повышающих активность серы (углерод, кремний). В газовой фазе в этих случаях обнаруживаются соединения типа CS, COS, CS2, SiS. Однако и при достаточно высоких концентрациях углерода и кремния процесс удаления серы в газовую фазу идет медленно (рис. 11.16), поэтому влиянием его при проведении ориентировочных расчетов можно пренебречь.
11.6.8. Скачивание шлака. Помимо ПОВЫШеНИЯ a (СаО) и снижения a (Feo) существенное значение при десульфурации имеет снижение активности серы в шлаке. Это достигается повышением основности шлака и обновлением шлака. Скачивание шлака, содержащего серу, и наведение нового шлака при помощи чистых от серы добавок (прежде всего СаО) существенно снижают содержание серы в шлаке, и при сохранении постоянства отношения 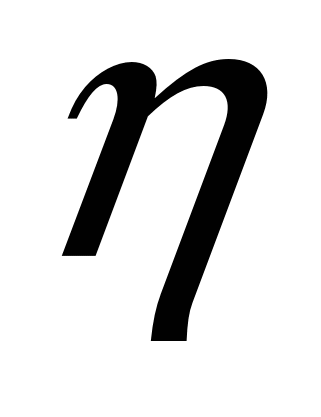 s=(S)/[S] s=(S)/[S]
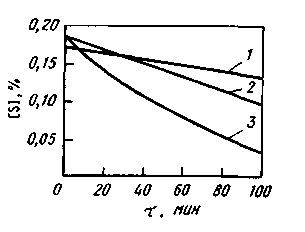
Рис. 11.16. Влияние содержания углерода и
кремния на удаление серы из железа при
плавке в вакууме:
1 — чистое железо; 2— 1,3% С; 3— 1,0% Si
содержание серы в металле [S] соответственно уменьшается. Скорость перехода серы из металла в шлак в данном случае определяется скоростью диффузии, поэтому роль температуры металла и перемешивания ванны возрастает. Если условия не позволяют организовать скачивание шлака, то приходится при помощи введения в шлак не содержащих серу материалов (прежде всего СаО) увеличивать количество шлака и тем самым снижать концентрацию серы в шлаке и ее активность.
Таким образом, основными условиями, необходимыми для успешного проведения операции десульфурации, являются: 1) высокая активность СаО в шлаке; 2) низкая активность оксидов железа в шлаке; 3) низкая активность кислорода в металле (раскислен-ность металла); 4) малая активность (низкое содержание) серы в шлаке; 5) высокая температура; 6) большая площадь контакта металла с десульфу-рирующим шлаком. На практике для обеспечения этих условий используют следующие технологические приемы:
1. Вводят добавки извести (СаО) или известняка (СаСО3).
2. Для получения активного жидко-подвижного шлака и повышения тем самым активности СаО в шлак вводят добавки (А12О3, CaF2, MnO и др.), снижающие его вязкость. Эти добавки ускоряют протекание процесса ошлако-вания введенных кусков извести.
3. Проводят обновление шлака (скачивание его с последующим наведением нового шлака, не содержащего серы).
4. Стремятся использовать для десульфурации те периоды плавки, в которые металл максимально нагрет (при высокой температуре ванны энергично окисляется углерод, получает развитие реакция [С] + (FeO) = СО + Fеж и активность оксидов железа в шлаке понижается, при этом улучшаются условия перемешивания металла со шлаком; при высокой температуре ванны ускоряются процессы ошлакования извести и увеличивается a(СаО) при высокой температуре возрастает интенсивность диффузионных процессов и облегчаются условия диффузии серы из объема металла к поверхности контакта со шлаком).
5. Металл обрабатывают жидкими или твердыми синтетическими шлаками и шлаковыми смесями с высокойa(СаО) и низкой a (Feo)
6. Когда хотят получить сталь с особо низким содержанием серы, вдувают в металл в струе инертного газа высокоосновные шлаковые смеси (СаО + CaF2), а в особых случаях — такие компоненты, как карбид кальция СаС2, или другие сплавы, содержащие кальций, или даже чистый кальций.
7. Используют для десульфурации РЗМ (церий, лантан, неодим и др.).
8. В тех случаях, когда содержание серы в металле должно быть возможно более низким, шихту для плавки специально отбирают, а иногда используют предварительно специально выплавленную чистую (по содержанию серы) шихту (так называемую «шихтовую болванку»).
11.6.9. Роль марганца. Марганец играет особую роль в борьбе с вредным влиянием серы.
Роль марганца в десульфурации проявляется на разных стадиях:
1. При транспортировке чугуна от доменного цеха к сталеплавильному и при выдержке чугуна в миксере определенное развитие получает реакция [Mn] + [S] = (MnS).
2. Марганец, содержащийся в чугуне, быстро окисляется (с выделением тепла), и образующийся при этом оксид марганца МпО ускоряет ошлако-вание кусков извести и в целом ускоряет процесс шлакообразования. Если в чугуне содержится марганец, то в сталеплавильном агрегате в составе шлака всегда имеется МпО; при подаче на шлак струи кислорода МпО окисляется до гаусманита Мп3О4. При взаимодействии Мп3О4 с СаО образуются легкоплавкие соединения и процесс шлакообразования ускоряется. Ускорение шлакообразования ускоряет процесс удаления серы в шлак.
3. Образующийся при окислении марганца МпО непосредственно принимает участие в десульфурации: (МпО) + (FeS) = (MnS) + (FeO).
4. Содержащийся в металле марганец также влияет на процесс десульфурации до момента затвердевания слитка (рис. 11.17).
Практически в готовой стали в большинстве случаев содержится 0,4— 0,8 % Мп, и этот марганец активно взаимодействует с сульфидами железа:
(FeS) + [Мп] = (MnS) + Fеж.
Химическое сродство марганца к сере при понижении температуры возрастает, и постепенно (по мере охлаждения металла и кристаллизации слитка) большая часть серы переходит из FeS в MnS (см. рис. 11.17). При температуре прокатки углеродистой стали (
1100°С) уже при 0,2% Мп около 95 % серы связано в сульфиды марганца. Сульфид MnS имеет температуру плавления, существенно более высокую, чем у сульфида FeS (1610 °С), и при содержании в металле > 0,3 % Мп легкоплавкая сульфидная пленка на границах зерен не образуется
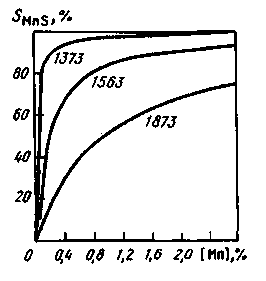
Рис. 11.17. Зависимость доли серы, связанной в MnS, от содержания марганца [Мп]
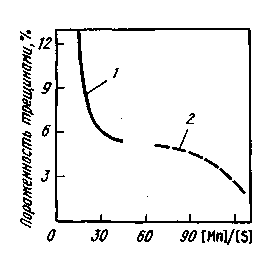
Рис. 11.18. Влияние отношения [Mn]/[S] в готовой стали (1 — Зсп, 2— 17Г1С-У) на пораженность непрерывнолитых заготовок трещинами
Способность марганца уменьшать вредное влияние серы иллюстрирует рис. 11.18. Однако введение марганца не исключает полностью вредного влияния серы на свойства металла. Хрупкие включения MnS, расположенные по границам зерен металла, снижают его пластические свойства и ударную вязкость.
11.7. ОКИСЛЕНИЕ И
ВОССТАНОВЛЕНИЕ ХРОМА
Хром является одним из наиболее распространенных элементов, используемых для легирования стали (для повышения прочностных свойств, получения жаропрочных, коррозионно-стойких сталей и др.). Чистый хром имеет кристаллическую решетку объемно-центрированного куба, следовательно, является изоморфным   -Fe. Свойства раствора хрома в железе близки к свойствам идеального раствора. В условиях окислительной плавки хром может окисляться с выделением тепла. Хром образует оксиды СгО, Сг2О3, СгО3. В условиях кислого процесса (кислый шлак) окисление хрома происходит до оксида СгО, в основном процессе —до Сг2О3. На активность Сг2О3 в основном шлаке влияют все основные оксиды (FeO, СаО, MgO), так как в основных шлаках могут образовываться хромиты железа (FeCr2O4), кальция, магния. Для характеристики степени окисления хрома и перехода его в шлак обычно используют коэффициент распределения хрома (Сг)/[Сг]. Чем выше значение отношения (Сг)/[Сг], тем выше степень окисления хрома. И для кислых, и для основных шлаков степень окисления хрома зависит от окисленности шлака, но характер этой зависимости различен. Для кислых шлаков: [Сг] + (FeO) = (СгО) + Fеж, К'= (СгО)/[Сг] • a (FеО), откуда (СгО)/ [Сг] = -Fe. Свойства раствора хрома в железе близки к свойствам идеального раствора. В условиях окислительной плавки хром может окисляться с выделением тепла. Хром образует оксиды СгО, Сг2О3, СгО3. В условиях кислого процесса (кислый шлак) окисление хрома происходит до оксида СгО, в основном процессе —до Сг2О3. На активность Сг2О3 в основном шлаке влияют все основные оксиды (FeO, СаО, MgO), так как в основных шлаках могут образовываться хромиты железа (FeCr2O4), кальция, магния. Для характеристики степени окисления хрома и перехода его в шлак обычно используют коэффициент распределения хрома (Сг)/[Сг]. Чем выше значение отношения (Сг)/[Сг], тем выше степень окисления хрома. И для кислых, и для основных шлаков степень окисления хрома зависит от окисленности шлака, но характер этой зависимости различен. Для кислых шлаков: [Сг] + (FeO) = (СгО) + Fеж, К'= (СгО)/[Сг] • a (FеО), откуда (СгО)/ [Сг] =  К • a (FeO), и практически рассматривается соотношение (Сг)/[Сг]. Для основных шлаков: 2 [Сг] + 3 (FeO) =(Сг2О3) + К • a (FeO), и практически рассматривается соотношение (Сг)/[Сг]. Для основных шлаков: 2 [Сг] + 3 (FeO) =(Сг2О3) +
+ ЗFеж, К "=(Cr203)/[Cr]2.a (3Fe0), откуда , (Cr)/[Cr]2= К "-a (3Fe0); величина (Сг)/[Сг]2 зависит от a (3Fe0); В основных шлаках оксид Сг2О3, обладающий кислотными свойствами, взаимодействует с оксидами железа, в результате образуется хромит FeO • Сг2О3 (или FeCr2O4). При повышении основности увеличиваются потери хрома в шлаке (рис. 11.19). При основности шлака
CaO/SiO2 < 3 для реакции
2[Сг] + 3(FeO) = (Cr2O3) + ЗFеж
ΔGº=-367,88 + 0,71 T кДж/моль.
Значения и знаки коэффициентов свидетельствуют о возможности восстановления хрома при повышении температуры. Действительно, в условиях сталеплавильных агрегатов легко добиться восстановления хрома. В тех случаях, когда выплавляют хромистые стали и в шихте содержится какое-то количество хрома, его стремятся использовать. Восстановление хрома из
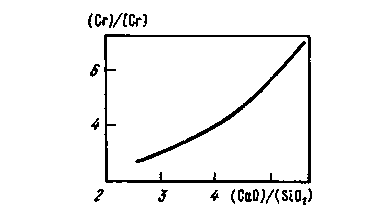
Рис. 11.19. Зависимость коэффициента распределения хрома (Сг)/[Сг] при плавке в мартеновских печах от основности шлака (CaO)/(SiO2) (температура металла 1550-1650 º С)
шлака может быть обеспечено при раскислении шлака (например, ферросилицием). При этом уменьшается окисленность шлака и разрушаются хромиты. Однако раскисление шлака допустимо лишь в тех случаях, когда в шлаке мало фосфора, так как при раскислении фосфор, ранее перешедший в шлак, восстанавливается и переходит в металл. Температура плавления Сг2О3 превышает 2000 ºС, и в начальный период плавки (невысокие температуры) окисление содержащегося в шихте хрома и обогащение шлака таким тугоплавким оксидом, как Сг2О3, могут привести к получению очень вязких шлаков; это обстоятельство необходимо учитывать.
Для многих высокохромистых сталей (например, стойкой против коррозии)' или сплавов важное значение имеет получение низкого содержания углерода. Окисление углерода возможно при высоком окислительном потенциале, при котором происходят также интенсивное окисление хрома и переход его в шлак. Для предотвращения окисления хрома необходимо иметь в ванне очень высокие температуры. В присутствии углерода при высоких температурах протекают реакции
FeO • Сг203 + 4[С] = Fеж + 2[Сг] + 4СОГ;
(СгО) + [С] = [Сг] + СОГ;
К=(Сr]-Рсо/(СrО)*[С],
откуда [Сг]=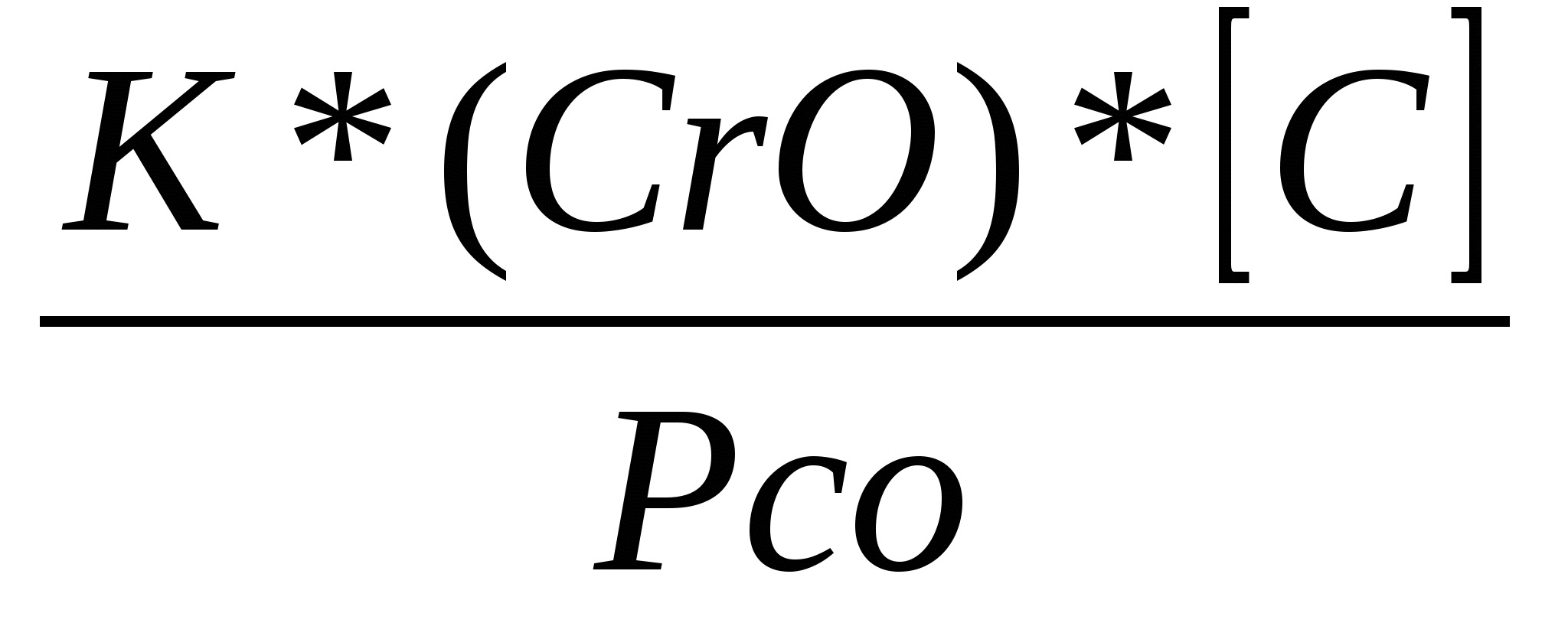 т.е. понижение давления рсосдвигает равновесие реакции вправо, окисляется углерод и восстанавливается хром (рис. 11.20). Снижение рсодостигается при обработке металла вакуумом или при продувке металла смесью кислорода и инертного газа (при этом обеспечивается снижение парциального давления СО в пузырях газа). Уменьшение рсопозволяет получать в конвертерах высокохромистые сплавы с низким содержанием угле- т.е. понижение давления рсосдвигает равновесие реакции вправо, окисляется углерод и восстанавливается хром (рис. 11.20). Снижение рсодостигается при обработке металла вакуумом или при продувке металла смесью кислорода и инертного газа (при этом обеспечивается снижение парциального давления СО в пузырях газа). Уменьшение рсопозволяет получать в конвертерах высокохромистые сплавы с низким содержанием угле-
1 В соответствии с ОСТ 14-1-142—84 был установлен термин коррозионностойкая сталь; за рубежом часто используется термин stainlesssteel— нержавеющая сталь.
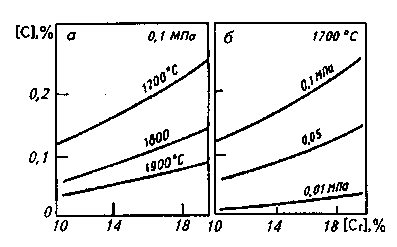
Рис. 11.20. Равновесные концентрации хрома и углерода в зависимости от температуры (а) и парциального давления СО (б) в системе Fe-C-Cr-O
рода без потерь хрома. На этом основаны широко применяемые в настоящее время способы вакуум-кислородного и аргоно-кислородного обезуглероживания.
11.8. ИСПАРЕНИЕ И ОКИСЛЕНИЕ ЖЕЛЕЗА ПОД ВОЗДЕЙСТВИЕМ КИСЛОРОДА
В мировой практике в настоящее время основное количество стали выплавляют в агрегатах, в которых роль окислителя выполняет кислород. Температура в зоне воздействия на металл струи кислорода составляет, по данным различных исследователей, 2200— 2800 °С. Воздействие на металлическую ванну струй кислорода сопровождается обильным выделением плавильной пыли, состоящей в основном из оксидов железа. Пыль эта имеет бурый цвет, поэтому выделяющиеся при продувке ванны кислородом образования обычно называют б у р ы м д ы м о м. В связи с трудностями экспериментирования (высокие температуры, высокие скорости движения газов и т. п.) законченной теории, описывающей характер и интенсивность образования бурого дыма, до настоящего времени еще нет. Однако установлен ряд общих закономерностей. Содержание плавильной пыли в выделяющихся при продувке металла газах колеблется в зависимости от условий продувки в широких пределах, достигая 50— 100 г/м3 и даже выше. Принято считать, что процесс образования бурого дыма происходит в две стадии: испарение железа в зоне продувки (мгновенная теоретическая температура на поверхности окисляющегося металла
4000 °С) и последующее окисление испарившегося железа кислородом газовой фазы. Интенсивность испарения определяется соотношением скоростей массообмена (скорости подвода кислорода к поверхности) и теплообмена (скорости отвода тепла с поверхности в глубь металла).
Установлено, что количество выносимой из зоны реакции пыли зависит от содержания в металле углерода и от интенсивности его окисления: чем выше скорость окисления углерода, тем больше образуется бурого дыма. Возможной причиной этого является эффект окисления в окислительной атмосфере остатков тонкой металлической пленки, окружающей пузырь СО, который выделяется из ванны при ее кипении.
Существуют также косвенные данные, свидетельствующие о том, что количество пыли возрастает вследствие образования брызг при кипении металла и окисления этих брызг кислородом в зоне продувки. При температуре
2000 °С значения парциальных давлений пара железа и FeO близки (рис. 11.21); возможно, что наряду с железом испаряются и его оксиды.
На процессы образования бурого дыма в значительной степени влияет вязкость металла и шлака. В зоне продувки происходит интенсивное перемешивание. Чем интенсивнее перемешивание,
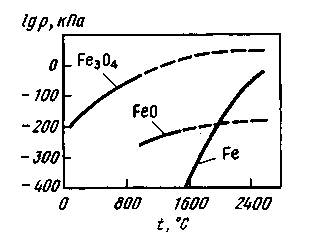
Рис. 11.21. Зависимость парциального давления паров железа и его оксидов от температуры
тем интенсивнее протекает конвективный перенос тепла, тем соответственно меньше перегрев металла на поверхности металл—кислород. Чем выше вязкость, тем хуже перемешивание в зоне продувки, тем ниже скорость отвода тепла с поверхности и тем сильнее дымообразование.
Угар металла при продувке кислородом может превышать 2 % от массы металла. Кроме того, приходится сооружать дорогостоящие устройства для улавливания образующейся пыли. Витающая над ванной пыль оказывает определенное (обычно отрицательное) воздействие на огнеупоры. Плавильная пыль в рабочем пространстве влияет также на оптические характеристики атмосферы агрегата. В зависимости от условий продувки размеры частиц пыли изменяются в широких пределах (1— 200 мкм). На унос пыли в значительной степени влияют условия продувки. Испарившиеся в зоне . высоких температур частицы могут конденсироваться в зонах менее высоких температур. Например, при погружении продувочного устройства в глубь ванны более крупные частицы пыли, проходя сквозь более холодные слои металла и шлака, конденсируются и остаются в ванне (изменяя соответственно состав металла и шлака). Мельчайшие частицы, витающие в пузыре газа, уходят вместе с газами из ванны. Крупные частицы оседают также и на футеровке агрегата.
Целесообразно различать понятия:
1) пылеобразование — количество пыли, выделяющейся из ванны в единицу времени; часть этой пыли возвращается в ванну, часть оседает на кладке, часть уносится потоком газов;
2) пылеунос — количество пыли, уносимой из агрегата в единицу времени; 3)запыленность — концентрация пыли в отходящих газах.
Для уменьшения пылеобразования и соответственно снижения угара металла и улучшения условий труда проводят следующие мероприятия: 1) охлаждают зону продувки, вводя с газообразным кислородом охладители (водяной пар, порошкообразные шлакообразующие материалы, пылевидную железную руду); 2) исключают возможность брызгообразования, используя многосопловые фурмы с рассредоточенной подачей дутья; 3) продувочные устройства вводят в глубь ванны и др.
|
|
|
 Скачать 7.23 Mb.
Скачать 7.23 Mb.