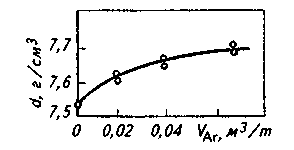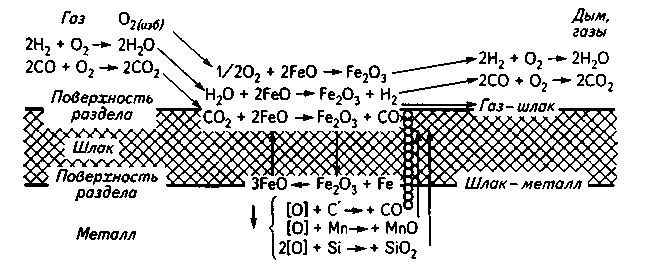|
|
Теория и технология производства стали 1. Учебник для вузов. М. Мир, ООО Издательство act
10.5. ВЛИЯНИЕ ПЕРЕМЕШИВАНИЯ
Установление наличия (или отсутствия) элементов структуры жидкой стали или микронеравновесности расплавленного металла для технолога важно еще и потому, что в этом случае возможное внешнее воздействие способно влиять на эту неравновесность. К числу таких внешних воздействий могут быть отнесены: перемешивание жидкого металла (продувка газами, вакуумно-пульсационное воздействие, электромагнитное перемешивание и т. п.), воздействие на металл ультразвуком, раздробление на мельчайшие капли и т. д. Наиболее распространенным из перечисленных способов является перемешивание жидкой стали инертным газом (обычно аргоном).
Можно предположить, что длительное перемешивание должно способствовать не только выравниванию состава и температуры, но и достижению микроравновесного состояния расплавленной стали. Не исключено, что приближение к равновесию микроскопических состояний расплава, т. е. повышение однородности его структуры ближнего порядка, вызовет изменение физических структурно-чувствительных свойств и улучшит качественные характеристики рафинированного таким образом металла.
Например, экспериментальные данные показывают, что продувка стали (особенно легированной) в ковше аргоном изменяет такие ее структурно-чувствительные свойства, как плотность (рис. 10.4), кинематическая вязкость (и энергия активации вязкого течения),
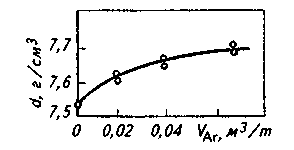
Рис. 10.4. Зависимость плотности стали 40Х
(испытания при комнатной температуре) от
расхода аргона при продувке (VAr)
поверхностное натяжение. Поверхностное натяжение образцов легированной стали, отобранных по ходу продувки металла аргоном в ковше, возрастает. Можно предположить, что уменьшение степени микронеоднородности расплава в результате интенсивного перемешивания при вне-печной обработке вызывает увеличение энергии взаимодействия его структурных единиц, что, в свою очередь, приводит к повышению поверхностного натяжения. Однако необходимы дальнейшие исследования для получения объективной характеристики явления. Пока отсутствует объективный практический критерий оценки степени перемешивания (часто ограничиваются внешней картиной перемешивания при моделировании или отбором проб на химический анализ и измерением температуры в нескольких точках конкретной емкости с металлом). В то же время получивший распространение термин «гомогенизация» расплава объединяет комплекс процессов, в том числе выравнивание химического состава и температуры, достижение равномерного распределения данного состава включений и газов в каждой единице объема металла, а в необходимых случаях рафинирование в процессе перемешивания металла от ряда определенных включений; к числу подобных явлений относится и ликвидация в процессе перемешивания микронеоднородности расплава.
10.6. СТРОЕНИЕ ЖИДКОЙ СТАЛИ И ТЕХНОЛОГИЯ
Теория жидкого состояния стали еще далека от совершенства, однако получено множество доказательств того, что изменения структуры жидкого металла (в зависимости от изменения его состава, степени перегрева и т. д.) должны учитываться при определении рациональной технологии плавки.
Современные исследования показывают, что структура жидкого расплава по ряду косвенных признаков подобна (в зависимости от степени перегрева и содержания углерода) структуре 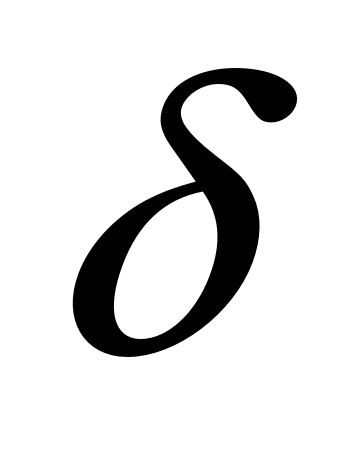 - или - или 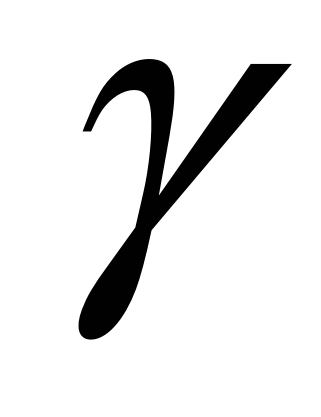 -Fe. Наличие -Fe. Наличие 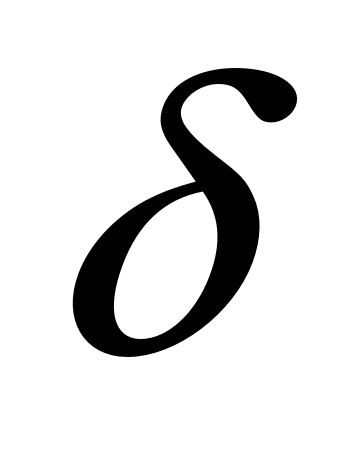 -подобной (более «рыхлой») структуры облегчает условия зарождения новой фазы, дегазации металла и т. п. Эксперименты показывают, что при ведении плавки, когда изменение состава металла и его температуры соответствует области более рыхлой структуры, получается сталь более высокого качества с меньшим количеством газов и включений. На структуру жидкого металла влияют добавки легирующих элементов (никеля, марганца, хрома и т. д.). Если легирующая добавка способствует разрыхлению структуры жидкого металла, то и условия ведения плавки изменяются (облегчается газовыделение и т. п.). Разрыхлению структуры расплава способствуют сравнительно небольшие добавки таких элементов, как никель, кобальт, медь (этим обеспечивается получение -подобной (более «рыхлой») структуры облегчает условия зарождения новой фазы, дегазации металла и т. п. Эксперименты показывают, что при ведении плавки, когда изменение состава металла и его температуры соответствует области более рыхлой структуры, получается сталь более высокого качества с меньшим количеством газов и включений. На структуру жидкого металла влияют добавки легирующих элементов (никеля, марганца, хрома и т. д.). Если легирующая добавка способствует разрыхлению структуры жидкого металла, то и условия ведения плавки изменяются (облегчается газовыделение и т. п.). Разрыхлению структуры расплава способствуют сравнительно небольшие добавки таких элементов, как никель, кобальт, медь (этим обеспечивается получение 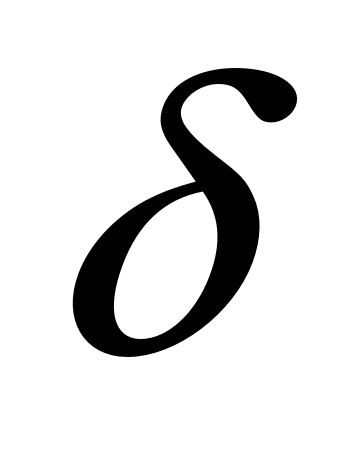 -подобной рыхлой структуры). При этом должны улучшаться условия газовыделения (облегчается образование пузырей газов: СО, Н2, N2) и соответственно должны изменяться и показатели качества металла. Например, если в стали содержится 1— 2 % Ni, то повышаются скорость окисления углерода и интенсивность дегазации, снижается брак стали и т. д. -подобной рыхлой структуры). При этом должны улучшаться условия газовыделения (облегчается образование пузырей газов: СО, Н2, N2) и соответственно должны изменяться и показатели качества металла. Например, если в стали содержится 1— 2 % Ni, то повышаются скорость окисления углерода и интенсивность дегазации, снижается брак стали и т. д.
Используя имеющиеся данные о зависимости структурно-чувствительных свойств жидкой стали от ее температуры и состава, можно составить диаграмму состояния сплавов на основе железа выше линии ликвидуса. На рис. 10.5 показаны варианты диаграмм состояния систем Fe-C и Fe-Ni, составленные Г. Н. Еланским. Линии выше ликвидуса на этих диаграммах не являются, по представлениям Г. Н. Еланского, показателем полиморфных превращений в жидких сплавах железа, но свидетельствуют о существовании зон с разными координационными числами (близким к структуре 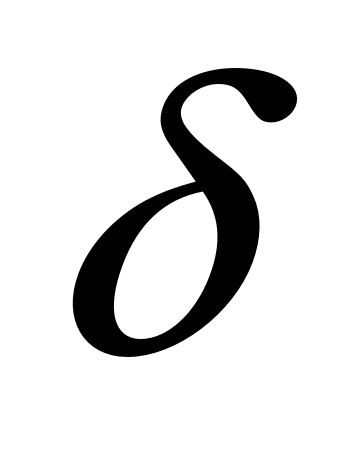 - или - или 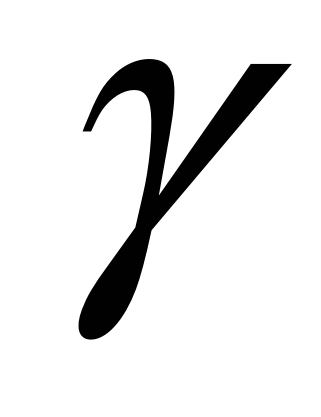 -Fe) и о том, что лишь при перегреве -Fe) и о том, что лишь при перегреве
250 °С осуществляется полный переход к структуре перегретых расплавов.
Используя имеющиеся данные о строении жидкой стали, можно также определить необходимую степень перегрева и продолжительность выдержки металла при этом перегреве для достижения полного разупорядочения расплава (термовременная обработка). В зависимости от состава расплава можно определять температурные области, в которых вследствие «разрыхления» структуры облегчается протекание процессов газовыделения (окисления углерода, дегазации стали), и учитывать возможное влияние строения жидкой стали (сплавов). При известных составе и температуре жидкой стали можно учитывать возможное влияние ее строения на вязкость, плотность, поверхностное натяжение и другие характеристики. В зависимости от области на диаграмме состояния, через которую проходит путь изменений состава и температуры сплава, можно прогнозировать получение тех или иных свойств после разливки и кристаллизации металла. Объем экспериментальных данных в этой области знаний недостаточно полный, однако по мере их накопления и по мере роста требований к качеству выплавляемого металла практическое использование диаграмм состояния будет более совершенным.
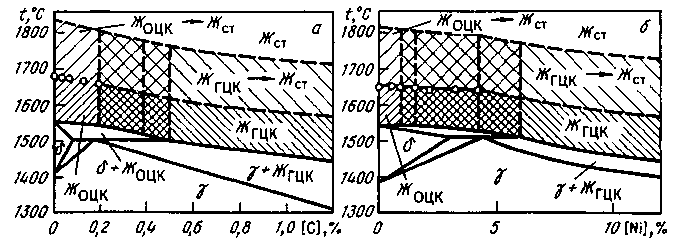
Рис. 10.5. Диаграммы состояния Fe-C (а) и Fe-Ni (б) выше линии ликвидуса (Жст — жидкость со статистической структурой перегретых расплавов)
11. ОСНОВНЫЕ РЕАКЦИИ СТАЛЕПЛАВИЛЬНЫХ ПРОЦЕССОВ
При рассмотрении вопросов, связанных с изучением химической термодинамики металлургических процессов, используют значения констант равновесия реакций, найденные в лабораторных условиях. В реальных сталеплавильных процессах полное состояние равновесия не может быть достигнуто. Это связано прежде всего с тем, что на сталеплавильную ванну непрерывно воздействует атмосфера агрегата (с обычно высоким окислительным потенциалом), а также (в меньшей мере) футеровка (подина, стены печи).
11.1. ВЛИЯНИЕ АТМОСФЕРЫ АГРЕГАТА
Атмосфера агрегата может иметь окислительный или восстановительный характер. Если атмосфера агрегата окислительная, то развитие получат окислительные процессы; в восстановительной атмосфере (как, например, в доменной печи) будут развиваться восстановительные процессы. Атмосфера агрегата может служить источником вредных примесей металла (водорода, азота, серы), попадание которых в ванну нежелательно. Так как в любом топливе (угле, мазуте, природном газе и т. п.) содержатся углерод и водород и при сжигании топлива образуются Н20, СО, СО2, в составе атмосферы (если в агрегат подают топливо) оказываются газы, содержащие кислород и водород. Если сжигаемое топливо содержит серу, то в газах она также будет присутствовать (обычно в виде SO2). При подаче в сталеплавильный агрегат атмосферного воздуха (для сжигания топлива или для продувки ванны) в газах содержится также и азот. Определенное количество (иногда до 1 %) азота всегда присутствует в газообразном кислороде, используемом для продувки ванны.
В большинстве сталеплавильных агрегатов атмосфера окислительная, т. е. имеет место непрерывный переход кислорода из атмосферы в металл. Это объясняется тем, что парциальное давление кислорода дутья, например, в конвертере >1ООкПа, в воздухе -20 кПа, в продуктах сгорания в рабочем пространстве подовых печей 1—10 кПа, а парциальное его давление, равновесное с кислородом, растворенным в металле, колеблется в зависимости от содержания углерода, температуры металла и других факторов от I0 -3 до 10 -5 Па. Таким образом, paO2/pO2равн=106 —107
Количество кислорода, перешедшего за время плавки в ванну, может быть значительным. Так, в мартеновских и электропечах (при использовании в них топливно-кислородных горелок) из атмосферы печи в металл переходит (и расходуется на окисление железа и примесей) в зависимости от типа процесса, состава шихтовых материалов и продолжительности плавки от 5 до 30 кг, а в кислородных конвертерах — от 50 до 80 кг кислорода на 1 т стали.
11.1.1. Переход кислорода из газо -вой фазы в металл. Передача кислорода из газовой фазы через шлак в металл может осуществляться следующим образом:
а) в результате непосредственного контакта окислительной фазы (О2, СО2, Н2О) с металлом, как это имеет место при продувке ванны воздухом или кислородом, а также в тех случаях, когда металл в печи не покрыт шлаком (при завалке шихты и в начале плавления, при интенсивном кипении, на выпуске, во время разливки и т.п.);
б) при помощи корольков (капель) металла, всегда в больших или меньших количествах имеющихся в шлаке: 1) корольки, окисляясь на поверхности контакта с газовой фазой, при перемешивании ванны попадают в металл и переносят кислород; 2) при интенсивном кипении заметная доля металла за время кипения успевает побывать в шлаке в виде корольков и окислиться, в результате чего соответствующим образом изменяется состав ванны;
в) вследствие перехода кислорода из газовой фазы в металл через шлак. Этот процесс состоит, по крайней мере, из трех звеньев: 1) «окисление» частиц шлака на поверхности газ-шлак; 2) перенос кислорода через слой шлака; 3) переход кислорода в металл на границе металл—шлак.
На границе атмосфера печи-шлак происходит окисление FeO шлака:
2(FeO)+{1/2О2 (или Н2О, или 1/2СО2)} →Fe203;
Оадс +2Fe2+ш +3О2-ш →2FеO -ш.
Например, отбор проб шлака из мартеновской печи на различных уровнях по высоте показывает, что в верхних слоях содержится больше Fe2O3 и меньше FeO, чем в нижних. В тех случаях, когда имеет место вспенивание шлака, различие в химическом составе шлака по высоте может быть значительным. Выравнивание состава шлака по высоте происходит в результате диффузии и перемешивания. На скорость этого процесса заметно влияет гетерогенность шлака. Поскольку коэффициент диффузии Dи вязкость шлака 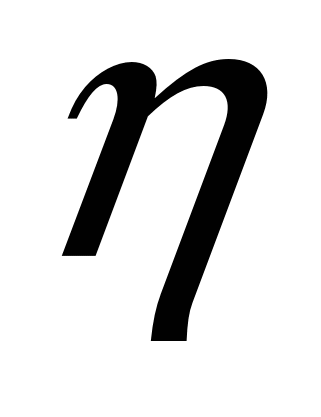 связаны соотношением D связаны соотношением D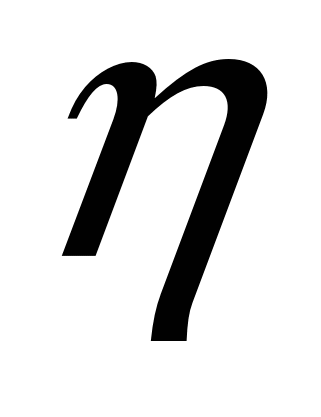
const, гетерогенность шлакового расплава тем больше, чем больше его вязкость 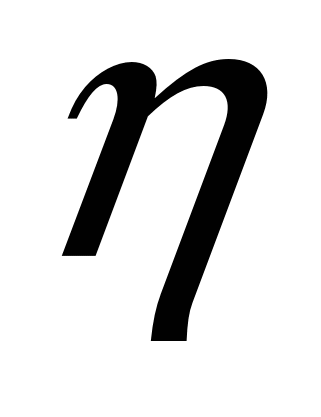 и, следовательно, меньше коэффициент диффузии Dи ниже скорость массопереноса оксидов железа в шлаковом слое. По мере снижения гетерогенности шлака вязкость его уменьшается и состав по высоте выравнивается. и, следовательно, меньше коэффициент диффузии Dи ниже скорость массопереноса оксидов железа в шлаковом слое. По мере снижения гетерогенности шлака вязкость его уменьшается и состав по высоте выравнивается.
Металл практически всегда содержит кислорода меньше, чем по условиям равновесия со шлаком. Этот градиент концентраций определяет переход кислорода через межфазную границу шлак—металл. Процесс переноса кислорода из шлака в металл обычно записывается в виде:
(Fe2O3)+Fe=3(FeO),
(FеО) → [О]+Fеж,
или
2FeO2 +Fe=3Fe2+ +4Oш2-,
Fеш2++Ош2- =[0]+Fеж.
Обобщенная схема передачи кислорода из окислительной атмосферы через шлак в металл представлена на рис. 11.1. Скорость процесса перехода кислорода из шлака через границу шлак—металл значительно выше, чем интенсивность обычной молекулярной диффузии в шлаке, и не лимитирует процесса передачи кислорода. Выравнивание этих скоростей происходит вследствие значительного ускорения диффузии в результате интенсивного перемешивания выделяющимися из металла газами при кипении ванны. Однако интенсивность снабжения металла кислородом через шлак значительно ниже, чем при непосредственном контакте между металлом и окислительной атмосферой. Этим, в частности, объясняются значительно более высокие скорости окисления примесей в конвертерных процессах, где окислитель вступает в контакт непосредственно с металлом. Интенсификация процессов окисления достигается также введением кусков руды в результате непосредственного контакта их с металлом.
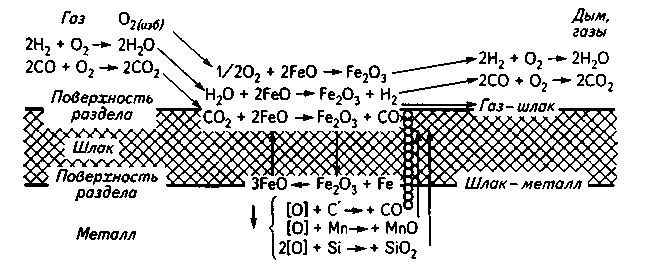
Рис. 11.1. Схема передачи кислорода из газовой фазы через шлак в металл 114
11.1.2. Продувка металла кислородом или воздухом. При продувке металла воздухом или кислородом в состав атмосферы агрегата входит также конгломерат пузырей О2, N2, CO и т.д., проходящих через ванну. При малой интенсивности продувки пузыри газа пронизывают толщу металла; по мере повышения интенсивности продувки капли металла оказываются взвешенными в потоке газа. В первом случае при невысокой температуре и повышенной вязкости металла через металл будут проходить крупные пузыри, запас кислорода в которых достаточен для окисления всех атомов железа и его примесей, находящихся на поверхности пузырей. При этом окисляется преимущественно железо, так как число атомов железа значительно больше общего числа атомов примесей (углерода, кремния, марганца и т. д.). По мере увеличения интенсивности продувки, повышения температуры металла и понижения его вязкости размеры пузырей, пронизывающих металл, могут уменьшиться настолько, что количество содержащегося в таком пузыре кислорода недостаточно для окисления атомов железа и его примесей, условно расположенных на поверхности такого пузыря. Такое состояние называют состоянием «кислородного голода».На основании расчетов установлено,что при радиусе пузырей10-2—10 -3 см кислородный голод уже наблюдается и окисление примесей происходит в соответствии с их химическим сродством к кислороду.
11.2. 0КИСЛЕНИЕ УГЛЕРОДА
Реакцию окисления углерода часто называют основной реакцией сталеплавильных процессов. При окислении (выгорании) углерода происходит так называемое кипение металла в результате выделения пузырей СО. В процессе кипения происходят перемешивание металла, выравнивание его химического состава и температуры, увеличивается площадь соприкосновения металла со шлаком, что, в свою очередь, ускоряет протекание всех процессов на границе шлак—металл, из металла удаляются газы и неметаллические включения. В большинстве случаев в сталеплавильных агрегатах подачу энергии к ванне (топливными горелками, электрической дугой и т. п.) осуществляют сверху и, если бы не кипение, нагрев глубинных слоев ванны был бы весьма затруднен. Углерод, растворенный в железе, принято обозначать [С].
|11.2.1.Продукты реакции. Углерод, растворенный в металле, окисляется в основном до СО. Однако при низких концентрациях углерода кроме реакции [С] + [О] = СОГ имеет место реакция [С] + 2[О] = СО2(Г). По расчетным данным, если при 0,2 % [С] в железе удельный вес реакции образования СО2 составляет всего 0,5%, то при 0,03 % [С] — 10 %. В большинстве случаев можно с достаточной для практических целей точностью считать, что углерод окисляется с образованием СО. Константа равновесия этой реакции Ксможет быть выражена формулой
Кс= рСО/(а[С] * а[0]) =
= Pco/([C]*f[C]* [0]*f[0]).
Значения коэффициента активности f[с] и f [О] до настоящего времени точно не определены. Но поскольку на практике обычно имеют дело с расплавами, содержащими малое (< 1 %) • количество углерода и очень малое (<0,1 %) количество кислорода, можно принимать значения/[с] и/[О] близкими к единице. Следовательно, Кс= рСО /([С]*[О]). При рСО =1 Кс =
= 1/([С] • [О]), или [С] • [О] = 1/Кс = т.
Произведение [С] • [О] при нормальном атмосферном давлении принимают обычно близким к значениям, определенным впервые Вачером и Гамильтоном (США) для 1620 ºС: т =[С] • [О] =0,0025. Полученные на практике значения [С] и [О] сравнивают обычно со значениями, определяемыми из равенства [С] -[О] = 0,0025.
|
|
|
 Скачать 7.23 Mb.
Скачать 7.23 Mb.