Теория и технология производства стали 1. Учебник для вузов. М. Мир, ООО Издательство act
 Скачать 7.23 Mb. Скачать 7.23 Mb.
|
|
13.3. ВЛИЯНИЕ ГАЗОВ И ВКЛЮЧЕНИЙ НА СВОЙСТВА СТАЛИ Газы и неметаллические включения, как правило, отрицательно влияют на качество металла. С вредным влиянием газов связаны такие дефекты, как подкорковые и внутренние пузыри (рис. 13.2), осевая пористость, пятнистая (или газовая) ликвация (рис. 13.3), волосовины, флокены (рис. 13.4) и др. С вредным влиянием неметаллических включений связаны такие дефекты, как точечная и точечно-пятнистая неоднородность, загрязнения и волосовины (рис. 13.5, 13.6), шиферный излом, камневидный излом и др. Многие дефекты связаны одновременно с присутствием и газов, и неметаллических включений, причем число и размеры дефектов возрастают при содержании в стали вредных примесей (серы, фосфора и др.), снижающих температуру плавления сплава. Это связано с развитием ликвационных  Рис. 13.2. Подкорковые и внутренние пузыри в подголовном темплете слитка явлений при кристаллизации слитка. Как известно, затвердевание сталей и сплавов происходит в некотором интервале температур (интервале затвердевания). Вначале затвердевают оси дендритов состава, имеющего более высокую температуру затвердевания; на заключительной стадии затвердевания в незакристаллизовавшихся участках остается жидкость, обогащенная легкоплавкими примесями, которая затвердевает в последнюю очередь. В этот момент в слитке формируется определенное дополнительное количество неметаллических включений. В период окончательного затвердевания из стали выделяется вследствие снижения растворимости некоторое количество газов. В связи с уменьшением растворимости газов при понижении температуры, особенно при переходе из жидкого состояния в твердое при кристаллизации слитка или отливки, сталь, содержащая большое количество газов, получается пузыристой, с низкими механическими свойствами и непригодной к использованию. Повышенные концентрации кислорода в спокойной стали могут вызвать образование пузырей вследствие реакций с углеродом [О] + [С] = СОГ. Кроме того, при высоких концентрациях кислорода в стали образуются значительные количества легкоплавких оксидных и оксисульфидных включений, застывающих по границам зерен, в результате чего понижается прочность металла при высоких температурах (красноломкость). Азот понижает пластические свойства стали, повышает хрупкость при низких температурах (хладноломкость),склонность стали к старению. Водород является причиной образования ряда дефектов стали (флокенов и т. д.). Эти дефекты связаны с выделением при застывании растворенного в металле атомарного водорода (в основном при температуре превращения y—> Выделение молекулярного водорода  Рис. 13.6. Неметаллические включения в зоне волосовины (микрошлиф стали 12Х18Н9Т) х 100. (и последующее разрушение сплошности металла) происходит в местах скопления неметаллических включений, микропор, ликватов и т. д. На практике используют способность водорода интенсивно диффундировать, особенно при повышенных температурах. Флокеночувствительные стали подвергают замедленному охлаждению (обычно после прокатки на обжимных станах и порезки на мерные длины); стальные заготовки часами (иногда сутками) находятся в специальных пролетах в емкостях (ямах), где штабеля металла, засыпанные слоем изолирующего щебня, медленно охлаждаются, а растворенный водород диффундирует к поверхности заготовки и удаляется. Однако снизить до безопасного уровня содержание водорода таким способом удается далеко не всегда (особенно при отливке крупных слитков), поэтому для качественной стали такие операции, как обработка вакуумом или продувка инертным газом, являются обязательными. Обработка металла вакуумом во многих случаях позволяет вообще отказаться от дорогостоящей противо-флокенной обработки замедленным охлаждением. Повышенное содержание газов в стали вызывает не только понижение ее механических свойств, но и непостоянство механических свойств образцов металла, взятых из разных участков слитка; «пятнистую» ликвацию, трещины, расположенные внутри заготовки и обнаруживаемые при ступенчатой обточке (так называемые волосовины), дефектные виды излома и т. д. Некоторое количество растворенных в металле газов при кристаллизации выделяется в виде пузырей, часть которых остается в слитке. На межфазной границе металл—газовый пузырь могут концентрироваться неметаллические включения. Этому способствует лучшая смачиваемость включением газовой фазы, чем металла. В результате вокруг газового пузыря обнаруживается повышенная концентрация включений, что особенно заметно ухудшает качество металла. Неметаллические включения ухудшают механические и другие свойства стали (магнитную проницаемость, электрическую проводимость и т. п.), так как нарушают сплошность металла и образуют полости, которые являются концентраторами напряжения. Хотя отрицательное влияние большого содержания включений известно, очень многое зависит от размеров включений, состава и расположения их в готовом изделии. При этом небольшое содержание включений в стали еще не является гарантией высокого качества. При общем малом количестве включений в отдельных местах слитка или отливки возможны их скопления. Особенно опасными для качества стали являются включения, расположенные по границам зерен в виде тонких пленок. Большую опасность представляют также включения, имеющие острые грани; обычно это тугоплавкие включения, температура плавления которых выше температуры жидкого металла. Эти включения часто являются местом концентрации напряжений в металле и источником начала процесса разрушения изделия. В случае, когда такое включение оказывается на поверхности изделия (например, шарика в подшипнике, железнодорожного рельса и т. д.), возможно выкрошивание включения с последующим преждевременным выходом изделия из строя. Включения округлой формы, считающиеся менее вредными, образуются в том случае, если температура плавления их невелика и они плохо смачиваются металлом. Менее вредны также включения в виде расположенных равномерно по сечению металла субмикроскопических частиц. В некоторых случаях даже принимают специальные меры к тому, чтобы такие очень мелкие включения (например, включения нитридов и карбо-нитридов в термоупрочняемых сталях) образовались. Подобные включения образуются при введении в металл элементов с высоким химическим сродством к таким примесям, как кислород, сера, азот, углерод, в случае получения при этом тугоплавких соединений (при введении в отдельных случаях алюминия, РЗМ, вольфрама, титана и др.). Большое значение имеет изменение состава и количества включений при кристаллизации и охлаждении слитка. Во время прокатки или ковки форма включений, их размеры и распределение также могут существенно изменяться. Одни включения при кристаллизации могут выделиться по границам зерен, другие — внутри зерен; некоторые при обработке давлением дробятся и образуют цепочку вдоль оси прокатки, другие вытягиваются, третьи не изменяют своих размеров и т. д. В результате оказывается, что видимая (под микроскопом) чистота стали по включениям зависит не только от их содержания, но и от степени обжатия при прокатке и т. п. Механические свойства металла при испытании образцов, вырезанных вдоль (продольные образцы) и поперек (поперечные образцы) оси прокатки, различаются и зависят от включений. Содержание неметаллических включений особенно заметно влияет на показатели испытаний поперечных образцов. Допустимые пределы содержания газов и неметаллических включений в каждой группе марок сталей определяются соответствующими стандартами. Стандарт определяет также методику отбора проб и методику проведения анализа и контроля. 14. РАСКИСЛЕНИЕ И ЛЕГИРОВАНИЕ СТАЛИ Окислительные условия ведения плавки в сталеплавильных агрегатах, наличие окислительных шлаков, а также взаимодействие металла с атмосферой при выпуске и разливке — все это является предпосылкой к тому, что кислород, растворенный в стали, к моменту ее выпуска из агрегата имеет определенную и часто повышенную активность. Технологическую операцию, обеспечивающую снижение активности кислорода до необходимых пределов, называют раскислением. Сталь, прошедшую такую обработку, называют раскисленной. Если раскисленная сталь при затвердевании в изложницах ведет себя спокойно, т. е. из нее почти не выделяются газы, то такую сталь называют спокойной. Если раскисление не проводить, то в стали при ее постепенном охлаждении в изложнице будет протекать реакция между растворенным кислородом и углеродом металла: [О] + [С] = СОГ. Образующиеся при этом пузыри монооксида углерода, выделяясь из кристаллизующегося слитка, приводят к тому, что металл в изложнице интенсивно перемешивается, поверхность его бурлит. Такую сталь называют кипящей. Иногда при раскислении из стали удаляют не весь кислород. Оставшийся растворенный кислород вызывает кратковременное кипение металла. Такую сталь называют полуспокойной. Достигнутый при раскислении уровень активности (концентрации) кислорода называют степенью раскислен-ности. От степени раскисленности зависит структура стального слитка (рис. 14.1). На рис. 14.2 приведены кривые, характеризующие уровень окисленности стали после ее раскисления. Согласно этой схеме раскисление кипящей стали сводится лишь к некоторому снижению содержания кислорода в металле (уровень окисленности металла остается выше равновесного с углеродом). Чаще всего это обеспечивается введением некоторого количества марганца (иногда в металл вводят также небольшие количества кремния и алюминия). Обычно в кипящей стали содержится 0,3—0,4 % Мп. При рас- 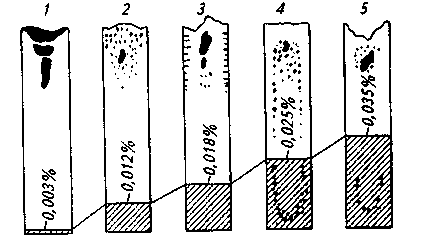 Рис. 14.1. Схематическая структура спокойного (/), полуспокойного (2), закупоренного (J) и кипящего (4, 5) слитков. Цифры у линий — концентрация кислорода в стали 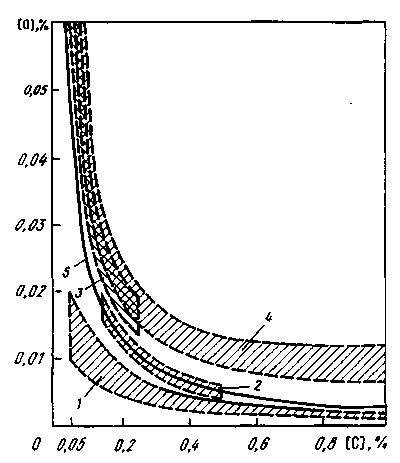 Рис. 14.2. Уровень окисленности стали после ее раскисления: 1, 2, 3— при производстве соответственно спокойной, полуспокойной и кипящей стали; 4— область обычного содержания кислорода в металле перед раскислением; 5— кривая равновесия с углеродом кислении полуспокойной стали обеспечивается снижение окисленности металла до уровня, примерно соответствующего равновесному с углеродом. Чаще всего это обеспечивается введением помимо марганца также определенного количества кремния. Обычно полуспокойная сталь содержит 0,4— 0,5% Мп и 0,08-0,12% Si. При раскислении спокойной стали уровень окисленности металла существенно ниже равновесного с углеродом. Таким образом, практически всю выплавляемую сталь подвергают раскислению в той или иной степени; при этом активность растворенного в металле кислорода снижается до требуемых пределов. Уменьшение активности кислорода в металле может осуществляться двумя способами: 1) уменьшением .содержания кислорода; 2) связыванием кислорода в прочные соединения. Существуют следующие способы раскисления стали: 1) глубинное, или осаждающее; 2) диффузионное; 3) обработкой синтетическими шлаками; 4) обработкой вакуумом; 5) электрохимическое. 14.1. ГЛУБИННОЕ, ИЛИ ОСАЖДАЮЩЕЕ, РАСКИСЛЕНИЕ Этот метод заключается в переводе растворенного в стали кислорода в нерастворимый оксид путем введения в металл определенного элемента-раскислителя. Элемент-раскислитель должен иметь большее химическое сродство к кислороду, чем железо. В результате реакции образуется малорастворимый в металле оксид, плотность которого меньше плотности стали. Поученный таким образом «осадок» всплывает в шлак (отсюда название метода «осаждающий»). Этот метод раскисления часто также называют «глубинным», так как раскис-лители вводят в глубину металла. В качестве раскислителей (табл. 14.1) обычно применяют марганец (в виде ферромарганца), кремний (в виде ферросилиция), алюминий, сплавы РЗМ (цезия, лантана и др.) и ЩЗМ. Раскисление осуществляется по следующим реакциям: [Мп] + [О] = (МпО), [Si] + 2[0] =(Si02), 2[А1] + 3[0]=А1203(ТВ), 2[Се] + 3[О] = Се2Оз(Тв) и т.д. Все эти реакции идут с выделением тепла. Равновесие реакции осаждающего раскисления сдвигается влево при повышении и вправо при понижении температуры. Практически это означает, что по мере понижения температуры стали (при ее кристаллизации в изложнице или в литейной форме) реакции раскисления продолжают идти и образуются все новые и новые количества оксидов, которые не успевают всплыть и удалиться из металла. В связи с этим при данном методе раскисления невозможно получить сталь, совершенно чистую от неметаллических включений, что является его недостатком. Однако этот метод получил широкое распространение как наиболее простой и дешевый. При введении в металл элемента-раскислителя активность растворенного в металле кислорода уменьшается. Активность кислорода, соответ ствующая определенной концентрации Таблица 14.1. Состав ферросплавов некоторых марок
элемента-раскислителя, при которой он находится в равновесии с кислородом при данной температуре, называется раскислительной способностью элемента-раскислителя. При изменении температуры раскислитель-ная способность изменяется, иногда очень существенно. Обычно сравнение элементов-раскислителей по их раскислительным способностям проводят при 1600 °С. В общем случае реакция глубинного, или осаждающего, раскисления имеет вид m[R] + п[0] = (RmOn), K=a(RmOn)/(a[R ]т a [ 0]n где R— условное обозначение элемента-раскислителя. При раскислении обычно имеют дело с очень малыми значениями концентраций элемента-раскислителя [R]и кислорода [О], поэтому a[R] Если в результате реакции образуется чистый оксид RmOn, то a[RmOn] =1 и К= l/[R]m • [О]" или К'= [R] т- [О]n. Значения произведения равновесных концентраций раскислителя и кислорода удобны для сравнения раскислительной способности используемых элементов. Графически эти соотношения часто представляют в логарифмических или полулогарифмических координатах (рис. 14.3). Если К'= = [R]m • [О]n, то lgK'=mlg[R] + nlg[0], откуда nlg[0]=lgK'-mlg[K],  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
