Болезни рыб и основы рыбоводства. Учебники и учебные пособия для студентов высших учебных заведений
 Скачать 4.89 Mb. Скачать 4.89 Mb.
|
|
ТИПОВЫЕ ПАТОЛОГИЧЕСКИЕ ПРОЦЕССЫ И КОМПЕНСАТОРНО- ПРИСПОСОБИТЕЛЬНЫЕ РЕАКЦИИ РЫБ При рассмотрении особенностей болезней рыб в первую очередь следует иметь в виду, что любое заболевание складывается из взаимодействия двух противоположных процессов: патогенного действия на организм специфического возбудителя или других этиологических факторов и компенсаторно-приспособительных процессов организма, направленных на восстановление нарушенных функций органов и систем и сохранение гомеостаза организма. При разных группах болезней рыб наблюдаются определенные соотношения этих процессов, что позволяет отнести их к типовым, т. е. к таким, которые наблюдаются практически при всех болезнях, но проявляются в разных вариантах и своеобразных, типичных для данной болезни взаимных сочетаниях (А. И. Струков и др., 1982). К общепатологическим процессам, развивающимся в организме животных и человека при болезнях, относят различные виды дистрофий (зернистую, гиалиново-капельную, гидропическую, жировую и др.), нарушения кровообращения (гиперемию, анемию, стаз, геморрагии, тромбоз, эмболию и др.), воспаление, регенераторные процессы. Если рассматривать проявление этих процессов в сравнительно-эволюционном аспекте, то оказывается, что у рыб они протекают по тем же общим закономерностям, что и у высших позвоночных. У рыб они отличаются скорее количественно, чем качественно. Это подтверждается более ранними работами (Крафт, Ясутаке и др.) и нашими исследованиями при разных группах болезней: токсикозах, бактериальных и вирусных инфекциях, некоторых инвазиях рыб. Они показали, что у рыб встречаются практически все виды дистрофий, но особенно часто встречаются зернистая, жировая, гиалиново-капельная и гидро- пическая. В разных вариантах они ярче проявляются при токсикозах и инфекционных болезнях рыб. Сосудистые расстройства у рыб чаще имеют общий системный характер и проявляются в виде различных форм гиперемии, ишемии и анемии, геморрагий, локальных и общих отеков. Это можно объяснить особенностями анатомического строения сердечно-сосудистой системы, отсутствием у них лимфоузлов и др. Воспалительная реакция у рыб изучена слабо, но она во многом сходна с проявлением воспаления у млекопитающих. Наиболее четко у рыб проявляются покраснение и опухание тканей. Местная и общая температурные реакции выражены слабо из-за утечки теплоты в воду; внешнее проявление боли у них малодифференци- ровано. Воспаление у рыб характеризуется сочетанием трех типов патологических процессов: альтерации, расстройства кровообращения (гиперемии и экссудации) и пролиферации клеток местных тканей. Степень альтеративных повреждений тканей зависит от вирулентности возбудителя, тяжести сосудистых расстройств и напряженности защитных сил организма. Образование язв на коже связывают с гиперэргической реакцией, сходной с феноменом Артюса, хотя экспериментально это пока не доказано. Сосудистые расстройства у рыб часто сопровождаются массивной транссудацией, экссудацией и эритродиапедезом. Особенно это характерно для многих острых инфекций рыб, протекающих септически (аэромонозов, псевдомонозов и др.). Они проявляются покраснением кожи, отеком рыхлой клетчатки (гидратацией мускулатуры, ерошением чешуи, пучеглазием), асцитом. Рыбам свойственно в основном сочетание серозного и геморрагического воспалений. Фибринозное и гнойное воспаления встречаются гораздо реже. В то время как у млекопитающих острое воспаление сопровождается эмиграцией гранулоцитов, у рыб этот феномен выражен менее четко, что связано с недостаточным количеством и более низкой фагоцитарной активностью нейтрофильных лейкоцитов рыб. Предполагают, что нейтрофилы рыб выделяют в очаге воспаления пероксиды, участвующие, по-видимому, в окислении и обезвреживании токсических продуктов. Кроме нейтрофилов клеточный инфильтрат составляют полиморфные мононуклеарные клетки местных тканей: макрофаги, лимфоидные элементы, плазмобласты и др. Это объясняется лимфоидным характером крови рыб и высокой активностью клеток РЭС. Существенным компонентом воспаления у рыб является пролиферация соединительнотканных элементов, протекающая так же, как у других позвоночных. Пролиферация особенно выражена при хронических инфекциях (ихтиофоноз, микобактериоз), а также некоторых инвазиях. Интенсивность и характер воспалительной реакции неодинаковы при бактериальных и вирусных инфекциях рыб, что связано с различиями факторов патогенности бактерий и вирусов. Патогенное действие бактерий, обусловленное их инвазивностью и токси- генностью, характеризуется сочетанием нескольких видов экссуда- тивного воспаления: серозного, серозно-геморрагического, фибринозного или гнойного. При вирусных инфекциях патология сразу начинается с некробиоза и часто завершается некрозом тканей, поскольку вирусы являются облигатными внутриклеточными паразитами. Поэтому при вирусных болезнях рыб более выражен альтера- тивный компонент воспаления. Против экзогенных агентов вообще и возбудителей болезней в частности у рыб достаточно хорошо развиты как неспецифические механизмы общей резистентности, так и специфические факторы защиты (иммунитет). Они выполняют компенсаторно-приспособительную функцию при различных болезнях. К неспецифическим факторам защиты у рыб относятся: эпителиальные и эндотелиальные покровы органов; слизь на коже, жабрах и в пищеварительном тракте; высокая регенерационная способность тканей; большое содержание лейкоцитов в крови; хорошо развитая мононуклеарная фагоцитарная система, представленная рассеянными по всему организму клетками ретикулярной, лимфо- идной, эндотелиальной тканей; гуморальные и физиологические реакции организма. Внешние покровы органов вместе с выделяемой слизью выполняют не только механическую защиту. Слизь рыб содержит муци- ноподобное вещество, глико-нуклеопротеиды, лизоцим, бактериолизины, пропердин, секреторные иммуноглубины и другие вещества, что обеспечивает ее нейтрализующую, кровеостанавливаю- щую способность, антимикробные и антипаразитарные свойства. При длительном воздействии экзогенных раздражителей (токсинов, колебаний рН воды и др.) наступает истощение секреции слизи, изменяются ее защитные свойства, что приводит к снижению барьерных свойств кожи, ее травмированию и открывает ворота для внедрения в организм микробов, паразитов, химических веществ и т. д. Поэтому травмирование кожи способствует заражению рыб многими инфекциями и инвазиями, а также проникновению в организм ядовитых веществ. Клеточные и гуморальные факторы защиты включают фагоцитоз и продуцирование различных антимикробных веществ. В фагоцитозе у рыб участвуют разнообразные клетки рети- кулолимофидных органов, рыхлой соединительной ткани, эндо- телиальных покровов, лейкоциты. Экспериментальными исследованиями на разных видах рыб показано, что в элиминации чужеродных веществ участвуют ретикулярные и синусоидные клетки почек, селезенки и печени, лимфоидная ткань желудка и кишечника. Корпускулярные субстанции разной природы фагоцитируют моноциты и частично эозинофилы крови. Фагоцитарные свойства нейтрофилов рыб изучены слабо. Предполагают, что они осуществляют бактерицидное действие больше экстраклеточно, выделяя лизоцим и другие вещества, стимулирующие развитие воспалительной реакции. В то же время не отрицается участие нейтрофилов рыб в фагоцитозе бактерий и нейтрализации токсинов, о чем свидетельствуют, по нашим данным, скопление нейтрофилов при серозно-гнойном воспалении и нейтрофилия при многих токсикозах рыб. Большинство исследователей считают, что фагоцитоз у рыб осуществляется в основном мононуклеарны- ми клетками. В слизи, крови и тканевых жидкостях рыб имеется большинство гуморальных факторов естественной резистентности, свойственных позвоночным животным. Это лизоцим, комплемент, про- пердин, интерферон, хитиназа, преципитины, лизины, неиммунные глобулины, С-реактивный белок, трансферины и др. Но они имеют ряд существенных особенностей и изучены недостаточно. Лизоцим — фермент с мурамидазной активностью — выявлен в сыворотке крови, слизи и фагоцитах многих видов рыб, имеет одинаковую молекулярную массу с лизоцимом млекопитающих и отличается от него по аминокислотному составу. Лизоцимная активность у разных видов и даже внутри одного вида рыб значительно колеблется. У хищных рыб (щука, окунь) его активность выше, чем у всеядных. Лизоцим особенно активен против грамположитель- ных бактерий. В комбинации с другими факторами он может лизи- ровать и грамотрицательные бактерии. Комплемент рыб, как и млекопитающих животных, структурно представляет собой комплекс проэнзимов, участвующих как в специфической, так и в неспецифической защите организма. Он обладает основными свойствами комплемента млекопитающих, но температурный предел его активности у рыб колеблется от 0—4 до 40—56 °С. При этом выявлены специфические свойства комплемента у разных видов рыб. У рыб доказано наличие интерферона. При вирусных инфекциях усиление его синтеза предшествует образованию специфических антител. Естественные гемагглютинины выявлены в сыворотке крови миноги, угря, радужной форели, карпа. Мало сведений имеется о природе лизинов и других гуморальных факторов резистентности рыб. Хотя гуморальные факторы резистентности у рыб изучены недостаточно, несомненно то, что они обеспечивают интегральную защитную функцию сыворотки крови и тканевой жидкости рыб. Поэтому на практике для оценки уровня резистентности организма рыб используют определение показателя бактерицидной активности сыворотки крови. Наконец, важнейшим фактором защиты рыб от инфекций является зависимая от внешней среды температура тела, которая может активизировать или подавлять развитие возбудителей болезней и защитно-приспособительных реакций организма. Например, выраженный инфекционный процесс развивается у них при адекватной для возбудителя и хозяина температуре воды, а следовательно, и тела рыб. Так, бактериальные болезни карпов ярче проявляются при температурах выше 20 °С, а форели — 12— 20 °С. Вирусные инфекции протекают остро при более низких температурах — 10—15 °С. Отчасти этим объясняется видоспеци- фичность возбудителей болезней холодолюбивых и теплолюбивых рыб, а также резистентность рыб к инфекциям телоплокров- ных животных. В отношении механизмов специфического иммунитета у рыб выявлены как общие закономерности, так и ряд особенностей. Показано, что функцию распознавания и восприятия микробов в организме рыб осуществляют лимфоциты, снабженные гетерогенными антигенреагирующими рецепторами. Этот процесс стимулирует появление в месте локализации антигенов эффекторных клеток: макрофагов, плазмобластов, плазматических клеток и грану- лоцитов, которые переводят антиген в иммуногенную форму (В. Р. Микряков, 1991). Полагают, что появлению антител в крови рыб предшествует дифференцировка лимфоидных клеток селезенки, головной и средней почки в сторону плазмобластов. Морфологически это проявляется пролиферацией клеток ретикулоэндотелиальной системы, гиперплазией гемопоэтической ткани и сопровождается увеличением объема селезенки и почек. У рыб установлено наличие Т- и В-лимфоцитов. При этом в почках карпа лимфоциты представляют собой смешанную популяцию, а в селезенке — однородную, состоящую из аналогов В-клеток. В пронефросе радужной форели встречаются только аналоги В-лимфоцитов, а в селезенке — Т- и В-клеток. Иными словами, характерный для высших позвоночных процесс трансформации иммуно- компетентных клеток в антителообразующие возникает у низших позвоночных, в том числе у рыб. Под влиянием специфической антигенной информации в лимфоидных органах рыб (почках, селезенке, тимусе) синтезируются антитела, относящиеся к классу Ig M-подобных иммуноглобулинов млекопитающих. Существование у рыб других классов иммуноглобулинов не доказано. Динамика антителогенеза у рыб в принципе сходна с образованием антител у теплокровных, за исключением того, что она зависит от температуры воды. Подавляющее число исследователей считают, что максимальное продуцирование антител происходит в период наибольшей физиологической активности рыб, т. е. при температуре, оптимальной для роста и развития данного вида. При пониженных температурах (менее 10 °С) иммунный ответ подавляется. Напряженность иммунитета повышается под влиянием иммунизации, причем 2—3-кратная вакцинация рыб более эффективна, чем однократная. В результате этого возрастает активность как неспецифических факторов (особенно завершенности фагоцитоза), так и титров антител в крови. Эпизоотологические наблюдения за течением заразных болезней рыб и опыты показали, что после перенесения болезни у рыб формируется приобретенный иммунитет. Так, А. К. Щербина доказал появление иммунитета при аэромонозе (краснухе) карпов, на основе чего он раскрыл эпизоотологические особенности течения этого заболевания в изолированном и неизолированном стадах карпов. В закрытом стаде формируется иммунная группа рыб, за счет чего инфекция постепенно затухает. В открытом стаде, которое ежегодно пополняется завозными рыбами, соответственно отмечаются обострения болезни и аэромоноз наблюдается в течение длительного времени. В литературе имеются немногочисленные данные о наличии иммунитета при инвазионных болезнях, например ихтиофтирио- зе и др. Для профилактики некоторых инфекционных болезней применяются вакцины, например при вибриозе форели. Однако вакци- нопрофилактика большинства заболеваний пока не нашла широкого применения в рыбоводстве. Глава 14 МЕТОДЫ ДИАГНОСТИКИ БОЛЕЗНЕЙ РЫБ При возникновении гибели рыб или подозрении на заболевание проводят всестороннее обследование рыбоводного хозяйства (водоема и т. п.), с тем чтобы установить причину болезни (или гибели рыб), выявить возбудителя, источник, пути его проникновения и распространения, а также условия, которые способствовали возникновению болезни. Эти сведения необходимы для своевременного проведения лечебных, оздоровительных и профилактических мероприятий. Поэтому диагностику большинства болезней рыб осуществляют комплексно с применением как общих, так и специальных исследований. Комплекс диагностических исследований включает: ветеринарно-санитарное обследование рыбоводных хозяйств, сбор анамнестических и эпизоотологических данных; клиническое обследование стада рыб; патологоанатомическое вскрытие рыб; лабораторные исследования. Анамнестические и эпизоотологические данные, клинические признаки и патологоанатомические изменения чаще используют для постановки предварительного диагноза, а при некоторых болезнях они имеют решающее значение. Окончательный диагноз чаще ставится после проведения лабораторных исследований. При подозрении на инфекционные заболевания проводят кли- нико-анатомические, вирусологические, бактериологические и микологические исследования, ставят биопробу. При подозрении на инвазионные болезни необходимы клинический осмотр, патологоанатомическое и паразитологическое вскрытия. При подозрении на отравления и незаразные болезни кроме клинико-анатомических проводят гидрохимические, химико-ток- сикологические (воды, рыбы, грунта, кормов и др.) исследования, ставят биопробы. При всех болезнях дополнительно проводят гематологические, биохимические, гистологические и другие диагностические исследования. ВЕТЕРИНАРНО-САНИТАРНОЕ ОБСЛЕДОВАНИЕ РЫБОВОДНЫХ ХОЗЯЙСТВ Обследование рыбоводных хозяйств (водоемов) проводят в плановом порядке для контроля выполнения противоэпизоотических мероприятий и вынужденно для установления диагноза при возникновении гибели рыб или подозрении на различные заболевания. В зависимости от целей и объема работ оно может быть полным или неполным. Плановые обследования рыбоводных хозяйств проводят по полной схеме 2—3 раза в год. Целями таких обследований являются изучение эпизоотической ситуации и разработка ветеринарно-са- нитарных и профилактических мероприятий, а также контроль их выполнения. Они включают следующие работы: проверка планов профилактических, лечебных и оздоровительных мероприятий и правильности их выполнения; анализ санитарного состояния прудов, бассейнов, садков, аквариумного хозяйства, кормоцехов и других производственных помещений; контроль методического уровня и условий для проведения диагностических исследований в местных лабораториях; уточнение эпизоотического состояния и токсикологической ситуации в хозяйстве; выборочное проведение необходимых диагностических исследований. По результатам обследования составляется заключение о вете- ринарно-санитарном и эпизоотическом состоянии хозяйства, уточняется комплекс профилактических и оздоровительных мероприятий. Неполное или вынужденное обследование проводят в случае возникновения заболевания рыб с целью его диагностики и разработки мероприятий по оздоровлению водоемов или хозяйства в целом. При этом основное внимание обращают на обследование неблагополучных водоемов, проведение клинических, патолого- анатомических, гидрохимических и других исследований в зависимости от предположительного диагноза, а также анализ документальных данных о перевозках, условиях содержания и кормления рыб, соблюдении рыбоводно-биологических нормативов их выращивания и т. п. Начинают обследование со сбора анамнестических данных: опроса рыбоводов и обслуживающего персонала о течении болезни и гибели рыб, как она проявлялась, какие возрастные группы рыб болеют, при каких условиях возникло заболевание: метеорологических (паводок, дождь, перепад температуры и т. д.), гидрологических и гидрохимических, рыбоводных (пересадки, сортировка рыб). Поданным ветеринарного учета определяют, отмечалось ли подобное заболевание в предыдущие годы, какие диагностические исследования и профилактические мероприятия проводились, каковы их результаты. Изучают схему устройства хозяйства и водоснабжения прудов, определяют вероятные источники загрязнения водоемов. В дальнейшем проводят обследование водоемов и стада пораженных рыб, которое включает: осмотр прудов (водоемов) и оценку санитарного состояния береговой зоны, зарастаемости ее растительностью, физических свойств воды; проведение клинического осмотра и патологоанатомического вскрытия рыб, учета больных и погибших рыб, определения уровня их заболеваемости; отбор воды и патматериалов для лабораторных исследований. КЛИНИЧЕСКОЕ ОБСЛЕДОВАНИЕ СТАДА РЫБ Клинический осмотр проводят выборочно непосредственно в водоеме, при контрольном отлове или посадке рыб в специальные емкости (аквариумы, садки, бассейны и т. п.). Рекомендуется просматривать не менее 100 рыб каждого вида и возраста. Регистрируют нарушение поведения рыб: пугливость, угнетение, возбуждение, координацию движения, равновесие в воде. Осматривают кожные покровы и плавники, обращая внимание на количество и качество слизи, изменение окраски, наличие припухлостей, кровоизлияний, язв, рубцов, цист, ерошение чешуи и т. д. Приподнимая жаберные крышки, осматривают жабры. Обращают внимание на окраску, форму, рисунок и степень ослизнения жабр, структуру лепестков, просматривая их с помощью лупы. На губах и слизистой ротовой полости встречаются кровоизлияния, язвы, новообразования. Важно не пропустить изменения на глазах: западания глаз или пучеглазие (экзофтальм), кровоизлияния, помутнение хрусталика и роговицы. Проводят учет больных рыб в абсолютном и процентном выражениях (заболеваемость). Рыб с клиническими признаками отсаживают в ведра или другие емкости, переносят в лабораторию и проводят патологоанатомическое вскрытие, паразитологические и другие исследования. Для вскрытия берут 25 сеголетков, 10—15 двухлетков и единичные экземпляры рыб старшего возраста. ПАТОЛОГОАНАТОМИЧЕСКОЕ ВСКРЫТИЕ РЫБ Патологоанатомическое вскрытие имеет важное диагностическое значение. Его применяют при диагностике большинства болезней рыб. Вскрытию подвергают свежие трупы (жабры без признаков разложения) и живых рыб с клиническими признаками заболевания. С целью недопущения разноса заразного начала вскрытие рыб проводят в лаборатории или в другом помещении. Запрещается вскрывать рыб на берегу водоема, скармливать вскрытых рыб собакам, кошкам и другим животным. Вскрытых рыб подвергают утилизации или закапывают в землю после обеззараживания их хлорной известью. Живых рыб перед вскрытием обездвиживают разными способами: усыпляют гипнодилом (5—10 мг/л), хлоралгидратом (2,4 г/л), разрушают спинной мозг иглой или разрезом позвоночника в области затылка. Патологоанатомическое вскрытие начинают с наружного осмотра, обращая внимание на те же изменения внешних покровов, плавников, глаз и других органов, что и при клиническом обследовании. Вскрывают рыб в следующем порядке. Жабры обнажают удалением жаберной крышки ножницами. Отмечают степень ослизне- ния, изменения их окраски и рисунка, наличие кровоизлияний, очагов некроза, цист паразитов и т. д. Ножницами отрезают 2—3 дуги и просматривают их под лупой. Иногда готовят препараты отдельных лепестков на предметном стекле. Накрыв их покровным стеклом, определяют толщину складок и патологические изменения. Брюшную полость карповых рыб вскрывают двумя разрезами (рис. 32). Ножницами делают надрез брюшной стенки впереди анального отверстия, вставляют тупой конец ножниц в брюшную полость и делают первый разрез вдоль белой линии до области межчелюстного пространства. Вторым полулунным разрезом, проходящим по уровню боковой линии, отсекают брюшную стенку, обнажая внутренние органы. Разрезы делают осторожно, чтобы не повредить внутренние органы. Вначале осматривают брюшную и сердечную полости, обращая внимание на их содержимое, наличие жидкости (транссудат или экссудат, ее количество, цвет, запах, консистенция) или газа, крупных паразитов, внешний вид внутренних органов. У половозрелых рыб отделяют гонады, отмечая стадию их зрелости, цвет, кровоизлияния, наличие мертвых икринок (белого цвета) и др. Затем, надрезав кишечник в области псевдодиафрагмы и ануса, извлекают комплекс внутренних органов. Осторожно отделяют желудок, кишечник, печень с желчным пузырем и селезенку. После отделения плавательного пузыря обнажают почки, лежащие вдоль позвоночника в виде ленты темно-красного цвета. При осмотре плавательного пузыря определяют его форму, толщину и прозрачность оболочек, наличие кровоизлияний, пятен ге- мосидерина, экссудата в полости и т. д. Состояние паренхиматозных органов (печени, почек, селезенки) оценивают по внешним признакам: размеру, консистенции, цвету, кровенаполнению, наличию кровоизлияний, очагов некроза, рисунку на разрезе и др. Кишечник разрезают вдоль, промывают в воде, просматривают состояние слизистой, учитывают количество гельминтов и др. При осмотре сердца отмечают его размер, форму, состояние миокарда, степень наполнения полостей кровью и ее свертываемости, наличие сгустков, кровоизлияний. Вскрывают черепную коробку с помощью четырех разрезов, из которых первым поперечным разрезом отсекают крышку у носо-  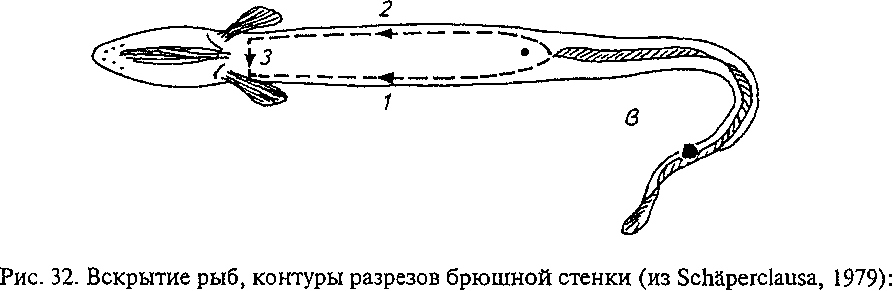 а — карпа и других карповых; б — форели и лососевых; в — угря вых ямок; два боковых разреза проходят от носовых ямок до затылочной области, а четвертый — в области затылка. Сначала проводят внешний осмотр оболочки головного мозга, затем его извлекают и характеризуют состояние вещества мозга, его кровенаполнение и др. При осмотре скелетной мускулатуры обращают внимание на цвет, консистенцию, наличие кровоизлияний, отека, припухлостей, цист паразитов, степень прикрепления к костям. Патологоанатомические изменения сопоставляют с клиническими симптомами, выявляют характерный комплекс признаков основного заболевания и сопутствующие осложнения (болезни), а также используют их для определения главной и непосредственной причины гибели рыб. В сомнительных случаях данные вскрытия уточняют с помощью гистологического исследования патматериала. Обработку патматериала проводят общими методами гистологической техники. По нашему опыту, кусочки органов рыб лучше заливать в целлоидин-парафин, а жабры, кожу и плавательный пузырь — в целлоидин. Срезы окрашивают общепринятыми методами. ПРАВИЛА ОТБОРА И ПЕРЕСЫЛКИ МАТЕРИАЛОВ ДЛЯ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ Пробы воды берут в нескольких точках водоема с таким расчетом, чтобы собранные образцы отражали гидрохимическое состояние водоема или загрязненность его отдельного участка (зоны гибели рыб, места впадения ручья или сбросного канала, района интенсивного поверхностного стока и т.д.), а также в незагрязненном участке (выше по течению). В прудах и других проточных емкостях берут пробы на вытоке воды. Пробы воды (не менее 2 л) отбирают батометром из поверхностных (на глубине 50 см) и придонных слоев в чистые стеклянные или полиэтиленовые бутылки (см. рис. 20). Перед заполнением посуду ополаскивают 2—3 раза исследуемой водой. В тех случаях, когда время транспортирования пробы составляет более 1 сут, их рекомендуется фиксировать различными консервантами в зависимости от целей исследования. Зимой воду при транспортировании следует утеплять, чтобы исключить ее замерзание. Пробы грунта (массой 2 кг) берут также из разных зон водоема дночерпателем Экмана или Кирпичникова. Грунт сушат, на воздухе и упаковывают в широкогорлые банки или полиэтиленовые мешки (рис. 33). Бентосные организмы (хирономиды, олигохеты, моллюски) в количестве 100—150 г отмывают от ила водой из водоема. 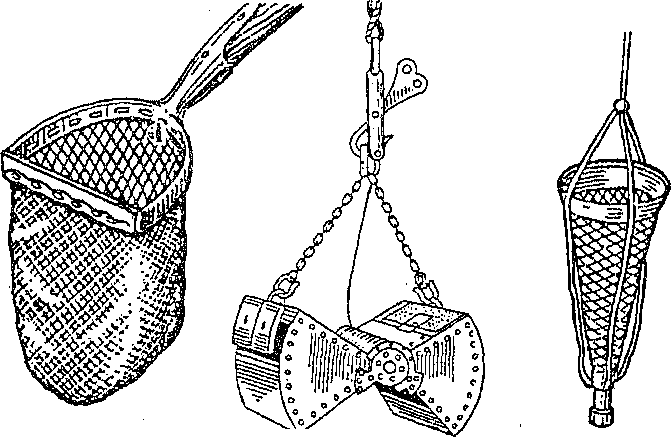 А Б В Рис. 33. Приспособления для взятия проб грунта и планктона: А — скребок; Б — дночерпатель; В — планктонная сетка Планктон собирают планктонной сеткой, фильтруя такое количество воды, которое необходимо для получения около 50 г живой массы планктона. Больных или подозрительных по заболеванию рыб доставляют в ветеринарную лабораторию живыми. Для исследования берут 10— 15 рыб на различных стадиях болезни. Живых рыб перевозят в молочных бидонах или других емкостях, заполненных на 3/4 объема водой из того же водоема, откуда взята проба, или водой из артезианской скважины. Летом при длительном транспортировании воду с рыбой постепенно охлаждают до температуры 12—15 °С, добавляя мелкие кусочки льда. Чтобы не вызывать у рыб температурного шока, нельзя допускать перепад температуры воды исходного водоема и транспортной емкости более 5—7 °С. В случае невозможности выполнить эти условия отбирают патматериалы от больных рыб и соответствующим способом консервируют. Для химико-токсикологического анализа пригодны снулая рыба или свежие трупы, которые отправляют в охлажденном, замороженном виде или консервируют 70°-ным спиртом. Кусочки органов для бактериологических и вирусологических исследований отбирают стерильно, замораживают или консервируют 40—50%-ным раствором глицерина в кипяченой воде или физиологическом растворе. Кровь, экссудат и другой жидкий пат- материал доставляют в запаянных пастеровских пипетках. Пробы для микологических исследований консервируют в растворе антибиотиков (пенициллина или стрептомицина по 100 ЕД/мл раствора). В исключительных случаях делают посевы в лаборатории рыбоводного хозяйства. Кровь для исследований берут пастеровской пипеткой из хвостовых сосудов (артемии и вены) или из сердца с соблюдением правил асептики и антисептики (рис. 34). Взятую кровь используют для посева, приготовления мазков, гематологических и биохимических исследований. Цельную кровь стабилизируют гепарином (1000 ЕД/мл) или лимоннокислым натрием. Сыворотку крови получают общепринятым методом, помещают в стерильные запаянные ампулы, а летом консервируют 5%-ным раствором фенола (1—2 капли на 1 мл сыворотки) или тиомерсалом из расчета 10 мг препарата на 10 мл сыворотки. Отобранные жидкие материалы перевозят в термосе со льдом. 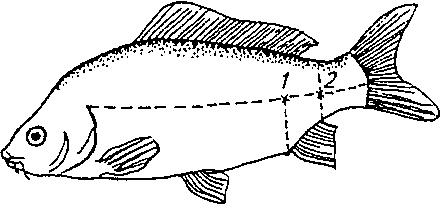 Материал для гистологических исследований берут от погибших и вынужденно убитых рыб. Мелких рыб (мальки и се- Рис. 34. Места взятия крови из хвостовых сосудов карпа: 1 — у сеголетков; 2— у карпов старшего возраста голетки) после вскрытия брюшной полости фиксируют целиком, а от крупных особей берут органы или кусочки органов размером 2 х 3 см и толщиной 0,5—1,0 см. Кусочки из пораженных органов и тканей вырезают так, чтобы были захвачены нормальные и измененные участки. Независимо от степени поражения берут кусочки кожи с подлежащей мускулатурой, жабр, печени, почек, селезенки, сердца, кишечника, плавательного пузыря, головного мозга. Кишечник перед фиксацией осторожно вскрывают или делают на нем несколько надрезов, чтобы фиксирующая жидкость проникла в его полость. Головной мозг осторожно извлекают целиком после вскрытия черепной коробки. Подлежащий исследованию материал помещают в стеклянные банки и фиксируют 10%-ным нейтральным формалином, жидкостью Буэна или Карнуа. С пораженных органов собирают паразитов и консервируют разными способами в зависимости от их систематического положения и размеров. Для определения простейших — инфузорий, жгутиконосцев — готовят мазки соскобов из жабр и кожных покровов на предметных стеклах, подсушивают их на воздухе и хранят в бумаге или фиксируют жидкостью Шаудина 15—20 мин. Из цист миксо- споридий также готовят мазки на предметных стеклах, которые сразу заключают в глицерин-желатину. Гельминтов собирают с органов в солонки или чашки Петри, промывают от слизи водой или физиологическим раствором и выдерживают в них до гибели паразита. Моногенетических сосальщиков сразу заключают в глицерин-желатину на предметных стеклах или фиксируют в 4%-ном растворе формалина. Трематод, ленточных червей и скребней фиксируют 70°-ным спиртом между стеклами так, чтобы они расправились, а у скребней вышел хоботок; нематод и личинок цестод консервируют в жидкости Барбагалло. Паразитических рачков фиксируют в 70°-ном спирте или 4%-ном формалине, пиявок —в 4%-ном формалине, не раздавливая, и глохидий — в 70°-ном спирте. Отобранные материалы подробно описывают, этикетируют, упаковывают в водонепроницаемую тару, опечатывают и высылают с нарочным в ветеринарную лабораторию или другое учреждение, где имеются возможности для исследования. В сопроводительном письме сообщают данные обследования водоема, указывают предполагаемый диагноз и какие лабораторные исследования необходимо провести. БАКТЕРИОЛОГИЧЕСКИЕ И ВИРУСОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ Для доказательства бактериальной или вирусной этиологии болезней рыб необходимо выделить возбудителя из организма больных рыб, идентифицировать его по культурально-морфологичес- ким, антигенным и биологическим признакам, воспроизвести болезнь на здоровых рыбах, повторно выделить (реизолировать) возбудителя от экспериментальных животных. Все эти исследования проводят по общепринятой схеме с учетом особенностей организма рыб и возбудителей болезней (схема I, табл. 11). Схема I. Лабораторная диагностика бактериальных болезней рыб Патологический материал от больных рыб f ^ Посевы на МПБ, МПА, Микроскопия мазков кро- дифференциальные среды ви и отпечатков органов ^ Выращивание пер- I Окраска по Граму, окраска Миксобактерии, мико- вичных культур г>- на оксидазу, определение бактерии и др. (/ = 24...26 °С) I подвижности Чистые культуры сем. Vibriomceae и др. ности i t I. Изучение биохимичес- II. Определение патоген- ких свойств III. Изучение антигенных свойств
вида
смесью сывороток
Бактериологические посевы проводят вначале с пораженных участков кожи, мышц (язвы, абсцессы и др.), жаберной ткани, крови и асцитной жидкости, а после вскрытия полости — обязательно с печени, почек или селезенки. Материал для вирусологических исследований отбирают из органов и тканей, где концентрируется вирус, а при малоизученных болезнях — из наиболее пораженных органов. Язвы перед отбором патологического материала промывают стерильным физиологическим раствором; содержимое абсцессов, фурункулов, асцитной жидкости набирают пастеровской пипеткой после прижигания места прокола. Для асептического вскрытия рыбу обездвиживают, фиксируют препаровальными иглами на деревянной или пробковой доске. Туловище с левой стороны освобождают от слизи и чешуи, удаляют грудной и брюшной плавники, дезинфицируют 70°-ным спиртом или фламбируют спиртовым тампоном. Брюшную стенку отсекают стерильными ножницами полулунным разрезом от ануса к жаберной крышке. Патматериал с паренхиматозных органов отбирают стерильно пастеровскими пипетками или бактериологической петлей. Первичные бактериологические посевы проводят на МПБ, МПА и некоторые дифференциальные среды (например, кровяной агар, Китт—-Тароцци). Патологический материал для вирусологи- 11. Основные свойства бактерий сем. Vlbrionaceae
Aeromonas hydrophila | |||||||||||||||||||
