Учебнометодическое пособие для студентов i курса медицинского вуза Рекомендовано Учебнометодическим объединением по медицинскому и фармацевтическому образованию вузов России в качестве учебного пособия для студентов медицинских вузов
 Скачать 5.49 Mb. Скачать 5.49 Mb.
|
Смещение химического равновесияКаждое химическое равновесие устанавливается при определенном значении трех параметров, которые его характеризуют: 1) концентрация реагирующих веществ, 2) температура, 3) давление для газов. Изменение одного их этих параметров определяет характер внешнего воздействия на систему и приводит к нарушению равновесия (рис. 16). Установившееся новое равновесие оказывается смещенным по отношению к исходному вправо или влево в зависимости от того, равновесные концентрации каких веществ стали больше - продуктов реакции или исходных веществ. Направление смещения равновесия определяется принципом Ле Шателье:  Если на систему, находящуюся в состоянии химического равновесия, оказывать воздействия путем изменения концентрации реагентов, давления, температуры, то равновесие смещается в направлении той реакции, протекание которой ослабляет это воздействие. Это означает, что до установления нового равновесия получает большую скорость та реакция, которая уменьшат внешнее воздействие, и таким образом равновесие смещается в сторону образования продуктов этой реакции. Аналогично принципу Ле Шателье в природе существует принцип адаптивных перестроек:  Любая живая система при воздействии на нее перестраивается так, чтобы уменьшить это воздействие. Анри-Луи Ле-Шателье родился 8 октября 1850 года в Париже. После окончания Политехнической школы в 1869 году он поступил в Высшую Национальную горную школу. Будущий открыватель знаменитого принципа был широко образованным и эрудированным человеком. Его интересовали и техника, и естественные науки, и общественная жизнь. Много времени он посвятил изучению религии и древних языков. В возрасте 27 лет Ле-Шателье стал уже профессором Высшей горной школы, а тридцать лет спустя - Парижского университета. Тогда же он был избран в действительные члены Парижской Академии наук. Наиболее важный вклад французского ученого в науку был связан с изучением химического равновесия, исследованием смещения равновесия под действием температуры и давления. Студенты Сорбонны, слушавшие лекции Ле-Шателье в 1907-1908 годах, так записывали в своих конспектах: "Изменение любого фактора, могущего влиять на состояние химического равновесия системы веществ, вызывает в ней реакцию, стремящуюся противодействовать производимому изменению. Повышение температуры вызывает реакцию, стремящуюся понизить температуру, то есть идущую с поглощением тепла. Увеличение давления вызывает реакцию, стремящуюся вызвать уменьшение давления, то есть сопровождающуюся уменьшением объема...". К сожалению, Ле-Шателье не был удостоен Нобелевской премии. Причина заключалась в том, что эта премия присуждалась только авторам работ, выполненных или получивших признание в год получения премии. Важнейшие работы Ле Шателье были выполнены задолго до 1901 года, когда состоялось первое присуждение Нобелевских премий. Способы смещения равновесия1. Увеличение давления (для газов) смещает равновесие в сторону реакции, ведущей к уменьшению объема (т.е. к образованию меньшего числа молекул).  1 1 A(г) +В(г) С(г); увеличение давления приводит к возраста- 2 нию скорости прямой реакции ( 1 > 2), 2 моль 1моль равновесие смещается вправо. 2 нию скорости прямой реакции ( 1 > 2), 2 моль 1моль равновесие смещается вправо. 2. Увеличение температуры смещает положение равновесия в сторону эндотермической реакции (т.е. в сторону реакции, протекающей с поглощением теплоты): 1 A  + В С + Q, увеличение температуры приводит к 2 возрастанию скорости обратной (эндотер- + В С + Q, увеличение температуры приводит к 2 возрастанию скорости обратной (эндотер-м  ической) реакции ( 2 > 1), равновесие смещается влево. ической) реакции ( 2 > 1), равновесие смещается влево. 1 A  + В С – Q, увеличение температуры приводит к 2 возрастанию скорости прямой (эндотерми- + В С – Q, увеличение температуры приводит к 2 возрастанию скорости прямой (эндотерми-ч  еской) реакции ( 1 > 2), равновесие смещается вправо. еской) реакции ( 1 > 2), равновесие смещается вправо. У  величение концентрации исходных веществ А и В и удаление продуктов из сферы реакции смещает равновесие вправо, так как увеличивается скорость прямой реакции. Уменьшение концентраций исходных веществ A или В приводит к возрастанию скорости обратной реакции ( 2 > 1), равновесие смещается влево. величение концентрации исходных веществ А и В и удаление продуктов из сферы реакции смещает равновесие вправо, так как увеличивается скорость прямой реакции. Уменьшение концентраций исходных веществ A или В приводит к возрастанию скорости обратной реакции ( 2 > 1), равновесие смещается влево. Катализаторы не влияют на положение равновесия, так как катализатор ускоряет как прямую, так и обратную реакции. 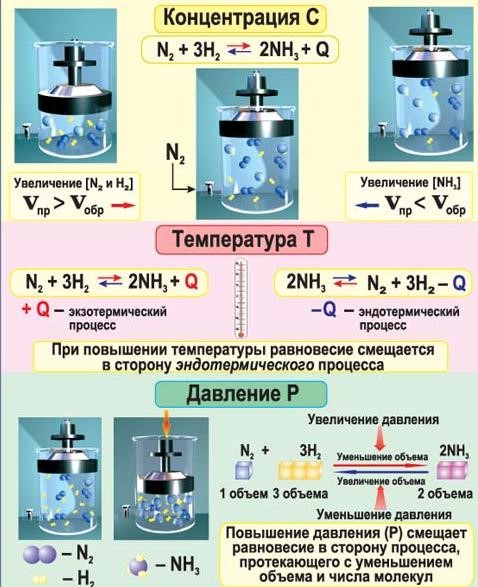 Рис. 16. Влияние концентрации, давления, температуры на равновесие |
