Учебнометодическое пособие для студентов i курса медицинского вуза Рекомендовано Учебнометодическим объединением по медицинскому и фармацевтическому образованию вузов России в качестве учебного пособия для студентов медицинских вузов
 Скачать 5.49 Mb. Скачать 5.49 Mb.
|
Тема: ОСНОВЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ, ТЕРМОХИМИИ. ОПРЕДЕЛЕНИЕ ТЕПЛОТЫ РАСТВОРЕНИЯ ВЕЩЕСТВАЦели изучения: усвоить содержание основных понятий и сущность законов термодинамики, научиться на их основе выполнять различные термодинамические и термохимические расчеты. Научиться экспериментально определять тепловой эффект растворения вещества.  Повторить: тепловые эффекты химических реакций, сохранение и превращение энергии при химических реакциях. Термохимические уравнения. Молярная концентрация вещества в растворе. Повторить: тепловые эффекты химических реакций, сохранение и превращение энергии при химических реакциях. Термохимические уравнения. Молярная концентрация вещества в растворе.  Учебно-целевые вопросыОсновные понятия химической термодинамики: система, параметры системы, функции состояния системы, процессы, теплота, работа, внутренняя энергия, энтальпия. Первый закон термодинамики, его биологическое значение. Термохимия. Тепловой эффект химической реакции. Закон Гесса и следствия из него. Второй закон термодинамики, его биологическое значение. Энтропия, факторы, влияющие на ее величину. Роль энтропийного фактора для характеристики системы и процессов. Энергия Гиббса, значение для термодинамических расчетов. Влияние энтропийного и энтальпийного факторов на возможность самопроизвольного протекания процесса. Особенности энергетического обмена в живых организмах как открытых системах. Принцип энергетического сопряжения в живых организмах. Краткая теоретическая частьОсновные понятия, определения, законыТ  ермодинамика – наука о законах, управляющих изменением энергии системы, передачей энергии от одной системы к другой, а также взаимным превращением различных видов энергии. ермодинамика – наука о законах, управляющих изменением энергии системы, передачей энергии от одной системы к другой, а также взаимным превращением различных видов энергии. Химическая термодинамика изучает приложение термодинамики к химическим процессам. Одно из основных понятий термодинамики – система. С  истема – это тело или групп тел, находящихся во взаимодействии, реально или мысленно обособленных от окружающей среды и подвергнутых изучению, рассматривающиеся как совокупность большого числа частиц. истема – это тело или групп тел, находящихся во взаимодействии, реально или мысленно обособленных от окружающей среды и подвергнутых изучению, рассматривающиеся как совокупность большого числа частиц. Классификация термодинамических системВ зависимости от однородности различают системы гомогенные и гетерогенные. С И С Т Е М Ы  гомогенные, однофазные гетерогенные, двух- и более фазные (однородные) (разнородные) Например : воздух, вода, Например: цельная кровь, молоко истинные растворы В зависимости от характера взаимодействия с окружающей средой различают системы изолированные, закрытые и открытые.
Например: живой организм Например: теплообменники в природе не существует, модель - термостат В термодинамике различают три состояния системы: равновесное, стационарное и переходное.
  СОСТОЯНИЕ СИСТЕМЫ  Состояние системы характеризуется параметрами.  Параметры системы – совокупность физических и химических величин, характеризующих состояние системы. Параметры системы подразделяют на экстенсивные и интенсивные.  ПАРАМЕТРЫ СИСТЕМЫ экстенсивныевеличины, зависящие от числа частиц в системе Например: масса (m), объем (V), количество вещества (n) интенсивныевеличины, не зависящие от числа частиц в системе Например: температура (T), давление (р), концентрация (с) При взаимодействии систем значения экстенсивных параметров суммируются, а интенсивных – усредняются. Например, при смешивании горячего кофе и холодного молока, объемы суммируются, а температура усредняется. Наряду с параметрами для характеристики состояния системы используют функции состояния. Функции состояния – экстенсивные величины, которые нельзя непосредственно измерить экспериментально, характеризующие состояние системы. Их значения зависят только от данного состояния системы и не зависят от того, каким путем это состояние достигнуто. К функциям состояния относятся: внутренняя энергия (U), энтальпия (Н), энтропия (S), свободная энергия Гиббса (G). Переход системы из одного состояния в другое является процессом. П  роцесс – переход системы из одного состояния в другое, сопровождающийся необратимым или обратимым изменением хотя бы одного параметра, характеризующего данную систему. роцесс – переход системы из одного состояния в другое, сопровождающийся необратимым или обратимым изменением хотя бы одного параметра, характеризующего данную систему.  = конечное значение  начальное значение изменение параметра параметра параметра начальное значение изменение параметра параметра параметра  Неотъемлемое свойство материи – движение. Оно проявляется в разных формах качественно отличающихся друг от друга, но взаимосвязанных между собой и превращающихся друг в друга. Мерой движения является энергия.  емлемым свойством системы. Рис. 1. Виды энергии химической системы В зависимости от форм движения материи различают следующие виды энергии: тепловая, электрическая, химическая, ядерная и т.д. Термодинамика рассматривает процессы взаимного перехода тепловой энергии в другие виды (механическую, химическую, электрическую и т.д.). В химической термодинамике важное значение имеет понятие внутренней энергии системы. В  нутренняя энергия (U) системы – это сумма потенциальной энергии взаимодействия всех частиц системы между собой и кинетической энергии их движения. нутренняя энергия (U) системы – это сумма потенциальной энергии взаимодействия всех частиц системы между собой и кинетической энергии их движения. Внутренняя энергия системы складывается из поступательного и вращательного движения молекул, энергии внутримолекулярного колебательного движения атомов и атомных групп, составляющих молекулы, энергии вращения электронов в атомах, энергии, заключающейся в ядрах атомов, энергии межмолекулярного взаимодействия и других видов энергии. U 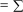 U , кДж/моль i U , кДж/моль iВ Обмен внутренней энергией между системой и окружающей средой может осуществляться в форме теплоты или работы. Р  абота (А или W) – энергетическая мера направленных форм движения частиц в процессе взаимодействия системы с окружающей средой. абота (А или W) – энергетическая мера направленных форм движения частиц в процессе взаимодействия системы с окружающей средой. Работа А считается положительной, если совершается системой против внешних сил окружающей среды. Т  еплота (Q)– энергетическая мера хаотических форм движения частиц в процессе взаимодействия системы с окружающей средой. еплота (Q)– энергетическая мера хаотических форм движения частиц в процессе взаимодействия системы с окружающей средой. В термодинамике количество теплоты Q считается положительным, если теплота сообщается системе из окружающей среды. Работа и теплота не являются функциями состояния, а являются функциями процесса, их величина зависит от пути процесса, по которому система перешла из одного состояния в другое. I закон термодинамикиI закон термодинамики рассматривает обмен энергией между системой и окружающей средой в форме работы и теплоты. Это всеобщий закон природы, закон сохранения и превращения энергии, объясняющий положение диалектического материализма о вечности и неуничтожимости движения и материи. Впервые этот закон сформулировал немецкий врач Ю. Р. Майер (1842 г.), хотя фактически это закон сохранения энергии, который был сформулирован М.В. Ломоносовым еще в 1748 г. Ю  . Р. Майер работал судовым врачом на корабле. Который направлялся из Европу на Яву. Он обратил внимание, что венозная кровь жителей Явы более светлая, чем кровь жителей Германии и высказал предположение, что это явление связано с разным остаточным количеством кислорода в крови. Жители жаркого региона потребляют кислорода меньше, чем жители север- . Р. Майер работал судовым врачом на корабле. Который направлялся из Европу на Яву. Он обратил внимание, что венозная кровь жителей Явы более светлая, чем кровь жителей Германии и высказал предположение, что это явление связано с разным остаточным количеством кислорода в крови. Жители жаркого региона потребляют кислорода меньше, чем жители север-ных районов. При пониженной теплоотдаче организма в тропиках ему требуется меньше энергии, а чем меньше расход энергии, тем меньше потребление пищи. Ю. Р. Майер пришел к выводу, что теплота, выделяющаяся при переработке пищи в организме, расходуется на поддержание постоянной температуры тела и совершение мышечной работы.  Энергия не исчезает и не возникает из ничего, а только превращается из одного вида в другой в строго эквивалентных количествах. В зависимости от вида системы существуют различные формулировки I закона термодинамики. Н  евозможно создать вечный двигатель (перпетуум мобиле) первого рода, т.е. осуществить работу, не израсходовав энергию. евозможно создать вечный двигатель (перпетуум мобиле) первого рода, т.е. осуществить работу, не израсходовав энергию.  В изолированной системе изменение внутренней энергии системы в результате любых процессов всегда равно нулю.  Подведенная к закрытой системе теплота расходуется на изменение внутренней энергии системы и на совершение системой работы против внешних сил окружающей среды. Q Живые организмы функционируют в изобарно- и Q = U + р V; U  = Uкон Uнач; V = Vкон Vнач; = Uкон Uнач; V = Vкон Vнач; Q = (Uкон Uнач) + р(Vкон Vнач); Q = (Uкон рVкон) – (Uнач + рVнач); U + рV = H, где Н – энтальпия, численно равна сумме внутренней энергии системы и произведения давления на объем системы. Э  нтальпия (Н) – термодинамическая функция, характеризующая энергетическое состояние системы при изобарноизотермических условиях. нтальпия (Н) – термодинамическая функция, характеризующая энергетическое состояние системы при изобарноизотермических условиях. Химические реакции и физико-химические процессы могут протекать с выделением или поглощением энергии. К  оличество теплоты, которое выделяется или поглощается при проведении химической реакции в изобарно-изотермических условиях Qр равно изменению энтальпии системы и называется энтальпией реакции ( Нр-ции). оличество теплоты, которое выделяется или поглощается при проведении химической реакции в изобарно-изотермических условиях Qр равно изменению энтальпии системы и называется энтальпией реакции ( Нр-ции). Химические реакции и физико-химические процессы подразделяют на экзотермические и эндотермические процессы. Э  кзотермические процессы – процессы, в результате которых энергия выделяется из системы в окружающую среду. кзотермические процессы – процессы, в результате которых энергия выделяется из системы в окружающую среду. Д   ля экзотермических процессов: Нкон Ннач, Н = (Нкон Ннач) 0, Н 0 Эндотермические процессы – процессы, в результате которых энергия поглощается системой из окружающей среды. ля экзотермических процессов: Нкон Ннач, Н = (Нкон Ннач) 0, Н 0 Эндотермические процессы – процессы, в результате которых энергия поглощается системой из окружающей среды. Для эндотермических процессов:  Нкон Ннач, Н = (Нкон Ннач) 0, Н 0 Нкон Ннач, Н = (Нкон Ннач) 0, Н 0 Энтальпия системы является экстенсивным параметром и зависит от температуры, давления, поэтому изменение энтальпии в результате химической реакции или физико-химического процесса определяют при стандартных условиях. Стандартные условия (с.у.): количество вещества – 1 моль; давление – 760 мм. рт. ст. = 101 325 Па; температура – 298 K. Термодинамические величины в с.у. обозначаются соответствующим символом этой величины с верхним индексом о и температурой 298, указанной справа внизу. Н  о298 – стандартная энтальпия процесса или реакции – энергетическая характеристика физико-химического процесса или химической реакции, проводимых при с.у. о298 – стандартная энтальпия процесса или реакции – энергетическая характеристика физико-химического процесса или химической реакции, проводимых при с.у. Для оценки энергетического состояния веществ в термодинамике используются значения стандартных энтальпий образования этих веществ, обозначаемых: Но298 (вещество, агрегатное состояние), кДж/моль.  Стандартная энтальпия образования простых веществ в их наиболее термодинамически устойчивом агрегатном и аллотропном состоянии при с.у. условно принимается равной нулю. Н  апример, для кислорода Но298 (О2, г) = 0, а для озона Но298 (О3, г) = 142 кДж/моль, для графита Но298 (С, графит) = 0, а для алмаза Но298 (С, алмаз) = 1,88 кДж/моль. апример, для кислорода Но298 (О2, г) = 0, а для озона Но298 (О3, г) = 142 кДж/моль, для графита Но298 (С, графит) = 0, а для алмаза Но298 (С, алмаз) = 1,88 кДж/моль.  Стандартная энтальпия образования сложного вещества равна энтальпии реакции получения 1 моль этого вещества из простых веществ при с.у. Например, стандартная энтальпия образования этанола равна стандартной энтальпии реакции: 2 Значение стандартной энтальпии образования сложного вещества зависит от природы вещества и его агрегатного состояния. Числовые значения стандартных энтальпий образования веществ являются справочными данными и для некоторых веществ приведены в табл. 2 приложения. Используя стандартные энтальпии образования веществ, участвующих в химической реакции, можно, не прибегая к эксперименту, рассчитать энтальпию реакции на основе закона Г.И. Гесса (1840 г.): З  начение теплового эффекта процесса, протекающего в изобарных ( Нр-ции) или изохорных ( Uр-ции) условиях, зависит только от начального и конечного состояния данной системы и не зависит от пути процесса. начение теплового эффекта процесса, протекающего в изобарных ( Нр-ции) или изохорных ( Uр-ции) условиях, зависит только от начального и конечного состояния данной системы и не зависит от пути процесса. Например: С(тв) + О2(г) СО2(г) Н1  С(тв) + 1/2О2(г) СО(г) Н2 С(тв) + 1/2О2(г) СО(г) Н2 СО(г) +1/2О2(г) СО2(г) Н3 CO   H2 H3 Н1 = Н2 + Н3 H2 H3 Н1 = Н2 + Н3 C H1 CO2 Р  усский химик Герман Иванович (Герман Генрих) Гесс (18021850)родился в Женеве в семье художника, который вскоре переехал в Россию. В 15-летнем возрасте Геcc уезжает в Дерпт (ныне Тарту, Эстония), где учится сначала в частной школе, а затем в гимназии, которую с блеском заканчивает в 1822 г. После гимназии он поступил в Дерптский университет на меди- усский химик Герман Иванович (Герман Генрих) Гесс (18021850)родился в Женеве в семье художника, который вскоре переехал в Россию. В 15-летнем возрасте Геcc уезжает в Дерпт (ныне Тарту, Эстония), где учится сначала в частной школе, а затем в гимназии, которую с блеском заканчивает в 1822 г. После гимназии он поступил в Дерптский университет на меди-цинский факультет, где изучал химию у профессора Готфрида Озанна, специалиста в области неорганической и аналитической химии. В 1825 г. Гесс защитил диссертацию на степень доктора медицины: «Изучение химического состава и целебного действия минеральных вод России». Как и многие учѐные того времени, Гесс проводил исследования в самых разных областях: разработал способ извлечения теллура из его соединения с серебром (теллурида серебра – минерала, названного в честь учѐного гесситом); открыл поглощение платиной газов; впервые обнаружил, что измельченная платина ускоряет соединение кислорода с водородом; описал многие минералы; предложил новый способ вдувания воздуха в доменные печи; сконструировал аппарат для разложения органических соединений, устраняющий погрешности в определении количества водорода и т.д. Мировую известность Герман Гесс получил как основатель термохимии. Учѐный сформулировал основной закон термохимии – «закон постоянства сумм теплот», являющийся приложением закона сохранения энергии к химическим процессам. Гессу принадлежит также открытие второго закона термохимии – закона термонейтральности, согласно которому при смешивании нейтральных солевых растворов тепловой эффект отсутствует. Гесс впервые высказал мысль о возможности измерения химического сродства исходя из теплового эффекта реакции, предвосхитив сформулированный позднее Марселеном Бертло и Юлиусом Томсеномпринцип максимальной работы. Гесс занимался также вопросами методики преподавания химии. Его учебник «Основания чистой химии» (1831) выдержал семь изданий (последнее – в 1849 г.). В своѐм учебнике Гесс использовал разработанную им русскую химическую номенклатуру. Под названием «Краткий обзор химического именословия» она вышла отдельным изданием в 1835 г. (в работе принимали также участие С.А.Нечаев из Медико-хирургической академии, М.Ф.Соловьев из Петербургского университета и П.Г.Соболевский из Горного института). Эта номенклатура была позже дополнена Д.И.Менделеевым и во многом сохранилась до настоящего времени. Закон Гесса широко используется для расчета тепловых эффектов химических реакций, которые экспериментально определить невозможно. Из закона Гесса вытекают следующие следствия. 1-е следствие используют для расчета энтальпии реакции по стандартным энтальпиям образования веществ.  oобр.(прод. р-ции) oобр.(прод. р-ции) 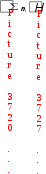 oобр.(исх. в-в) , oобр.(исх. в-в) , где ni– стехиометрические коэффициенты химической реакции.  Энтальпия химической реакции при с.у. равна разности алгебраической суммы энтальпий образования продуктов реакции и алгебраической суммы энтальпий образования исходных веществ с учетом их стехиометрических коэффициентов: 2-е следствие используют для расчета теплового эффекта реакции по стандартным теплотам сгорания веществ. С  тандартная теплота сгорания вещества – это теплота, выделяющаяся при сгорании 1 моль вещества в кислороде до высших оксидов при стандартных условиях. тандартная теплота сгорания вещества – это теплота, выделяющаяся при сгорании 1 моль вещества в кислороде до высших оксидов при стандартных условиях. Стандартные теплоты сгорания являются справочными величинами и для некоторых веществ приведены в табл. 3 приложения. 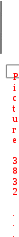 Энтальпия реакции равна разности алгебраической суммы энтальпий сгорания исходных веществ и суммы энтальпий сгорания продуктов реакции с учетом их стехиометрических коэффициентов. Hoр-ции =  oсгор.(исх. в-в) oсгор.(исх. в-в) 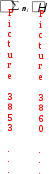 oобр.(прод. р-ции) , где ni– стехиометрические коэффициенты химической реакции. oобр.(прод. р-ции) , где ni– стехиометрические коэффициенты химической реакции. Наиболее распространенными реакциями, используемыми живым организмом для получения энергии, являются реакции окисления. Э  нергия, выделяемая при полном окислении, т.е. сгорании питательных веществ, называется их калорийностью. нергия, выделяемая при полном окислении, т.е. сгорании питательных веществ, называется их калорийностью. По закону Гесса, количество теплоты, которое выделяется при окислении питательных веществ, не зависит от того, как или где они окисляются, при условии, что продукты реакции остаются неизменными. М Следовательно, для энергетической оценки большинства продуктов питания может служить энтальпия реакции их сгорания. Энергетическую характеристику продуктов питания принято выражать в калориях: 1 кал = 4,18 Дж, соответственно, 1 ккал = 4,18 кДжУдельные теплоты полного окисления основных компонентов пищевых продуктов приведены в табл. 4 приложения. Пища представляет собой смесь питательных веществ сложного состава, поэтому калорийность пищи указывается в расчете на 1 г, а не на моль (кДж/г или ккал/г). Нормальные величины суточной потребности в энергии для городского населения в зависимости от рода деятельности (данные Института питания АМН СССР)
1-я группа: работники умственного труда; операторы, обслуживающие современную технику; служащие, работа которых не связана с затратой физического труда. 2-я группа: работники связи, продавцы, медсестры, санитарки, проводники, швейники и др. 3-я группа: врачи, студенты, преподаватели, а также станочники, текстильщики, обувщики, водители транспорта, работники прачечных, почтальоны и др. 4-я группа: работники немеханизированного труда, а также горнорабочие, шахтеры, строительные рабочие, металлурги и др. Калорийность основных продуктов питания представлена в табл. 6 приложения. Практическое значение при термохимических расчетах имеет также 3-е следствие, известное как закон Лавуазье-Лапласа:  Тепловой эффект разложения какого-либо соединения равен и противоположен по знаку тепловому эффекту его образования. 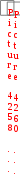 Hoобр. = Hoразл. Hoобр. = Hoразл.  Например: Н2(г) + Cl2(г) = 2HCl(г) H = –184 кДж Например: Н2(г) + Cl2(г) = 2HCl(г) H = –184 кДж 2HCl(г) = Н2(г) + Cl2(г) H = +184 кДж 4-е следствие:  Если совершаются две реакции, приводящие из различных начальных состояний к одинаковым конечным состояниям, то разница между их тепловыми эффектами равна тепловому эффекту перехода из одного начального состояния в другое. С  С С 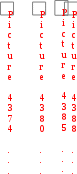 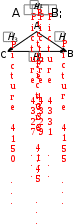 1 H3 = H1 H2 1 H3 = H1 H2 5-е следствие:  Если совершаются две реакции, приводящие из одинаковых начальных состояний к различным конечным состояниям, то разница между их тепловыми эффектами представляет собой тепловой эффект перехода из одного конечного состояния в другое. А  С С 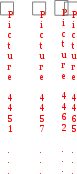 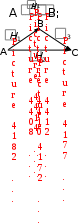 H H3 = H2 H1 H H3 = H2 H1 В зависимости от типа химической реакции или физикохимического процесса, кроме энтальпий образования и сгорания, различают: энтальпию нейтрализации, энтальпию растворения, энтальпию гидратации, энтальпию фазового перехода. Э  нтальпия нейтрализации – количество теплоты, которое выделяется при взаимодействии 1 моль эквивалентов сильной кислоты с 1 моль эквивалентов сильного основания. нтальпия нейтрализации – количество теплоты, которое выделяется при взаимодействии 1 моль эквивалентов сильной кислоты с 1 моль эквивалентов сильного основания. Нейтрализация любой сильной кислоты любой щелочью в водном растворе описывается одним и тем же ионным уравнением:  Н+ + ОН Н2О Ho298 нейтр-ции = 55,8 кДж/моль Н+ + ОН Н2О Ho298 нейтр-ции = 55,8 кДж/моль Э  нтальпия растворения – количество теплоты, которое выделяется при растворении 1 моль вещества в значительном избытке растворителя. нтальпия растворения – количество теплоты, которое выделяется при растворении 1 моль вещества в значительном избытке растворителя. II закон термодинамикиII закон термодинамики определяет условия самопроизвольного протекания процессов. Установлено, что все самопроизвольные процессы реализуются под влиянием двух основных факторов: стремления системы к достижению минимума энергии; стремления системы к увеличению ее энтропии, т.е. возрастанию беспорядка в ней. Э  нтропия (S) – термодинамическая функция, характеризующая меру неупорядоченности движения частиц системы, т.е. неоднородности расположения и перемещения ее частиц. нтропия (S) – термодинамическая функция, характеризующая меру неупорядоченности движения частиц системы, т.е. неоднородности расположения и перемещения ее частиц. Д  ля обратимого процесса: S = Q Дж ; ля обратимого процесса: S = Q Дж ; T моль К Для необратимого процесса: S Q T г Q – теплота, передаваемая системе; Т абсолютная температура, при которой осуществляется процесс. Э S  i Sо(прод. р-ции) i Sо(прод. р-ции)  i Sо(исх. в-в), где Sо – стандартная энтропия образования вещества. i Sо(исх. в-в), где Sо – стандартная энтропия образования вещества. Значения стандартных энтропий образования некоторых веществ приведены в табл. 2 приложения. В  еличина энтропии зависит: от агрегатного состояния, аллотропной формы, температуры, давления, сложности системы. еличина энтропии зависит: от агрегатного состояния, аллотропной формы, температуры, давления, сложности системы.  Энтропия вещества в газообразном состоянии больше, чем энтропия его в жидком состоянии, а последняя больше энтропии этого вещества в твердом состоянии: Sг Sж Sтв. Энтропия вещества в газообразном состоянии больше, чем энтропия его в жидком состоянии, а последняя больше энтропии этого вещества в твердом состоянии: Sг Sж Sтв.  Энтропия простых веществ зависит от их аллотропной формы: Энтропия простых веществ зависит от их аллотропной формы: Энтропия системы при повышении температуры возрастает, так как увеличивается неупорядоченность движения частиц: если T1 > Т2, то S1 > S2 Энтропия системы при повышении давления уменьшается, так как снижается неупорядоченность движения частиц: если р1 > р2, то S1 < S2 С увеличением сложности системы энтропия повышается, так как возрастает число видов частиц и вариантов их расположения. Энтропия – важнейший термодинамический параметр, который является не только мерой неупорядоченности расположения и движения частиц в системе, но и мерой связанной энергии, которую система не может превратить в работу, критерием направления протекания самопроизвольного процесса, критерием глубины протекания процесса (S = Smax). Свойства энтропии позволяют проследить цепочку усложняющихся образований от атомов элементов до белковых молекул, от неживой природы до живой клетки (рис. 2). Существует несколько формулировок II закона термодинамики:  Теплота не может самопроизвольно переходить от менее нагретого тела к более нагретому (Р. Клаузиус, 1850 г.).  Невозможно построить вечный двигатель второго рода, т.е. невозможно теплоту полностью превратить в работу (В. Томсон) 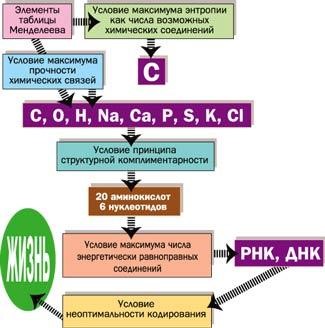 Рис 2. Схема образования от атомов элементов до белковых молекул, от неживой природы до живой клетки Все самопроизвольные процессы в макроскопических системах протекают в направлении от менее вероятного состояния к более вероятному состоянию системы (Л. Больцман) В   изолированных системах самопроизвольно могут совершаться только такие процессы, в которых энтропия системы возрастает: S 0. изолированных системах самопроизвольно могут совершаться только такие процессы, в которых энтропия системы возрастает: S 0. В  любой изолированной системе полная энергия остается постоянной, а полная энтропия со временем только повышается: U = 0, S 0. любой изолированной системе полная энергия остается постоянной, а полная энтропия со временем только повышается: U = 0, S 0. Математическая форма второго начала термодинамики для изолированных систем: | |||||||||||||||||||||||||

 И С Т Е М Ы
И С Т Е М Ы