|
|
Учебнометодическое пособие для студентов i курса медицинского вуза Рекомендовано Учебнометодическим объединением по медицинскому и фармацевтическому образованию вузов России в качестве учебного пособия для студентов медицинских вузов
S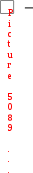 ≥ Q ≥ Q
T
Большинство биохимических реакций протекает в открытых системах и сопровождается одновременным изменением энтальпии и энтропии. Функцией состояния, одновременно учитывающей и энтальпию, и энтропию системы, является энергия Гиббса, которая связана с энтальпией и энтропией следующим уравнением:
G = H – TS, (кДж/моль)
G – энергия Гиббса, изобарно-изотермический потенциал, обобщенная термодинамическая функция, характеризующая энергетическое состояние системы при постоянном давлении и температуре. – энергия Гиббса, изобарно-изотермический потенциал, обобщенная термодинамическая функция, характеризующая энергетическое состояние системы при постоянном давлении и температуре.
Э нергия Гиббса функция состояния: G = Gкон – Gнач нергия Гиббса функция состояния: G = Gкон – Gнач
О дин из основателей химической термодинамики ДжозайяУиллард Гиббс(Gibbs J. W.) родился в 1839 году в небольшом американском городке Нью-Хейвене. Девятнадцати лет от роду он окончил Йельский университет, а уже через пять лет стал доктором философии и начал преподавать студентам математику. После стажировки в лучших университетах Европы Гиббс получил дин из основателей химической термодинамики ДжозайяУиллард Гиббс(Gibbs J. W.) родился в 1839 году в небольшом американском городке Нью-Хейвене. Девятнадцати лет от роду он окончил Йельский университет, а уже через пять лет стал доктором философии и начал преподавать студентам математику. После стажировки в лучших университетах Европы Гиббс получил
должность профессора в родном Йельском университете и начал самостоятельное исследование тепловых процессов в химии. И здесь ему удалось достичь выдающихся результатов. Имя американца Гиббса было присвоено многим величинам и понятиям новой отрасли химии - химической термодинамики (энергия Гиббса, треугольник Гиббса, правило фаз Гиббса).
Первую работу в области термодинамики Гиббс представил Коннектикутской академии наук в 1872 г. Она называлась «Графические методы в термодинамике жидкостей» и была посвящена методу энтропийных диаграмм. Метод позволял графически представить все термодинамические свойства вещества и сыграл большую роль в технической термодинамике. Гиббс развил свои идеи в следующей работе – «Методы геометрического представления термодинамических свойств веществ при помощи поверхностей» (1873), введя трѐхмерные диаграммы состояния и получив соотношение между внутренней энергией системы, энтропией и объемом. В 1874–1878 Гиббс опубликовал трактат «О равновесии гетерогенных веществ», идеи которого легли в основу химической термодинамики. В нем Гиббс изложил общую теорию термодинамического равновесия и метод термодинамических потенциалов, сформулировал правило фаз, построил общую теорию поверхностных и электрохимических явлений, обобщил принцип энтропии, применяя второе начало термодинамики к широкому кругу процессов и вывел фундаментальное уравнение, устанавливающее связь между внутренней энергией термодинамической системы и термодинамическими потенциалами. Полученные им уравнения позволяли определять направление химических реакций и условия равновесия для смесей любой сложности, а также для гетерогенных систем.
Уиллард был задумчив и слаб здоровьем, что отдалило его от участия в шумной общественной жизни США. Он рано потерял родителей, унаследовав с двумя старшими сестрами дом и скромное состояние. До конца жизни он оставался холостым. Тихо живя вместе с сестрами, Гиббс занимался домашним хозяйством и наукой. Они прожили вместе всю жизнь в одном и том же доме в Нью-Хейвене. От дома было полквартала до школы, где учился Гиббс в юности, один квартал до колледжа, где он провел студенческие годы, два квартала до университета, где он преподавал, и столько же до кладбища, где он был похоронен. Тихий провинциальный городок - американская "глубинка" - давал Гиббсу все, что нужно для работы: спокойную размеренную жизнь среди родных, необходимые книги в библиотеке, свободное время для размышлений, живописные окрестности для прогулок. На досуге Гиббс иногда угощал домочадцев собственноручно приготовленными изысканными салатами, которые назывались вполне научно - "гетерогенные равновесия". Гиббса отличали скромность, приветливость в общении с людьми. Никогда он не проявлял ни малейшего высокомерия или честолюбия. Даже в пожилом возрасте он не потерял стройной фигуры, всегда был тщательно одет и причесан. Он никогда не спешил и, тем не менее, никогда никуда не опаздывал. В 1901 году Лондонское королевское общество присудило Гиббсу медаль Коплея - самую почетную международную награду, учрежденную раньше Ноболевских премий. И это была последняя награда Гиббса: через два года, в 1903 году, он скончался. Понадобилось почти полвека, чтобы заслуги ученого получили признание не только в Европе, но и на родине. Только в 1950 году его бюст поместили в "Галерее славы великих американцев".
Д ля расчетов пользуются стандартной энергией Гиббса Gо298 (табл. 2 приложения). ля расчетов пользуются стандартной энергией Гиббса Gо298 (табл. 2 приложения).

Стандартная энергия Гиббса образования простых веществ в термодинамически устойчивой форме условно принята равной нулю.
Изменение энергии Гиббса в результате химической реакции определяется:
 Go298 р-ции = Go298 р-ции = 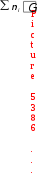 o298(прод. р-ции) o298(прод. р-ции) 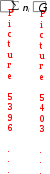 o298 (исх. в-в), o298 (исх. в-в),
где ni – стехиометрические коэффициенты химической реакции.
Изменение энергии Гиббса для биохимических реакций в нестандартных условиях можно рассчитывать на основе экспериментальных данных по уравнению:
|
|
|
 Скачать 5.49 Mb.
Скачать 5.49 Mb.
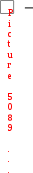 ≥ Q
≥ Q  – энергия Гиббса, изобарно-изотермический потенциал, обобщенная термодинамическая функция, характеризующая энергетическое состояние системы при постоянном давлении и температуре.
– энергия Гиббса, изобарно-изотермический потенциал, обобщенная термодинамическая функция, характеризующая энергетическое состояние системы при постоянном давлении и температуре.  дин из основателей химической термодинамики
дин из основателей химической термодинамики 
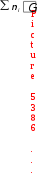 o298(прод. р-ции)
o298(прод. р-ции) 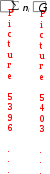 o298 (исх. в-в),
o298 (исх. в-в),