|
|
Учебнометодическое пособие для студентов i курса медицинского вуза Рекомендовано Учебнометодическим объединением по медицинскому и фармацевтическому образованию вузов России в качестве учебного пособия для студентов медицинских вузов
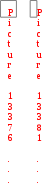 = kсnА(A)сnВ(B) = kсnА(A)сnВ(B)
Числа nA, nВ в выражении закона действующих масс называются порядками реакции по соответствующим веществам. Это экспериментально определяемые величины. Сумма показателей степеней nA и nВ называется общим порядком реакции.
 Обратите внимание! Степени при концентрациях веществ А и В в общем случае не равны стехиометрическим коэффициентам в реакции! Они становятся численно равными только в том случае, если реакция протекает именно так, как записывается (такие реакции называются простыми или элементарными). В большинстве случаев уравнение реакции отражает лишь суммарный результат химического процесса, а не его механизм. Обратите внимание! Степени при концентрациях веществ А и В в общем случае не равны стехиометрическим коэффициентам в реакции! Они становятся численно равными только в том случае, если реакция протекает именно так, как записывается (такие реакции называются простыми или элементарными). В большинстве случаев уравнение реакции отражает лишь суммарный результат химического процесса, а не его механизм.
Б екетов Николай Николаевич (1827–1911), русский физикохимик. Родился 7 (13) января 1827 в с. Новая Бекетовка Пензенской губернии в семье помещика. После окончания 1-й Петербургской гимназии поступил в Петербургский университет «на разряд естественных наук II отделения философского факультета»; два года спустя перевелся в Казанский университет. После его окончания в 1849 екетов Николай Николаевич (1827–1911), русский физикохимик. Родился 7 (13) января 1827 в с. Новая Бекетовка Пензенской губернии в семье помещика. После окончания 1-й Петербургской гимназии поступил в Петербургский университет «на разряд естественных наук II отделения философского факультета»; два года спустя перевелся в Казанский университет. После его окончания в 1849
возвратился в Петербург. В 1849–1853 работал в лаборатории Медикохирургической академии под руководством Н.Н. Зинина. Защитив магистерскую диссертацию, занял должность ассистента кафедры химии Петербургского университета. В 1855 был назначен экстраординарным профессором (адъюнктом) Харьковского университета. Преподавательская и научная деятельность его в стенах этого университета продолжалась без перерыва 32 года.
В 1865 Бекетов защитил докторскую диссертацию Исследования над явлениями вытеснения одних металлов другими, в 1866 был избран членом Петербургской академии наук и переехал в Петербург. Работал в химической лаборатории Петербургской академии наук, преподавал на Высших женских курсах. В 1860 Бекетов начал читать курс лекций по физической химии в Харьковском университете, в 1864 организовал отделение по подготовке физикохимиков. В докладной записке, обосновывавшей создание новой специальности, Бекетов писал: «Знать химию... невозможно без основательного знакомства с физикой, а потому также с математикой... Хотя мы и различаем химические и физические свойства тел, и те и другие суть выражение строения и свойств малейших частиц... Строение материи... находится в зависимости от физических условий и химических свойств». Научные работы Бекетова посвящены изучению зависимости направления химических реакций от состояния реагентов и внешних условий, исследованию химического сродства и того, какими свойствами это сродство определяется. В своей докторской диссертации он установил влияние концентрации реагентов на направление химической реакции, предвосхитив выводы закона действующих масс. Открыл вытеснение металлов из растворов их солей водородом и показал, что химическое действие газов зависит от давления; установил возможность протекания реакции в двух направлениях и дал точное определение состояния равновесия. Исследовал вытеснение одних элементов другими из их соединений и связал эти процессы с «первоначальными химическими свойствами элементов – тем, что называется химическим сродством». Стремясь связать химические явления с «относительными массами и расстояниями между действующими частицами», Бекетов вплотную подошел к идее, что химические свойства веществ определяются свойствами их атомов – атомной массой и радиусом. Установленный им «вытеснительный ряд металлов» в точности совпал с найденным впоследствии электрохимическим рядом напряжений. Исходя из своих представлений о «прочности» (в современной терминологии – стабильности) соединения элементов с близкими атомными массами, Бекетов предложил в качестве наиболее сильного восстанавливающего агента алюминий. С его помощью осуществил восстановление некоторых металлов из их оксидов при высоких температурах, создав основы метода, позже вошедшего в практику под названием алюминотермии. Этот метод теперь широко используется в металлургии.
Бекетов был не только ученым и педагогом, но и общественным деятелем: он организовал публичную библиотеку в Харькове, Общество по распространению грамотности и Общество пособия нуждающимся студентам, выступал с публичными лекциями. Был президентом Русского физико-химического общества.
Н орвежский химик Петер Вааге (правильнее – Воге) родился в г. Флеккефьорд (1833-1900). Изучал медицину и минералогию в университете Кристиании (ныне Осло); после окончания университета изучал химию в Германии и Франции. Вернувшись в Норвегию, в 1861 г. становится заведующий химической лабораторией, а с орвежский химик Петер Вааге (правильнее – Воге) родился в г. Флеккефьорд (1833-1900). Изучал медицину и минералогию в университете Кристиании (ныне Осло); после окончания университета изучал химию в Германии и Франции. Вернувшись в Норвегию, в 1861 г. становится заведующий химической лабораторией, а с
1862 г. – профессором университета в Кристиании. Основные на-
учные работы Вааге относятся к химической кинетике и химической термодинамике; исследования он проводил совместно с норвежским математиком К.М. Гульдбергом. В 1864-1867 гг. они установили закон действующих масс, который является одним из основных положений теории химического равновесия. Труды Вааге и Гульдберга по опытной и теоретической разработке учения о химическом равновесии и сродстве начали печататься с 1864 г. в норвежском журнале "Forhandlinger i Videnskabs Jelskabet i Christiania"; закон действующих масс опубликован ими в сочинении "Etudes sur les affinités chimiques" ("Исследование сил химического сродства", 1867). Однако эта работа Гульдберга и Вааге была переведена на немецкий язык лишь в 1879 г., и только после этого приобрела известность в научном сообществе. В 1880-х гг. закон действующих масс начинает рассматриваться как один из основополагающих законов химии. Представляя равновесие обратимой реакции как равенство двух сил сродства, действующих в противоположных направлениях, Гульдберг и Вааге показали, что направление реакции определяется не массами веществ, а произведением действующих масс (концентраций) реагирующих веществ. Установление этого закона, непосредственно связанного с теорией химического сродства, созданной Бертолле в самом начале XIX века, дало новый толчок в разработке понятий о химическом сродстве и химическом равновесии. Вааге написал также руководства по общей и аналитической химии.
 Норвежский математик и физико-химик Като Максимилиан Норвежский математик и физико-химик Като Максимилиан
Гульдберг родился в Кристиания (ныне Осло, Норвегия) (1836 1902). Окончил университет Кристиании. В 1859-1860 гг. преподавал математику в средней школе, в 1861 г. – в Королевской военной школе, с 1861 г. – в Королевской военной академии, с 1867 г. – в университете Кристиании. В 1869 г. стал профессором приклад-
ной математики университета Кристиании. В 1867 г. – член Норвежской Академии наук. Основные работы Гульдберга относятся к области физической химии, прежде всего, термодинамики и химической кинетики. В 1860 г. он установил зависимость температур плавления сплавов, смесей жирных кислот и смесей солей, а также плотности смесей от состава. Совместно с П. Вааге 1864-1867 гг. Гульдберг открыл закон действующих масс и исследовал условия химического равновесия. В 1870 г. Гульдберг сформулировал принцип подвижного равновесия для частного случая зависимости растворимости от давления. В 1870-1872 гг. развил представления о сущности неопределѐнных химических соединений. В 1879 г. Гульдберг совместно с Вааге разработал молекулярно-кинетическую интерпретацию закона действующих масс и его применения в практике осуществления химических реакций. Ввѐл в практику описания фазовых равновесий уравнения состояния и уравнения, связывающие внутреннюю энергию тела с параметрами состояния – давлением и температурой. Ввѐл в физику и химию понятие идеального твѐрдого тела, аналогичное понятию идеального газа. В 1875-1880 гг. разработал методы сравнительного расчѐта свойств веществ, нашѐл уравнения для вычисления коэффициентов расширения тел, теплот плавления и теплоѐмкостей. Вывел формулы для калориметрических характеристик пара в различных условиях и уравнения зависимости давления насыщенного пара от температуры. Кроме физической химии, Гульдберг занимался также метрологией, написал учебники по теоретической и прикладной математике.
Константа скорости реакции, k – это индивидуальная характеристика реакции, зависит от природы реагирующих веществ, температуры и катализатора, но не зависит от концентрации реагентов.
Значение константы скорости реакции постоянно для данной реакции при данной температуре. Физический смысл константы скорости заключается в том, что она численно равна скорости реакции при концентрации реагентов, равных 1 моль/л.
Для гетерогенных реакций в закон действующих масс не входят концентрации твердых веществ, т.к. реакции с твердыми веществами протекают на их поверхности, где «концентрация» вещества постоянна:
Cтв+O2(г)=CO2(г),
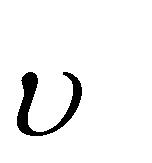 = kс(С)m·с(O2)n = k'с(O2)n; где k' = k(С)m. = kс(С)m·с(O2)n = k'с(O2)n; где k' = k(С)m.
В химической кинетике принято классифицировать реакции по величине общего порядка реакции. Рассмотрим зависимость концентрации реагирующих веществ от времени для реакций нулевого, первого и второго порядков.
|
|
|
 Скачать 5.49 Mb.
Скачать 5.49 Mb.
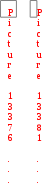 = kсnА(A)сnВ(B)
= kсnА(A)сnВ(B)  екетов Николай Николаевич
екетов Николай Николаевич