Учебнометодическое пособие для студентов i курса медицинского вуза Рекомендовано Учебнометодическим объединением по медицинскому и фармацевтическому образованию вузов России в качестве учебного пособия для студентов медицинских вузов
 Скачать 5.49 Mb. Скачать 5.49 Mb.
|
Реакции нулевого порядкаД Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ; это характерно для многих гетерогенных (идущих на поверхности раздела фаз) реакций в том случае, когда скорость диффузии реагентов к поверхности меньше скорости их химического превращения. Реакции первого порядкаД Реакции второго порядкаДля реакций второго порядка кинетическое уравнение имеет следующий вид: Как правило, реакция состоит из нескольких стадий. Например, реакция 4HBr + O2 = 2Br2 + 2H2O состоит из трех последовательных стадий: HBr + O2 = HOOBr HOOBr + HBr = 2HOBr HOBr + HBr = H2O + Br2 Установлено, что из этих трех стадий самая медленная – первая. Именно она определяет скорость всей реакции (является лимитирующей стадией). Поэтому зависимость скорости реакции окисления бромоводорода от концентраций имеет вид: |
| Реакция | Выражение для закона действующих масс | Порядок реакции |
| H2+Cl2=2HCl | | n(Cl2)=0,5; общий порядок 1,5 |
| 2CO+O2=2CO2 | | n(CO) = –1; общий порядок 0 |
Наиболее простые и изученные случаи - реакции с общим порядком, равным 1, 2 или 3:
| H2S2O3 = SO2 + S + H2O | | общий порядок 1 |
| H2 + I2 = 2HI | | общий порядок 2 |
| 2NO + Cl2 = 2NOCl | | общий порядок 3 |
Закономерностям реакций 1-го порядка подчиняется также радиоактивный распад, хотя он не является химической реакцией.
Для характеристики протекания реакции во времени используют, кроме скорости и константы скорости такой параметр как период полупревращения.
П
 ериод полупревращения 1/2 – время, за которое концентрация реагирующего вещества уменьшается вдвое.
ериод полупревращения 1/2 – время, за которое концентрация реагирующего вещества уменьшается вдвое. Д
Периоды полураспада некоторых радионуклидов, применяемых в медицине приведены в табл. 5 приложения.
Р
 еакции радиоактивного распада описываются кинетическими уравнениями 1-го порядка. Интегральная форма кинетического уравнения для реакций 1-го порядка имеет вид: с = со е–k ,
еакции радиоактивного распада описываются кинетическими уравнениями 1-го порядка. Интегральная форма кинетического уравнения для реакций 1-го порядка имеет вид: с = со е–k , где со – концентрация вещества в начальный момент времени; с – текущая концентрация вещества в момент времени ;
Константа скорости реакции 1-го порядка связана с периодом полураспада простым соотношением: k
1/ 2

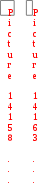 = k с(HBr)·с(O2)
= k с(HBr)·с(O2)