Учебнометодическое пособие для студентов i курса медицинского вуза Рекомендовано Учебнометодическим объединением по медицинскому и фармацевтическому образованию вузов России в качестве учебного пособия для студентов медицинских вузов
 Скачать 5.49 Mb. Скачать 5.49 Mb.
|
5. Влияние величины поверхности соприкосновения реагирующих веществДля гетерогенных систем (когда вещества находятся в разных агрегатных состояниях), чем больше поверхность соприкосновения, тем быстрее протекает реакция. Поверхность твердых веществ может быть увеличена путем их измельчения, а для растворимых веществ – путем их растворения. 6. Влияние катализатораК  атализ – явление изменения скорости химической реакции веществами, которые участвуют в реакции, но не входят в состав конечных продуктов. атализ – явление изменения скорости химической реакции веществами, которые участвуют в реакции, но не входят в состав конечных продуктов. Различают следующие виды катализа: К А Т А Л И З   положительный отрицательный (ингибирование) ускорение реакции замедление реакцииОбычно термин «катализ» относят к положительному катализу. Примером отрицательного катализа может быть ингибирование ферментов при взаимодействии с катионами элементовтоксикантов: Hg2+, Pb2+, Cd2+, As3+. К А Т А Л И З  
Примером гомогенного катализа является реакция разложения пероксида водорода в присутствии солей железа(II) в водных растворах: Fe2+  2H2O2 2H2O + O2 2H2O2 2H2O + O2 П  римером гетерогенного катализа является синтез аммиака из водорода и азота в присутствии металлического железа: 3H2 + N2 Fe 2NH3 римером гетерогенного катализа является синтез аммиака из водорода и азота в присутствии металлического железа: 3H2 + N2 Fe 2NH3  Разновидностью гомогенного катализа является кислотноосновной катализ. Разновидностью гомогенного катализа является кислотноосновной катализ. К таким реакциям относится омыление сложных эфиров и амидов: +  CH3COOC2H5 Н CH3COOH + C2H5OH CH3COOC2H5 Н CH3COOH + C2H5OH Катализаторы – молекулы, ионы, атомы, поверхности, участвующие в реакции, изменяющие скорость термодинамически возможных реакций за счет уменьшения или увеличения энергии активации, но остающиеся химически неизменными в результате реакции. К А Т А Л И З А Т О Р Ы  положительные отрицательные (ингибиторы) увеличивают скорость реакции замедляют скорость реакции Для оценки влияния катализатора на скорость реакции можно использовать уравнение Аррениуса в следующем виде: ln  1 RT 1 RTОбщие принципы катализаКатализаторы ускоряют только термодинамически возможные реакции. Катализаторы ускоряют химическую реакцию, как правило, за счет снижения энергии активации реакции, образуя промежуточные соединения. Катализаторы увеличивают скорости как прямой, так и обратной реакций, ускоряя достижение химического равновесия. Катализаторы после завершения реакции остаются в неизменном виде и количестве. Все каталитические реакции сложные, так как состоят, как минимум, из двух элементарных актов:  а) Реагент + катализатор промежуточное соединение; а) Реагент + катализатор промежуточное соединение; б) Промежуточное соединение продукты реакции + катализатор. Действие катализатора можно изменить: промоторы – усиливают, а каталитические яды – блокируют действие катализатора. Промотирование – увеличение активности катализатора в присутствии веществ, которые сами не являются катализаторами данного процесса (промоторов). Например, для катализируемой металлическим никелем реакции: введение в никелевый катализатор небольшой примеси церия приводит к резкому возрастанию активности катализатора. Отравление – резкое снижение активности катализатора в присутствии некоторых веществ (т. н. каталитических ядов). Например, для реакции синтеза аммиака (катализатор – губчатое железо), присутствие в реакционной смеси соединений кислорода или серы вызывает резкое снижение активности железного катализатора; в то же время способность катализатора адсорбировать исходные вещества снижается очень незначительно. Действие некоторых лекарственных препаратов основано на промотировании или отравлении ферментов. Механизм действия катализатораВлияние катализатора на скорость химической реакции заключается в его участии в этой реакции и изменении ее механизма. Катализатор образует с реагентами промежуточные соединения – активированные комплексы, которые в дальнейшем превращаются в продукты реакции и свободный катализатор. В присутствии катализатора изменяется механизм реакции, и она направляется по пути с меньшим значением энергии активации каждой стадии (Ea´ < Ea; Ea´´< Ea), что приводит к возрастанию скорости реакции (рис. 11). Кроме того, катализатор может способствовать определенной ориентации молекул в пространстве, удобной для данного химического взаимодействия, и влиять на энтропию переходного состояния, способствуя ее возрастанию. Н    апример, реакция A + B Ea D происходит в несколько стадий: 1) A +K Ea ' [AK] 2) [AK] +B Eа'' D + K, где K – катализатор, А и В – реагенты, D – продукт реакции. апример, реакция A + B Ea D происходит в несколько стадий: 1) A +K Ea ' [AK] 2) [AK] +B Eа'' D + K, где K – катализатор, А и В – реагенты, D – продукт реакции. 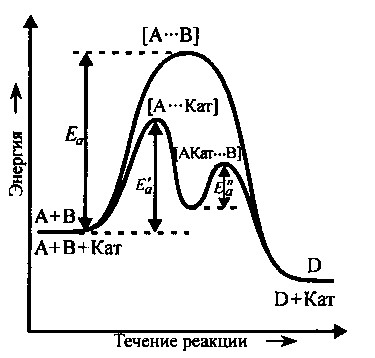 Рис. 11. Энергетический профиль реакции без катализатора и с катализатором Ингибитор, в отличие от катализатора, повышает энергию активации. Ингибиторы препятствуют обычному течению химической реакции, вступая во взаимодействие с каким-либо промежуточным веществом, тем самым удаляя его из реакционной смеси. Это затрудняет протекание всей последовательности стадий сложной реакции. Суть механизма гомогенного катализаПри гомогенном катализе реагирующие вещества и катализатор находятся в одной фазе (в растворе или в смеси газов). Гомогенные каталитические реакции состоят из двух элементарных реакций. A + B → D + P A +K → D + E E + B → P + K Продукт Е, образующийся в результате взаимодействия катализатора К с первым реагентом А, во второй стадии реагирует со вторым реагентом В с образованием второго продукта Р, а катализатор регенерируется. При этом лимитирующей могут быть разные стадии. Пример: реакция окисления ионов ванадия(III) ионами железа(III) протекает медленно. В присутствии гомогенного катализатора ионов меди(II) она ускоряется и протекает в две стадии: V3+ + Fe3+ → V5+ + Fe2+ I. V3+ + Cu2+ → V5+ + Cu+ II. Cu+ + Fe3+ → Cu2+ + Fe2+. Лимитирующей является первая стадия этого процесса. Особенности механизма гетерогенного катализаПри гетерогенном катализе реагирующие вещества и катализатор находятся в разных фазах, и химическая реакция протекает на границе фаз. Наибольшее практическое значение имеют каталитические реакции, когда катализатор находится в твердой фазе, а реагенты – в жидкой или газообразной. Примером гетерогенного катализа может служить реакция окисления SO2 в SO3 на катализаторе V2O5 (рис. 12).  Рис. 12. Схема каталитической реакции образования оксида серы(VI) Гетерогенный катализ включает 2 стадии: В целом скорость определяется либо первой (диффузионный режим), либо второй (кинетический режим) стадией. Кинетический режим более вероятен для невысоких температур. При высоких температурах скорость реакции возрастает быстрее, чем скорость диффузии, которая становится лимитирующей стадией. Ферментативный катализФерменты (энзимы) – простые или сложные белки, которые катализируют химические реакции в живых системах. Ферменты ускоряют химическую реакцию за счет снижения энергии активации реакции, образуя промежуточные соединения (рис. 13). 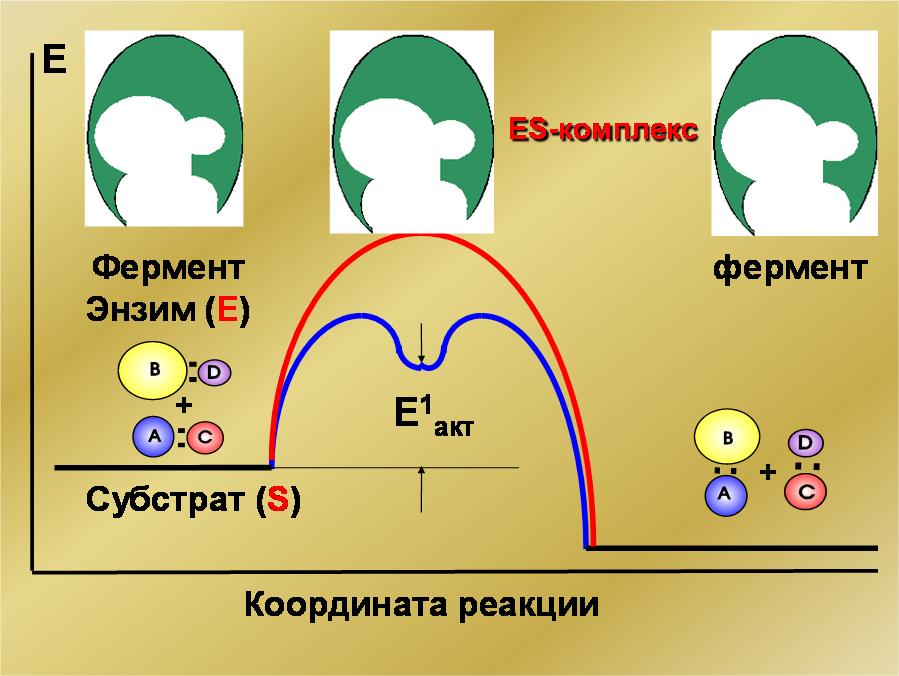 Рис. 13. Энергетический профиль реакции в присутствии фермента Особенности ферментативного катализаХимическая природа. Все ферменты – белки. По своему строению ферменты подразделяются на две большие группы: однокомпонентные и двухкомпонентные. К однокомпонентным относятся ферменты, состоящие только из белковых молекул. У этих ферментов роль активных центров выполняют определенные химические группировки – аминокислотные остатки. Например, ОН– группа серина, SH– группа цистеина и др. К двухкомпонентным относятся такие ферменты, которые состоят из белковой и небелковой части, причем белковая часть двухкомпонентного фермента оказывает решающее влияние на специфичность его действия. Вместе с тем соединение активной группы (небелковой части) с белками приводит к огромному возрастанию ее каталитической активности. Небелковая часть представлена витаминами или катионами d-элементов. Размер. Молекулы ферментов имеют размер коллоидных частиц (1-100 нм), поэтому их относят к ультрамикрогетерогенным катализаторам. В ысокая каталитическая активность. Ничтожно малые количества ферментов способны расщеплять во много раз превышающие количества реагирующих веществ. Например, 1 моль фермента алкогольдегидрогеназы за 1 сек при 25С способствует превращению 720 моль этанола в уксусный альдегид, а 1 моль промышленного катализатора за 1 сек даже при 200С позволяет окислить только 1 моль этанола. Химическая специфичность. Ферменты действуют на определенные субстраты или типы связей. Например, уреаза расщепляет только мочевину, а пепсин (фермент желудочного сока) действует на пептидные связи белков. Влияние внешних условий. По своей природе ферменты значительно более чувствительны к изменению внешних условий, чем неорганические катализаторы. Температурный оптимум большинства растительных ферментов 313-333 К, животных ферментов 313-323 К. Если температура превысит эти пределы, активность фермента очень быстро падает, а при 343-353 К происходит, как правило, их необратимое разрушение, обусловленное денатурацией белка. Инактивация. В процессе протекания каталитической реакции фермент постепенно разрушается и утрачивает свою активность – инактивируется. Чем большей активностью обладает фермент, тем он сильнее разрушается в процессе катализа. Этим свойством ферменты существенно отличаются от неорганических катализаторов, которые остаются без изменения в продуктах реакции. Общие принципы кинетики химических реакций применимы и к ферментативным реакциям, однако у последних имеется важная отличительная особенность – явление насыщения субстратом. Субстрат – объект воздействия фермента. Например, белки являются субстратом для фермента пепсина, крахмал – для амилазы и т.д. При низкой концентрации субстрата скорость реакции возрастает пропорционально концентрации субстрата, т.е. в отношении субстрата реакция имеет I порядок. По мере увеличения концентрации субстрата, скорость реакции растет медленнее, пропорциональность нарушается (реакция смешанного порядка). При дальнейшем увеличении концентрации субстрата, скорость реакции становится постоянной (реакция нулевого порядка). Происходит своего рода «насыщение» фермента субстратом. Исследование эффекта «насыщения» привело Л. Михаэлиса и М. Ментен в 1913 г. к созданию теории действия ферментов: Е   + S k1 ES ES k3 E + P k2 k4 + S k1 ES ES k3 E + P k2 k4где Е – фермент (энзим); S – субстрат; ES – фермент-субстратный комплекс; Р – продукты реакции; k1, k2, k 3, k 4 – константы скорости прямых и обратных реакций. Количественное соотношение между скоростью ферментативной реакции и концентрацией субстрата [S] выражается уравнением Михаэлиса-Ментен: 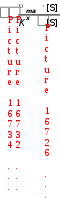 m где max – максимальное значение скорости данной реакции; K  m – «объединенная» константа Михаэлиса, равная k2 k3 при m – «объединенная» константа Михаэлиса, равная k2 k3 при 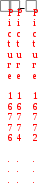 1 max , Km = [S]. k1 2 1 max , Km = [S]. k1 2Зависимость скорости ферментативной реакции от концентрации субстрата представлена на рис. 14. 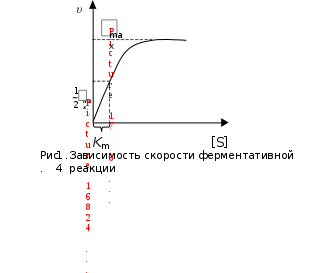 от концентрации субстрата Значение Km равно концентрации субстрата, при которой скорость реакции равна половине своего максимального значения. Примерные значение Km для большинства ферментов от 10–1 до 10–5. Уравнение Михаэлиса-Ментен – отправная точка при любом количественном описании действия ферментов. Л  еонор Михаэлис (1875-1949) – немецкий биохимик и химикорганик, основатель кинетики ферментативных процессов. Родился в Берлине. Окончил Берлинский университет (1896), продолжил образование во Фрейбургском университете (1896-1897). в 18991902 гг. работал в Муниципальной больнице в Берлине; в 19021906 г. – в Институте по исследованию рака (Берлин) и одновре- еонор Михаэлис (1875-1949) – немецкий биохимик и химикорганик, основатель кинетики ферментативных процессов. Родился в Берлине. Окончил Берлинский университет (1896), продолжил образование во Фрейбургском университете (1896-1897). в 18991902 гг. работал в Муниципальной больнице в Берлине; в 19021906 г. – в Институте по исследованию рака (Берлин) и одновре-менно с 1905 г. – в Берлинском университете (с 1908 г. – профессор). В 19221926 гг. – профессор Медицинской школы в г. Нагоя (Япония). В 1926-1929 гг. читал лекции в университете Дж. Хопкинса в Балтиморе (США). С 1929 г. работал в Рокфеллеровском институте медицинских исследований в Нью-Йорке. Основные работы посвящены изучению ферментативных реакций. В 1913 г. ввѐл константу (константа Михаэлиса) в уравнение уравнение зависимости скорости ферментативной реакции от концентрации субстрата в стационарном состоянии (уравнение Михаэлиса – Ментен). Согласно теории Михаэлиса и его сотрудницы Ментен, первым этапом любого ферментативного процесса является обратимая реакция между ферментом (Е) и субстратом (S), приводящая к образованию промежуточного фермент-субстратного комплекса (ES), который затем подвергается практически необратимому расщеплению на продукт реакции (Р) и исходный фермент. Константа Михаэлиса может служить мерой сродства субстрата к ферменту. Показал, что глюкоза в крови находится в свободном состоянии. Выполнил ряд исследований проницаемости клеточных мембран. Изучал семихиноидные свободные радикалы в обратимых окислительных системах. Исследование ферментативных процессов как в норме, так и при патологии необходимо для более глубокого понимания особенностей специфики обменных процессов в организме с целью научиться управлять ими. Достижения энзимологии – учения о ферментах – нашли практическое применение в различных областях народного хозяйства – пищевой, легкой промышленности, сельском хозяйстве и, особенно, в медицине. Возникла новая область медицины – медицинская энзимология, включающая следующие разделы: энзимодиагностику (исследование ферментов в биологических жидкостях и тканях с диагностической и прогностической целью); энзимопатологию (использование ферментов для изучения патогенеза ряда заболеваний); энзимотерапию (применение ферментов, их активаторов и ингибиторов с лечебной целью). Новым направлением энзимотерапии является системная энзимотерапия – применение комбинированных ферментов животного и растительного происхождения перорально.
|
| № пробирки | Температура, (оС) | Время появления помутнения, сек | Относительная скорость | Изменение скорости |
| 1 2 3 | | | | |
Относительная скорость реакции определяется соотношением:
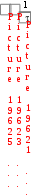 , где
, где 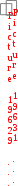 – промежуток времени от момента сливания до появления помутнения в пробирке.
– промежуток времени от момента сливания до появления помутнения в пробирке. Постройте график зависимости относительной скорости реакции от температуры.
Н
имея в виду, что она характеризуется первым порядком по концентрации тиосульфата натрия и нулевым порядком по концентрации серной кислоты.
Сделайте вывод об изменении скорости реакции при повышении температуры на 10 градусов.
Опыт № 2. Зависимость скорости химической реакции от концентрации реагирующих веществ
Оборудование: бюретки на 25,0 мл, штатив с пробирками, градуированные пробирки на 10,0 мл, секундомер.
Реактивы: 1М раствор серной кислоты; 0,1 М раствор Na2S2O3, дистиллированная вода.
Порядок выполнения работы
Возьмите три пронумерованные пробирки (1, 2, 3) и с помощью бюретки внесите 0,1М раствор Na2S2О3: в первую пробирку 3,0 мл, во вторую – 6,0 мл, и в третью – 9,0 мл.
В первую пробирку добавьте из бюретки 6,0 мл воды, во вторую – 3,0 мл воды, а в третью воду не добавляйте.
Во второй комплект пробирок (1, 2, 3) с помощью градуированной пробирки прилейте по 3,0 мл 1М раствора H2SO4.
Слейте содержимое первой пары пробирок (1, 1) в одну, перемешайте реагирующую смесь и засеките время появления помутнения.
В такой же последовательности проведите опыт со второй (2, 2) и третьей (3, 3) парами пробирок.
Данные опыта внесите в таблицу 2 и выполните необходимые расчеты.
Таблица 2
| № пробирки | Объем 0,1М р-ра Na2S2O3, мл | Объем Н2О, мл | Объем 1М р-ра H2SO4, мл | Относительная концентрация р-ра | Время появления помутнения, сек | Относительная скорость |
| 1 2 3 | 3 6 9 | 6 3 0 | 3 3 3 | 1с 2с 3с | | |
Постройте график зависимости относительной скорости реакции от относительной концентрации тиосульфата натрия:
с1=1с; с2=2с; с3=3с.
На основании полученных результатов сделайте вывод о зависимости скорости реакции от концентрации реагирующих веществ.
Опыт № 3. Сравнение каталитического действия различных катализаторов
В основе этого опыта лежит реакция разложения пероксида водорода в присутствии различных катализаторов:
 2Н2О2 катализато р 2Н2О + О2
2Н2О2 катализато р 2Н2О + О2
Опыт № 3.1
Оборудование: градуированные пробирки на 10,0 мл, штатив с пробирками.
Реактивы: 3%-ный раствор Н2О2, железо (стружки), конц. раствор аммиака, кусочки картофеля.
Порядок выполнения работы
В три пробирки внесите с помощью градуированной пробирки по 5,0 мл раствора Н2О2, затем добавьте катализаторы: в первую пробирку – стружки железа, во вторую – кусочек картофеля, в третью – 3-4 капли концентрированного раствора аммиака.
Расположите пробирки в порядке возрастания эффекта (образование пузырьков газа) наблюдаемой реакции.
Перечислите катализаторы в порядке возрастания их каталитической активности.
Сделайте вывод о сравнительном каталитическом действии взятых неорганических и биологического катализаторов на скорость разложения субстрата (Н2О2).
Укажите, в каких случаях наблюдается гомогенный, а в каких – гетерогенный катализ.
Опыт № 3.2
В основе этого опыта лежит реакция перехода Fe(III) в Fe(II) под действием ионов Сu2+ в присутствии восстановителя тиосульфата натрия:
2 Fe(CNS)3 + 2Na2S2O3
 Na2SO4 + 2NaCNS + Fe(CNS)2
Na2SO4 + 2NaCNS + Fe(CNS)2 Оборудование: штатив с пробирками, секундомер.
Реактивы: 0,5М раствор роданида аммония, 0,5М раствор Na2S2O3, 0,5М раствор хлорида железа (III), 0,5М раствор CuSO4.
Порядок выполнения работы
В две пробирки налейте по 5,0 мл 0,5М раствора роданида аммония и по 5-6 капель хлорида железа (III).
В одну из этих пробирок налейте 4-5 капель раствора сульфата меди(II).
В обе пробирки добавьте по 5,0 мл 0,5М раствора тиосульфата натрия и засеките время по секундомеру, необходимое для обесцвечивания растворов в обеих пробирках.
Обратите внимание – в какой пробирке раствор обесцвечивается быстрее? Почему? Ответ поясните.
План оформления отчета:
Дата и название работы.
Цель работы.
Краткое описание проведения опыта.
Результаты полученных опытных данных.
Выводы по работе.
Контрольные вопросы для защиты экспериментальной работы
Что изучает химическая кинетика? Какова ее практическая цель?
Дайте определения и приведите примеры гомогенных и гетерогенных реакций? Как находят их скорости?
От каких факторов зависит скорость химических реакций? Дайте определение закона действующих масс. В равенствах, выражающих этот закон, отражена ли зависимость скорости реакции от природы реагирующих веществ?
Что называют константой скорости? Каков физический смысл этой величины? Зависит ли константа скорости от температуры, природы реагирующих веществ и их концентраций?
Перечислите способы, которыми можно увеличить и уменьшить скорость данной химической реакции.
Какой формулой выражается правило Вант-Гоффа, определяющее зависимость скорости реакции от температуры?
Что называют температурным коэффициентом скорости реакции? Какие он может иметь значения?
Почему повышение температуры увеличивает скорости реакции? Какие молекулы называют активными?
Что называют каталитическими реакциями, катализаторами и ингибиторами?
Какой катализ называют: а) гомогенным, б) гетерогенным?
Каков механизм гомогенного катализа?
Какую роль играют адсорбционные процессы в гетерогенном катализе?
Тема: ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Цели изучения: усвоить сущность химического равновесия, принципа Ле Шателье; научиться рассчитывать константу равновесия, исходные и равновесные концентрации веществ, устанавливать связи между кинетическими и термодинамическими параметрами. Экспериментально изучить смещение химического равновесия под влиянием различных факторов.
 Повторить: обратимые и необратимые химические реакции, химическое равновесие, принцип Ле-Шателье, сдвиг химического равновесия.
Повторить: обратимые и необратимые химические реакции, химическое равновесие, принцип Ле-Шателье, сдвиг химического равновесия. 
Учебно-целевые вопросы
Процессы обратимые и необратимые с точки зрения термодинамики и кинетики.
Химическое равновесие, его динамический характер, равновесные концентрации веществ.
Константа химического равновесия (Kравн) гомогенных и гетерогенных систем. Способы ее выражения: Kс, Kр, Kа.
Факторы, влияющие на величину константы химического равновесия. Связь Kравн и ΔG.
Уравнение изотермы химической реакции Вант-Гоффа, его прогностическое значение.
Сдвиг химического равновесия, прогнозирование его смещения на основе принципа Ле-Шателье.
Особенности обратимых биохимических процессов. Понятие о гомеостазе.
Краткая теоретическая часть
Необратимые реакции – протекают в одном направлении до полного израсходования одного из реагирующих веществ.
Обратимые процессы – протекают одновременно две взаимно противоположные реакции – прямая и обратная. Все обратимые процессы стремятся привести систему в устойчивое равновесное состояние (рис. 15).

А + В С С А + В
Рис. 15. Изменение скорости обратимых реакций Большинство биохимических реакций носят обратимый характер.
Х
 имическое равновесие – такое динамическое состояние обратимого процесса, при котором скорости прямой и обратной реакции равны и которое характеризуется постоянством параметров при постоянных внешних условиях. Кинетическое условие химического равновесия:
имическое равновесие – такое динамическое состояние обратимого процесса, при котором скорости прямой и обратной реакции равны и которое характеризуется постоянством параметров при постоянных внешних условиях. Кинетическое условие химического равновесия:  .
. Термодинамическое условие химического равновесия:
 G = Gmin; G 0
G = Gmin; G 0 S = Smax; S = 0
Состояние химического равновесия имеет следующие особенности: а) динамический характер,
б) подвижность,
в) постоянство состояния химического равновесия во времени при неизменных внешних условиях,
г) возможность подхода к состоянию равновесия, как со стороны исходных веществ, так и со стороны продуктов реакции.
Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются. Состояние химического равновесия количественно характеризуется константой равновесия.
Константа химического равновесия – отношение констант скоростей прямой (k1) и обратной (k2) реакций:
K= k1/ k2
Константа равновесия химической реакции, Kравн, равна отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций реагентов в степенях, равных стехиометрическим коэффициентам – закон действующих масс для химического равновесия:
 аА + bВ сС + dD
аА + bВ сС + dD [C] c [D] d
Kравн = [A] a [B] b ,
где [А], [В], [С], [D] – равновесные концентрации всех веществ системы, которые устанавливаются в ней при наступлении состояния химического равновесия.
Kравн зависит от природы реагирующих веществ и от температуры. Существует три способы выражения константы равновесия: через концентрации Kс, через активности Kа, через парциальные давления для газов Kр.
К
Константа равновесия связана с изменением основных термодинамических характеристик соотношением:
G = – R·T·lnK= – 2,3 R·T·lgK
Т
 ак как G= H – T· S, то R·T·lnK= S – H/T.
ак как G= H – T· S, то R·T·lnK= S – H/T. Б
П
 ри отрицательных значениях G ( G < 0), lgK > 0 и K >1.
ри отрицательных значениях G ( G < 0), lgK > 0 и K >1. Ч
 ем больше отрицательные значения G, тем численно больше константа равновесия и тем сильнее смешается равновесие вправо. Чем больше положительные значения G ( G > 0), тем сильнее оно смещается влево. В предельных случаях исходные вещества практически полностью превращаются в продукты реакции или, наоборот, химически между собой не взаимодействуют.
ем больше отрицательные значения G, тем численно больше константа равновесия и тем сильнее смешается равновесие вправо. Чем больше положительные значения G ( G > 0), тем сильнее оно смещается влево. В предельных случаях исходные вещества практически полностью превращаются в продукты реакции или, наоборот, химически между собой не взаимодействуют. П
Для гетерогенных реакций в выражение для скорости реакций и константы равновесия не входят концентрации веществ, находящихся в твердой фазе. Как постоянные величины они учитываются в значениях соответствующих констант.
Уравнение изотермы Вант-Гоффа связывает направление реакции с исходным составом реагирующих веществ. Это уравнение позволяет определять направление процесса в том случае, когда активности (концентрации) веществ не отвечают стандартному состоянию.
Для реакции aА + bВ
 сС + dD уравнение изотермы имеет вид:
сС + dD уравнение изотермы имеет вид: cd

 Обучающие тесты с решением
Обучающие тесты с решением 
 а) I2 2I; б) 2NO + O2 2NO2;
а) I2 2I; б) 2NO + O2 2NO2;  инетическое уравнение химической реакции показывает зависимость скорости процесса от концентрации компонентов реакционной смеси. Кинетическое уравнение может иметь сложный вид, но если уравнение реакции отражает ее механизм, то скорость является степенной функцией концентрации исходных веществ: = k c(N2)c2(О2)
инетическое уравнение химической реакции показывает зависимость скорости процесса от концентрации компонентов реакционной смеси. Кинетическое уравнение может иметь сложный вид, но если уравнение реакции отражает ее механизм, то скорость является степенной функцией концентрации исходных веществ: = k c(N2)c2(О2)  а) Н2(г) + I2(г) 2НI(г);
а) Н2(г) + I2(г) 2НI(г);  = k c(Н2)c(I2),
= k c(Н2)c(I2),  = k c2(СО) c(О2),
= k c2(СО) c(О2), 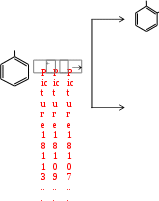 HO о-нитрофенол
HO о-нитрофенол  HNO 3
HNO 3  = 15 cек; c2(O3) = 0,15 моль/л; 2 = 35 cек. Скорость реакции определяется как изменение концентрации участвующего в ней вещества, отнесенной к промежутку времени, за который произошло это изменение, а именно:
= 15 cек; c2(O3) = 0,15 моль/л; 2 = 35 cек. Скорость реакции определяется как изменение концентрации участвующего в ней вещества, отнесенной к промежутку времени, за который произошло это изменение, а именно: 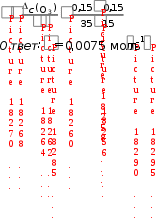 = 0,0075 моль/(лс)
= 0,0075 моль/(лс)  = 0,02 л/(мольс). с(SO 2 ) c(O) 0,25 0,6
= 0,02 л/(мольс). с(SO 2 ) c(O) 0,25 0,6 2(·OH) = 3 c1(·OH); 2 : 1 = ?
2(·OH) = 3 c1(·OH); 2 : 1 = ? 
 : 1 = [k c22(·OH)] : [kc12(·OH)] = .
: 1 = [k c22(·OH)] : [kc12(·OH)] = . 
 n 2 0,6931 k ; k0,1812 сутки.
n 2 0,6931 k ; k0,1812 сутки. 

 2;
2;  2,45 .
2,45 . 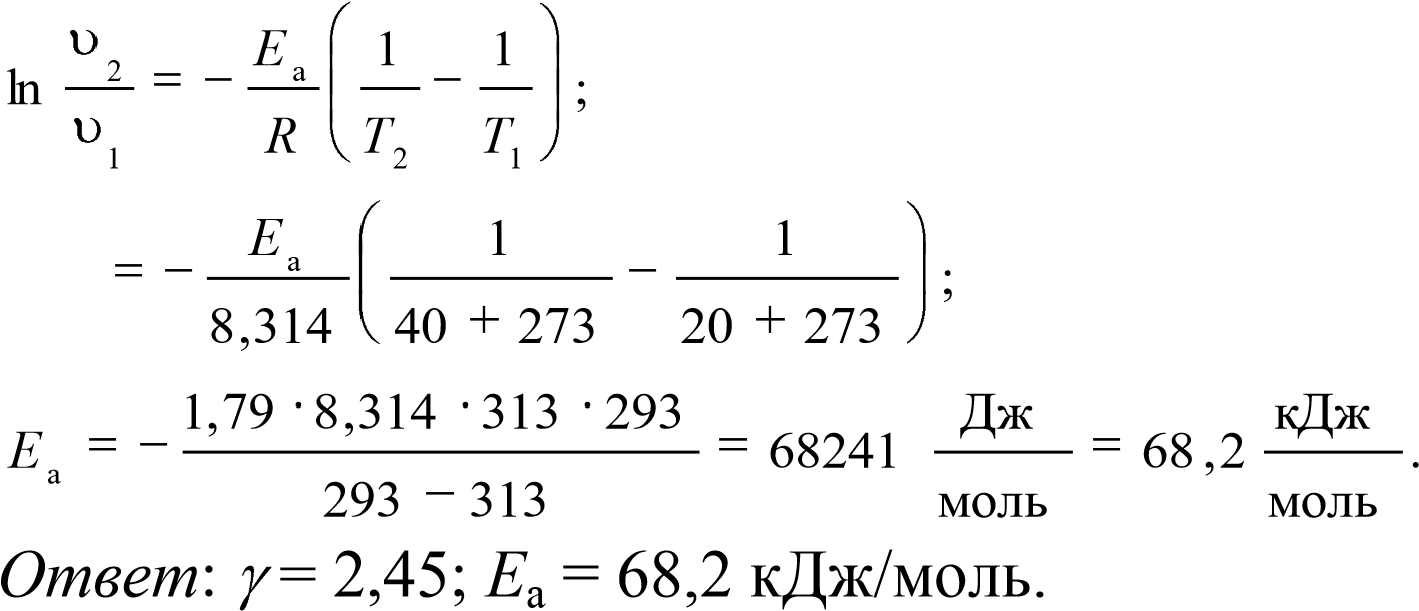 ln 6
ln 6

 аполните химический стакан водой и поставьте в него первую пару пробирок для термостатирования. Через 5 минут измерьте температуру воды в стакане. Слейте растворы в одну пробирку и засеките время до появления помутнения (1).
аполните химический стакан водой и поставьте в него первую пару пробирок для термостатирования. Через 5 минут измерьте температуру воды в стакане. Слейте растворы в одну пробирку и засеките время до появления помутнения (1).  ).
).  ).
).