Учебнометодическое пособие для студентов i курса медицинского вуза Рекомендовано Учебнометодическим объединением по медицинскому и фармацевтическому образованию вузов России в качестве учебного пособия для студентов медицинских вузов
 Скачать 5.49 Mb. Скачать 5.49 Mb.
|
Краткая теоретическая частьОсновные понятия, определения, формулыХ  имическая кинетика – это раздел химии, изучающий механизмы химических реакций, скорости их протекания и влияние различных факторов на скорости химических реакций. имическая кинетика – это раздел химии, изучающий механизмы химических реакций, скорости их протекания и влияние различных факторов на скорости химических реакций. По фазовому состоянию реагирующих веществ все реакции подразделяют на гомогенные и гетерогенные. Гомогенные реакции – протекают при отсутствии поверхности раздела между реагентами по всему объему системы, т.е. в пределах одной фазы, например в смеси газов или веществ в растворе. Примером гомогенной реакции в газовой фазе может служить взаимодействие водорода и йода с образованием йодоводорода: H2(г) + I2 (г) = 2HI(г). Примером гомогенной реакции в растворе является: NaOH(р-р) + HCl(р-р) NaCl(р-р) + Н2О(ж) Гетерогенные реакции – протекают на границе раздела фаз между реагентами, поэтому скорость гетерогенной реакции зависит от концентрации подвижного компонента (газа, растворенного вещества), от площади поверхности раздела фаз, от скорости диффузии подвижного компонента в зону реакции, а продуктов реакции – из этой зоны. Типичные гетерогенные реакции: реакция металлического цинка с раствором хлороводородной кислоты: Zn(т) + 2HCl(р) = H2(г) + ZnCl2(р) реакция образования главного неорганического вещества костной ткани: 5Ca2+(ж) + 3HPO 24 (ж) +4OH-(ж) = Ca5(PO4)3OH(т) +3H2O(ж) При рассмотрении биохимических превращений, протекающих в живом организме, не всегда просто решить, к какому типу относится та или иная реакция. Например, жизненно необходимая реакция образования оксигемоглобина: 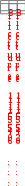 Hb(р) + O2(р) HbO2(р), Hb(р) + O2(р) HbO2(р), обеспечивает снабжение тканей животных кислородом, поступающим в легкие в газообразном состоянии. Эту реакцию можно отнести к гомогенной, так как и гемоглобин и кислород находятся в одной и той же клеточной жидкости эритроцитов в растворенном состоянии. Большое число биохимических превращений протекает внутри биологических мембран или на их поверхности. Например, отдельные стадии биоокисления глюкозы связаны с мембранами клеточных органелл – митохондрий. В этом случае отнесение реакции к гомогенной или гетерогенной зависит от того, к какой фазе относятся мембраны. Характер протекания химического превращения во времени при различных условиях зависит от механизма, с помощью которого осуществляется это превращение. Механизм реакции – это путь превращения исходных веществ в продукты. Одной из главных характеристик механизма является последовательность отдельных стадий реакции. По механизму протекания реакции подразделяются на простые и сложные.  Простые реакции состоят из однотипных элементарных актов Простые реакции состоят из однотипных элементарных актов Число частиц реагентов, взаимодействующих друг с другом в одной элементарной реакции, и превращающихся в продукты называется молекулярностью реакции. По молекулярности различают реакции: 1) мономолекулярные; 2) бимолекулярные; 3) тримолекулярные. К мономолекулярным реакциям типа А В или А В + С относятся процессы распада молекул на более простые вещества, например СН3–С–СН3 С2Н4 + Н2 + СО || O Биомолекулярными называются реакции типа Например, СН3I + CH3CH2ONa CH3OCH2CH3 + NaI Значительно реже встречаются трехмолекулярные реакции А + 2В С или 3А В 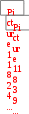 Например, 2NO + O2 2NO2 Например, 2NO + O2 2NO2  Реакции, при протекании которых осуществляются разнотипные элементарные акты, называются сложными реакциями.    последовательные параллельные последовательные параллельные (конкурирующие) циклические сопряженные фотохимические П ример сложной реакции Н2 + I2 2HI, она протекает в две стадии: 1-стадия: I2 2I; 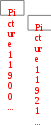 2-стадия: 2I + H2 2HI. 2-стадия: 2I + H2 2HI. Большинство химических и все биохимические реакции являются сложными. По кинетическому механизму все сложные химические реакции подразделяют на два больших класса: последовательные реакции и параллельные (конкурирующие) реакции. Последовательными называются сложные реакции, в которых продукт первой элементарной стадии вступает в реакцию второй стадии, продукт второй стадии вступает в третью и т. д., пока не образуется конечный продукт: А 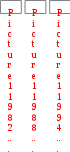 k1 В k2 С k3 D, k1 В k2 С k3 D, где k1, k2, k3 – константы скорости первой, второй и т.д. стадий. В 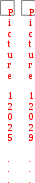 сложных реакциях скорости отдельных стадий могут резко отличаться. В этих случаях скорость сложной реакции определяется скоростью наиболее медленной стадии, называемой лимитирующей стадией = lim. сложных реакциях скорости отдельных стадий могут резко отличаться. В этих случаях скорость сложной реакции определяется скоростью наиболее медленной стадии, называемой лимитирующей стадией = lim. Практически все процессы метаболизма являются последовательными реакциями. Примером может служить метаболизм глюкозы. В биохимии реагент, вступающий в реакцию, называется субстратом. Вещества, образующиеся в промежуточных стадиях, называются промежуточными продуктами или интермедиатами. При метаболизме глюкозы исходным субстратом является глюкоза, интермедиатами – являются глюкоза-6-дифосфат, лактат, пируват и др., конечные продукты диоксид углерода и вода. К последовательным реакциям относится гидролиз белков: Обычный путь лекарственного вещества в организме можно рассматривать так же как последовательность двух процессов: всасывание из желудка в кровь и выведение из крови в мочу. Частным случаем последовательных реакций являются цепные радикальные реакции. Ц  епные реакции – это сложные реакции, в которых превращение исходного субстрата в продукты осуществляется многократным повторение одних и тех же стадий. епные реакции – это сложные реакции, в которых превращение исходного субстрата в продукты осуществляется многократным повторение одних и тех же стадий. Цепные реакции характеризуются возникновением в каждом элементарном акте активной частицы (радикалов, ионов), что вызывает цепь превращений исходных веществ в продукты реакции. Для всех цепных реакций характерны три стадии: зарождение цепи, развитие цепи, обрыв цепи. В организме может иметь место свободнорадикальное окисление, что при низкой интенсивности является метаболически нормальным. К нормальным метаболическим цепным реакциями относится пероксидное окисление липидов, играющее важную роль в жизнедеятельности организма. Основными стадиями этого процесса являются следующие элементарные реакции: R· + O2 → RO2· RO2· + RH → ROOH + R·, где R· – органический радикал, образованный в окислительновосстановительных метаболических реакциях липида RH; RO2· – пероксидный радикал; ROOH – органический пероксид. Радикал R·, образованный во второй стадии, снова вступает в первую стадию и т. д. Таким образом, развивается цепь реакций. Звеном цепи являются две рассмотренные реакции. Свободные радикалы участвуют в процессах клеточного деления, обновления ядерных мембран, однако концентрация радикалов не должна превышать определенную норму. Увеличение содержания свободных радикалов наблюдается в начальной стадии лейкоза, при лучевой болезни и др. Фотохимическиереакции являются частным случаем цепных реакций. Они протекают по цепному механизму и получают необходимую энергию в виде электромагнитных колебаний разной частоты. Например, процесс фотосинтеза происходит в листьях растений под действием солнечной энергии: 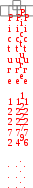 6СО2 + 6Н2О h С6Н12О6 + 6О2 6СО2 + 6Н2О h С6Н12О6 + 6О2 Многие биохимические реакции можно отнести к фотохимическим. Например, заболевание недоношенных новорожденных детей физиологической желтухой обусловлено накоплением в крови билирубина, который из-за недоразвития печени не выводится из организма. Поскольку установлено, что реакция окисления билирубина является фотохимической, а продукты окисления безвредны, то методом лечения физиологической желтухи стало облучение детей определенной дозой световой энергии. К фотохимическим реакциям можно отнести и зрительное восприятие. Родопсин – зрительный пигмент, локализованный в палочках сетчатки глаз. Это сложный белок, состоящий из ретиталя (альдегид витамина А) и опсина (комплекс гликопротеида и липидов). Под действием света родопсин претерпевает цис-трансизомеризацию ретиналя, связь ретиналя с опсином нарушается. В темноте происходит ресинтез родопсина. П  араллельные (конкурирующие) реакции – это сложные реакции, в которых одно и то же вещество А одновременно взаимодействует с одним или несколькими реагентами (B, C, D и т.д.), участвуя в одновременно протекающих реакциях: араллельные (конкурирующие) реакции – это сложные реакции, в которых одно и то же вещество А одновременно взаимодействует с одним или несколькими реагентами (B, C, D и т.д.), участвуя в одновременно протекающих реакциях: 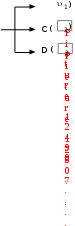 В ( В (А ) Таким образом, эти реакции «конкурируют» друг с другом за реагент А. Многие субстраты и интермедиаты метаболизма участвуют в конкурирующих реакциях. Использование в зависимости от условий различных конкурирующих путей метаболизма позволяет организму осуществлять регулирование процессов жизнедеятельности. Пример конкурирующих реакций:  С2Н4 + Н2О С2Н4 + Н2О С 2Н5ОН СН3СОН + Н2 Скорость конкурирующих реакций рассчитывается как суммарная: 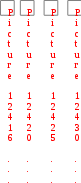 = 1 + 2 + 3 + … = 1 + 2 + 3 + … Помимо двух основных типов – последовательных и конкурирующих реакций – встречаются смешанные типы сложных реакций, например, последовательно-параллельные, сопряженные, циклические. Большинство биохимических реакций являются последовательно-параллельными или циклическими многостадийными процессами. Параллельные реакции, последовательно-параллельные широко представлены в организме. Например, аминокислота тирозин в результате ряда последовательных реакций превращается в адреналин, а параллельные процессы приводят к образованию меланина и фумаровой кислоты. OH OH 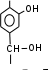  . . . . . .  . . . . . .COOH H2N CH2 NH CH3 тирозин адреналин  меланин фумаровая кислота Ц  иклические реакции – это сложные реакции, в которых одно и то же вещество является исходным реагентом и конечным продуктом реакции: иклические реакции – это сложные реакции, в которых одно и то же вещество является исходным реагентом и конечным продуктом реакции:  А В А В D С С  корость циклических реакций определяется самой медленной стадией = lim . корость циклических реакций определяется самой медленной стадией = lim . Примером циклических реакций является полное окисление ацетильного остатка в организме до СО2 и Н2О, которое осуществляется в цикле трикарбоновых кислот Кребса (рис. 6). С  опряженными реакциями называют такие две реакции, из которых одна вызывает протекание в системе другой реакции, не осуществимой в отсутствие первой. опряженными реакциями называют такие две реакции, из которых одна вызывает протекание в системе другой реакции, не осуществимой в отсутствие первой. Обязательным условием сопряжения является наличие общего реагента (интермедиата). В 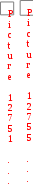 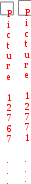 организме термодинамически невыгодные реакции, сопровождающиеся увеличением энергии Гиббса, т.е. G 0, осуществляются путем сопряжения с реакцией, характеризующейся достаточно большим отрицательным значением энергии Гиббса: G 0. организме термодинамически невыгодные реакции, сопровождающиеся увеличением энергии Гиббса, т.е. G 0, осуществляются путем сопряжения с реакцией, характеризующейся достаточно большим отрицательным значением энергии Гиббса: G 0. Большинство биохимических превращений в организме осуществляется в результате сопряжения с процессом метаболического окисления глюкозы. Именно глюкоза является источником энергии, обеспечивающим жизнедеятельность организма.  Рис. 6. Схема превращений в цикле Кребса Одним из основных результатов окисления глюкозы в организме является сопряженный с этим процессом синтез аденозинтрифосфата (АТФ) из аденозиндифосфата (АДФ) и фосфата (Ф) (см. стр. 26). При полном окислении 1 моль глюкозы кислородом в организме может образоваться 38 моль АТФ. Синтезированная АТФ затем участвует в многообразных сопряженных реакциях метаболизма, обеспечивая протекание термодинамически невыгодных процессов. Изучение различных реакций показывает, что скорость превращения может меняться в ходе реакции, т.е. является функцией времени. С 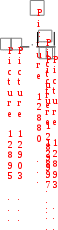  редняя скорость реакции – это усредненная скорость реакции за данный промежуток времени: редняя скорость реакции – это усредненная скорость реакции за данный промежуток времени: 1 ci , vi где vi, – стехиометрический коэффициент вещества в реакции. С  редняя скорость реакции по веществу редняя скорость реакции по веществу И   стинная скорость реакции, , – характеризует скорость реакции в данный момент времени ( стинная скорость реакции, , – характеризует скорость реакции в данный момент времени (И  стинная скорость реакции по веществу, – характеризует скорость по веществу в данный момент времени ( стинная скорость реакции по веществу, – характеризует скорость по веществу в данный момент времени (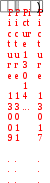  Е диница измерения скорости реакции моль/(лс) для гомогенных реакций. В практике биохимических исследований наряду с молярной концентрацией применяют концентрации по массе (мг/100 мл), по массовой доле (%/100 мл) и др. Единицами измерения скорости будут, соответственно, мг/(100 млс), %/(100 млс) и др. Например, количество осевших эритроцитов из исследуемой пробы крови можно измерить, определяя их массу, однако в клинике удобнее измерять высоту столбика осевших в капилляре эритроцитов, которая пропорциональна их массе. Поэтому скорость оседания эритроцитов (СОЭ) измеряется в мм/ч. Факторы, влияющие на скорость химических реакций1. Природа реагирующих веществПод "природой реагирующих веществ" понимают: Для веществ молекулярного строения – тип химических связей в молекулах реагентов, прочность связей. Чтобы молекула прореагировала, связь в ней необходимо разорвать. Для веществ немолекулярного строения (ионный или атомный кристалл) – строение кристаллической решетки, ее прочность. Для веществ, у которых "молекула" состоит из одного атома (например, металлы, благородные газы) – строение электронной оболочки атома, прочность связывания внешних электронов. Для молекул сложной формы – вероятность благоприятного для реакции взаимного расположения реагентов при соударении. Если соударение на рисунке 7 (а) приведет к реакции, то на рис. 7(б) – нет, с какой бы силой оно ни осуществилось. 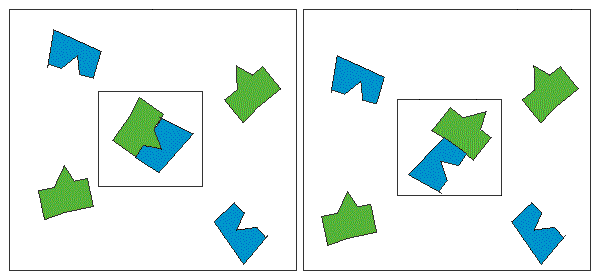 а) б) Рис. 7. Влияние взаимного расположения реагентов: а – реакция происходит; б – реакция невозможна Последний фактор называетсястерическим, илигеометрическим. Он особенно значим для реакций с участием таких больших молекул, как, например, белки. Многие их реакции происходят лишь в присутствии ферментов. Одна из функций ферментов как раз состоит в придании реагентам определенной конфигурации, удобной для взаимодействия. Примерами влияния природы реагирующих веществ являются следующие реакции: Н2 +I22НI (медленно)  + + ОН– Н2О (мгновенно) + + ОН– Н2О (мгновенно) Н О2 + О О3 (очень быстро) Н• + Cl• HCl (очень быстро) 2. Концентрация реагентовЧтобы вещества прореагировали, необходимо, чтобы их молекулы столкнулись. Вероятность столкновения двух людей на оживленной улице гораздо выше, чем на пустынной. Так и с молекулами. Очевидно, что вероятность столкновения молекул на рис. 8 (а) выше, чем на рис. 8 (б). Она прямо пропорциональна количеству молекул реагентов в единице объема, т.е. молярным концентрациям реагентов.  а) б) Рис. 8. Зависимость скорости реакции от концентрации реагентов В середине XIX в. (1865 г. – Н.Н. Бекетов, 1867 г. – К. Гульдберг,П. Вааге) был сформулирован основной постулат химической кинетики, называемый также законом действующих масс:  Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в некоторые степени: Для реакции aA + bB = dD + еЕ |
