Взаимосвязь термодинамических величин
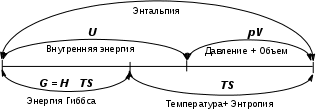 Н = U + pV
Н = U + pV 
Система самопроизвольно стремится к минимуму энергии и максимуму энтропии.
 G = H T S = Gкон. Gнач.
G = H T S = Gкон. Gнач. С

ледовательно,
термодинамический критерий G характеризует:
G 0
0 – экзэргонические (самопроизвольные) процессы или реакции;
G
 0
0 – эндэргонические процессы или реакции, для протекания которых необходимо затратить энергию;
G = 0 – химическое равновесие.
Особенности термодинамики биохимических процессов
1. Живые организмы не избегли подчинения законам термодинамики. В соответствии с первым законом термодинамики живые организмы не могут ни создавать энергию из ничего, ни уничтожать ее, они могут только преобразовывать одну форму энергии в другую. При этом организмы потребляют из окружающей среды энергию в той форме, в которой они могут использовать ее в конкретных условиях температуры и давления, а затем возвращают в среду эквивалентное количество энергии в другой форме, менее пригодной для них.
Живые организмы – открытые системы, находящиеся в неравновесном состоянии по отношению к окружающей среде. Термодинамическое равновесие для живого организма означало бы состояние смерти. В связи с этим организм «выбирает» стационарное состояние.
Стационарное состояние достигается уравновешенным притоком и оттоком веществ и энергии.
Изменение энтропии (человек + окружающая среда) в стационарном состоянии равно сумме изменения энтропии организма и среды:


 Sобщ. = Sчел. + Sсреды > 0
Sобщ. = Sчел. + Sсреды > 0

Суммарное изменение энтропии, необходимое для формирования человеческого организма и поддержания его жизни или существования любой другой живой системы всегда положительно.
В


 организм поступают вещества с низким значением энтропии (белки, полисахариды), а выделяется большое количество продуктов, увеличивающих энтропию окружающей среды (Н2
организм поступают вещества с низким значением энтропии (белки, полисахариды), а выделяется большое количество продуктов, увеличивающих энтропию окружающей среды (Н2О, СО
2, NH
3 и т.д.). Процессы с отрицательным и положительным значением
S взаимосвязаны: окисление глюкозы в процессе дыхания (
S 0) и синтез АТФ за счет выделившейся при окислении глюкозы энергии (
S 0). Процессы роста и развития (усложнения) организма сопровождаются уменьшением энтропии, однако, это происходит так, что изменение общей энтропии (
Sчел. +
Sсреды) положительно, но возрастает с минимальной скоростью.
Живые организмы поддерживают присущую им упорядоченность за счет увеличения энтропии внешней среды.
Жизнь – это постоянная борьба против тенденции к возрастанию энтропии организма, но так как избежать этого возрастания нельзя, живые организмы выбрали наименьшее «зло» – стационарное состояние, в котором скорость возрастания энтропии минимальна.
П
 роизводство энтропии системой, находящейся в стационарном состоянии, стремится к минимуму (принцип И. Пригожина
роизводство энтропии системой, находящейся в стационарном состоянии, стремится к минимуму (принцип И. Пригожина): Δ
S min .
Δ
τЖивая клетка – изотермическая химическая машина. Энергию,
которую клетки поглощают из внешней среды, они получают в форме химической энергии, которая затем преобразуется для выполнения химической работы, совершаемой в процессе биосинтеза клеточных компонентов, а также осмотической работы, необходимой для транспорта веществ в клетку, и механической работы сокращения и передвижения.
2. Принцип энергетического сопряжения биохимических реакций
В


живых системах эндэргонические реакции (
Gр-
ции 
0) сопряжены с экзэргоническими (
Gр-ции 0). Для сопряжения энд- и экзэргонических процессов необходимо наличие общего промежуточного соединения и чтобы на всех стадиях сопряженных реакций суммарный процесс характеризовался :

сопряж.р ций 0.
Пример энергетического сопряжения.
г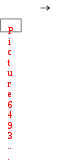
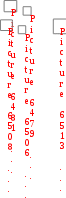 люкоза + фруктоза сахароза + Н2О; Gрo ции I =+20,9 кДж/моль
люкоза + фруктоза сахароза + Н2О; Gрo ции I =+20,9 кДж/моль
АТФ + Н2О АДФ + Ф; Gрo ции II = 30,5 кДж/моль. Эти две реакции I и II сопряжены за счет образования при совместном протекании общего промежуточного соединения глюкозо1-фосфат - интермедиата.
Суммарный процесс:
А

ТФ + глюкоза + фруктоза сахароза + АДФ + Ф
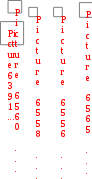 Gрo ции I II
Gрo ции I II = 29,2 кДж/моль;
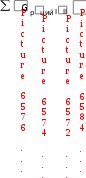
0.
Обратите внимание! Связи, по которым гидролиз проходит с большой убылью энергии Гиббса, в биохимии принято называть макроэргическими. Этот термин нельзя трактовать как «богатую энергией связь».
Для разрыва химической связи всегда требуется затрата энергии. Представление о том, что процесс расщепления связи поставляет энергию для химической работы, не имеет физического смысла. Необходимая для энергетического сопряжения энергия высвобождается в результате перегруппировки атомов в реагентах, среди которых имеется один с макроэргической связью.
Внутренним источником энергии в живых системах являются фосфорилированные соединения (АТФ, креатинфосфат и другие), при взаимодействии которых с биосубстратами, включая воду, выделяется энергия, необходимая для протекания важных для организма эндэргонических процессов.
Термодинамические особенности живых организмов объясняют его устойчивость, позволяющую много лет сохранять работоспособность на определенном уровне, а также относительное постоянство внутренней среды –
гомеостаз. 3. Многостадийность, обратимость
Д ругая особенность биохимических процессов, протекающих в организме, заключается в их многостадийности, так как вероятность обратимого протекания отдельной стадии значительно выше, чем всего процесса в целом (рис. 2). Это объясняется тем, что разница между величинами Gнач
ругая особенность биохимических процессов, протекающих в организме, заключается в их многостадийности, так как вероятность обратимого протекания отдельной стадии значительно выше, чем всего процесса в целом (рис. 2). Это объясняется тем, что разница между величинами Gнач и
Gкон для каждой отдельной стадии обычно невелика (|
Gр| 10 Дж/моль). Обратимость отдельных стадий биохимических процессов позволяет живому организму легко регулировать синтез тех или иных соединений в зависимости от потребности и тем самым поддерживать стационарное состояние.
Вероятность прямой реакции тем больше, чем больше уменьшение энергии Гиббса.
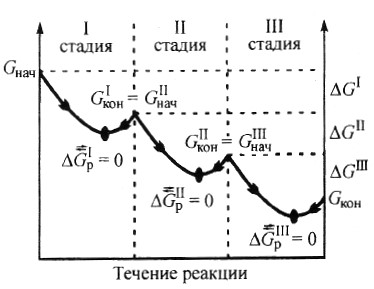
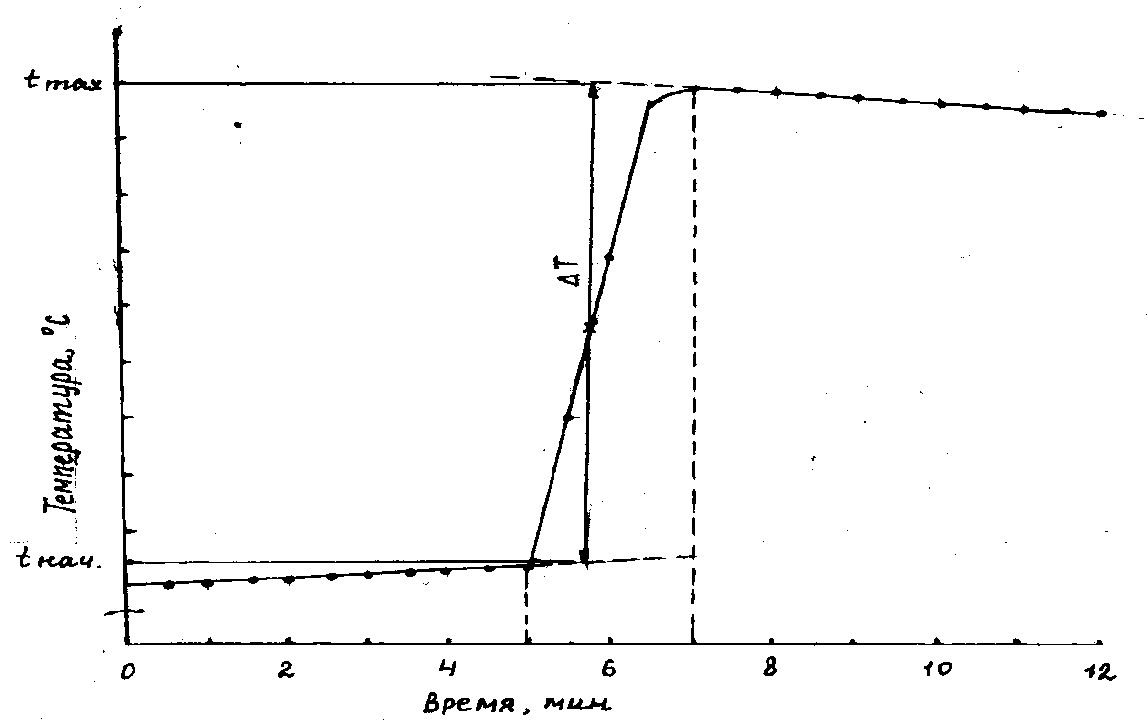
Рис. 3. Изменение энергии Гиббса в многостадийном биохимическом процессе (р, Т = const)
4. Гомеостаз
В живых организмах некоторые процессы и реакции протекают в условиях, близких к равновесным (например, протолитические, гетерогенные, лигандообменные, окислительно-восстановительные, адсорбционные). В связи с этим в организме поддерживаются различные балансы: кислотно-основной, гетерогенный, лигандообменный, окислительно-восстановительный, что в целом и определяет
гомеостаз. С амое замечательное свойство химических реакций, протекающих в живых клетках, которое в конечном итоге и делает возможным успешное функционирование клеток в качестве химических машин, состоит в том, что реакции катализируемые ферментами, протекают со 100%-ным выходом и не сопровождаются образованием побочных продуктов
амое замечательное свойство химических реакций, протекающих в живых клетках, которое в конечном итоге и делает возможным успешное функционирование клеток в качестве химических машин, состоит в том, что реакции катализируемые ферментами, протекают со 100%-ным выходом и не сопровождаются образованием побочных продуктов.
 Обучающие тесты с решением
Обучающие тесты с решением
Если система обратимым образом получает количество теплоты Q при температуре Т, то об энтропии системы можно сказать, что она …
в озрастает на величину QT 2) возрастает на величину Q/T
возрастает на величину, большую Q/T
возрастает на величину, меньшую Q/T
Ответ: Энтропия – это приведенная теплота:
S =
Q/
T. В соответствии со II началом термодинамики для необратимого самопроизвольного процесса в изолированной системе энтропия возрастает, т.е. Δ
S >
Qнеобр./
Т.
При обратимом процессе в изолированной системе энтропия остается постоянной, т.е. Δ
S =
Qобр./
Т.
Правильный ответ 2.
Укажите, в каких процессах и при каких условиях изменение энтропии может быть равно работе процесса?
в изобарных, при постоянных Р и Т
в изохорных, при постоянных V и Т
изменение энтропии никогда не равно работе
в изотермических, при постоянных P и V
Ответ: Энтропия характеризует ту часть энергии, которую нельзя превратить в работу (связанная энергия), и отражает стремление системы к максимуму беспорядка. Поэтому ни для каких процессов изменение энтропии не может быть равно работе.
Правильный ответ 3.
Е
 сли Н < 0 и S < 0, то в каком случае реакция может протекать самопроизвольно?
сли Н < 0 и S < 0, то в каком случае реакция может протекать самопроизвольно?
[

 H] > [T S] 3) [ Н] < [T S]
H] > [T S] 3) [ Н] < [T S]
п ри любых соотношениях Н и Т S 4) [ Н] = [T S] Ответ: При постоянстве температуры и давления химические реакции могут самопроизвольно протекать только в таком направлении, при котором энергия Гиббса системы уменьшается (ΔG < 0). В изобарно-изотермических условиях изменение энергии Гиббса равно: ΔG = ΔH – TΔS.
ри любых соотношениях Н и Т S 4) [ Н] = [T S] Ответ: При постоянстве температуры и давления химические реакции могут самопроизвольно протекать только в таком направлении, при котором энергия Гиббса системы уменьшается (ΔG < 0). В изобарно-изотермических условиях изменение энергии Гиббса равно: ΔG = ΔH – TΔS.
Е сли Δ
H < 0 и Δ
S < 0, то реакция возможна при условии, что Δ
H больше по абсолютной величине, чем
TΔ
S ( |Δ
H| > |
TΔ
S| ).
Правильный ответ 1.
П ри каких соотношениях Н и Т S химический процесс направлен в сторону эндотермической реакции:
ри каких соотношениях Н и Т S химический процесс направлен в сторону эндотермической реакции:
Н
 < T S 2) Н > Т S 3) Н = Т S 4) Н Т S
< T S 2) Н > Т S 3) Н = Т S 4) Н Т S
О твет: Для ответа на вопрос воспользуется предыдущими рассуждениями. Для самопроизвольного протекания процесса необходимо, чтобы энергия Гиббса системы уменьшалась, Δ
G < 0. Для эндотермических процессов Δ
H > 0, поэтому такие процессы будут идти самопроизвольно, если энтропия системы будет увеличиваться, т.е. |Δ
H| < |
TΔ
S|.
Правильный ответ 1.
Д
 ля процесса тепловой денатурации многих ферментов Н > 0 и S > 0. Может ли данный процесс протекать самопроизвольно?
ля процесса тепловой денатурации многих ферментов Н > 0 и S > 0. Может ли данный процесс протекать самопроизвольно?
м ожет при высоких температурах, так как |Т S| > | Н|
ожет при высоких температурах, так как |Т S| > | Н|
может при низких температурах, так как |Т S| < | Н|
н е может, так как |Т S| > | Н|
е может, так как |Т S| > | Н|
не может, так как |Т S| < | Н|
О твет: Для самопроизвольного протекания реакции, необходимо, чтобы энергия Гиббса системы уменьшалась, Δ
G < 0. Поскольку Δ
H > 0 и Δ
S > 0, то из уравнения: Δ
G = Δ
H –
TΔ
S, следует, что при низких температурах значение
TΔ
S мало и знак Δ
G определяется знаком Δ
H. Так как процесс эндотермический Δ
H > 0, то самопроизвольно реакция будет протекать только при высокой температуре. В этом случае |
TΔ
S| > |Δ
H|.
Правильный ответ 1.
О бучающие задачи с решением
бучающие задачи с решением
1. По стандартным энтальпиям образования реагирующих веществ и продуктов реакции вычислите значение энтальпии реакции гидролиза мочевины, одного из важнейших продуктов жизнедеятельности организма:
С
О(NH
2)
2(водн.) + Н
2О(ж) СО
2(водн.) + 2NH
3(водн.)
Решение: По таблице термодинамических величин (табл. 2 приложения) находим значения стандартных энтальпий образования всех веществ, участвующих в реакции:
Нообр(СО2) = 413,6 кДж/моль;
Нообр(NH
3) = 79,9 кДж/моль;
Н
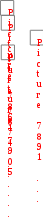 ообр
ообр(СО(NH
2)
2) = 319,2 кДж/моль;
Нообр(H
2O) = 286 кДж/моль.
Для решения используем 1-е следствие из закона Гесса:
Н
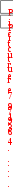

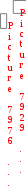


ор-ции=[
Нообр(СО2)+2
Нообр(NH3)]–[
Нообр(СО(NH2)2)+ Нообр(H2O)]
Нор-ции= [–413,6 + 2 (–79,9)] – [(–319,2) – (–286)] = +31,8 кДж/моль.
Ответ: энтальпия реакции гидролиза мочевины до оксида углерода(IV) и аммиака равна +31,8 кДж/моль, процесс эндотермический.
2. Определите тепловой эффект реакции образования диэтилового эфира, применяемого в медицине для наркоза, по стандартным энтальпиям сгорания веществ, участвующих в реакции:
2

С2Н5ОН(ж) С2Н5ОС2Н5(ж) + Н2О(ж).
Решение: По таблице термодинамических величин находим значения стандартных энтальпий сгорания:
Н осгор
осгор(С2Н5ОС2Н5) = 2727 кДж/моль;
Н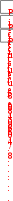 осгор
осгор(С2Н5ОН) = 1371 кДж/моль;
Носгор(Н2О) = 0 кДж/моль.
Д

ля решения используем 2-е следствие из закона Гесса:
Нор-ции = 2
Носгор(С2Н5ОН) [
Носгор(С2Н5ОС2Н5)
Носгор(Н2О)];
Нор-ции = [2 ( 1371)] [( 2727) 0] = 15 кДж/моль.
О твет: тепловой эффект реакции образования диэтилового эфира составляет 15 кДж/моль.
3. Рассчитайте изменение энтропии, энергии Гиббса и энтальпии в процессе усвоения в организме человека сахарозы, который сводится к ее окислению:
С

12Н22О11(к) + 11О2(г) 12СО2(г) + 11Н2О(ж)
Решение: По таблице термодинамических величин находим значения стандартных энтальпий, энтропий и свободных энергий Гиббса для всех веществ, участвующих в реакции:
Н ообр(С12Н22О11) = 2222 кДж/моль;
Нообр(О2) = 0 кДж/моль;
Н
 ообр
ообр(СО2) = 393 кДж/моль;
Нообр(Н2О) = 286 кДж/моль;
S ообр(С
12Н
22О
11) = +360 Дж/мольК;
S ообр
ообр(О2) = +205 Дж/моль К;
Sообр(Н2О) = +70 Дж/моль К;
Sообр(СО2) = +214 Дж/моль К;
G ообр(С12Н22О11) = 1545 кДж/моль;
G
 ообр
ообр(О2) = 0 кДж/моль;
Gообр(СО
2) = 394 кДж/моль;
G
ообр(Н2О) = 237 кДж/моль.
Используя 1-е следствие из закона Гесса, рассчитываем искомые величины:
Н

ор-ции = [12
Нообр(СО2) + 11
Нообр(Н2О)] –
[ Нообр(С12Н22О11) + 11 Нообр(О2)]
Н ор-ции
ор-ции = [12 (–393) + 11 (–286)] – [–2222 + 110] = –5676 кДж/моль;
S ор
ор-
ции = [12
Sообр(СО2) + 11
Sообр(Н2О)] –
[Sообр(С12Н22О11) + 11Sообр(О2)] =
S ор-ции
ор-ции = [12214 + 1170] – [360 + 11205] = +723 Дж/мольК;
G
ор-ции = [12
Gообр(СО2) + 11
Gообр(Н2О)] –
[ Gообр(С12Н22О11) + 11 Gообр(О2)] =
Gообр(С12Н22О11) + 11 Gообр(О2)] =
G ор-ции
ор-ции=[12 (–394)+ 11(–237)] – [( 1545) + 110] = –5790 кДж/моль.
О
твет:
Нор-
ции = 5676 кДж/моль;
Sор-
ции = +723 Дж/мольК;
Gор-
ции = 5790 кДж/моль.
Проверьте, нет ли угрозы, что оксид азота(I) применяемый в медицине в качестве наркотического средства, будет окисляться кислородом воздуха до весьма токсичного оксида азота(II): 2N2О(г) + О2(г) = 4NO(г). Решение:
Для ответа на поставленный в задаче вопрос необходимо рассчитать изменение энергии Гиббса для предполагаемой реакции, воспользовавшись значениями стандартных энергий Гиббса из таблицы термодинамических величин:



 Gо
Gо = 4
Gообр(NO) – 2
Gообр(N
2O) = 487 – 2104 = 140 кДж/моль.
Ответ: так как
Gо 0, реакция при заданных условиях не пойдет.
Энтальпия сгорания глюкозы равна –2802 кДж/моль при 298 К. Сколько г глюкозы нужно израсходовать, чтобы подняться по лестничному проему на 3 м. Принять, что в полезную работу можно обратить 25% энтальпии.
Решение: Максимальная полезная работа, которая может быть совершена человеком в результате окисления 1 г глюкозы кислородом (с учетом КПД организма), равна:
А

max =
n(С6Н12О6)
Нсгор.(С6Н12О6)
1 г
А max = 2802 кДж/моль0,25 = 3,89 кДж.
180 г/моль
Работа, необходимая для подъема человека массой 70 кг на высоту 3 м, составляет:
А

=
m q h = 70 кг 9,8 кг/с
2 3 м = 2058 Дж = 2,058 кДж.
Следовательно, если окисляется 1 г глюкозы, то полезная работа равна 3,89 кДж, а если полезная работа равна 2,058 кДж, то необходима глюкоза массой:
m(С
6Н
12О
6) =
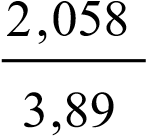
= 0,529 г.
Ответ: необходимо израсходовать 0,529 г глюкозы.
Человек в теплой комнате съедает 100 г сыра (энергетическая ценность его составляет 15,52 кДж/г). Если предположить, что в организме не происходит накопление энергии, то какую массу воды он выделит, чтобы установилась первоначальная температура?
Решение: Потоотделение охлаждает тело, поскольку для испарения воды требуется энергия. Мольная энтальпия парообразования воды равна 44 кДж/моль. Испарение воды происходит при постоянном давлении, поэтому можно приравнять энтальпию испарения воды к количеству теплоты, которую необходимо выделить:
Q

=
n(H
2O)
Hисп(Н
2О).
Энергия, получаемая при усвоении сыра составляет:
Q =
m(сыра)
Кал (сыра) = 100 г 15,52 кДж/г = 1552 кДж.
Тогда количество и масса воды, которые необходимо выделить равны:
Q
1552 кДж
n(H
2O) = = 35,3 моль;
Δ
Hисп 44 кДж/моль
m(Н
2О) =
n(H
2O)
М(Н
2О) = 35,3 моль 18 г/моль = 635 г.
Ответ: необходимо выделить 635 г воды.
7 . Рассчитайте энтальпию гидратации сульфата натрия, если известны энтальпии растворения безводной соли Na
2SO
4(к) (–23 кДж/моль) и кристаллогидрата Na
2SO
410Н
2О(к)
(78,6 кДж/моль).
Решение: При растворении безводной соли происходит ее гидратация и последующее растворение кристаллогидрата в воде. Эти процессы могут быть выражены с помощью треугольника Гесса и следующих термодинамических уравнений:
N

a
2SO
4(к) + 10Н
2О(ж) = Na
2SO
410Н
2О(к);
Н1 = ?
N

a
2SO
410Н
2О(к)+Н
2О(ж)= Na
2SO
4(р-р);
Н2 = +78,6 кДж/моль
N

a
2SO
4(к)+ Н
2О(ж)= Na
2SO
4(р-р);
Н3 = –2,3 кДж/моль
Na2SO4 10H
. 2O
H1 H2Na2SO4(к)
H3 Na2SO4(р-р)
В соответствии с законом Гесса энтальпия процесса растворения безводной соли ( Н3
соответствии с законом Гесса энтальпия процесса растворения безводной соли ( Н3) будет равна сумме энтальпий гидратации безводной соли до кристаллогидрата (
Н1) и энтальпии растворения кристаллогидрата (
Н2):
Н3 =
Н1 +
Н2.
Поэтому энтальпия гидратации Na
2SO
4 будет равна:
Н 1
1 =
Н3 Н2 = 2,3 78,6 = –80,9 кДж/моль.
Ответ: энтальпия гидратации сульфата натрия –80,9 кДж/моль.
П ри растворении 715 г кристаллической соды Na2CO310Н2О было поглощено 167,36 кДж тепла. Какова теплота растворения кристаллогидрата.
Решение: Энтальпией растворения называют тепловой эффект растворения 1 моль вещества в столь большом объеме растворителя, при котором дальнейшее прибавление последнего не вызывает дополнительных тепловых эффектов.
715 г
n (Na2CO3 10Н2О) =
 286 г/моль
286 г/моль = 2,5 моль;
Δ
HН

ораств-я(Na2CO310Н2О) =
n(Na 2CO 3 10H 2O) ;
Н ораств
ораств-
я(Na
2CO
3 10Н2О)=
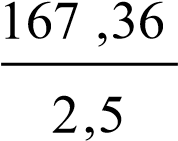
= 66,94 кДж/моль.
О твет: теплота растворения Na
2CO
310Н
2О равна 66,94 кДж/моль.
Э нтальпия растворения NH4NO3 в воде равна 26,7 кДж/моль. На сколько градусов понизится температура при растворении 20 г NH4NO3 в 180 г Н2О, если удельную теплоемкость раствора принять равной 3,76 Дж/(гград)?
 Ответ
Ответ: температура раствора понизится на 8,9 градуса.

Учебно-исследовательская лабораторная работа «Определение теплового эффекта процесса растворения безводной соли» Цели работы:
Научиться экспериментально определять энтальпию растворения безводной соли с использованием калориметра.
Научиться теоретически рассчитывать энтальпию растворения вещества, используя закон Гесса.
Оборудование: 1. Калориметр. 2. Термометр. 3. Цилиндр мерный.
Реактивы: навеска безводной соли карбоната натрия.
Порядок выполнения работы: Опыт проводится в упрощенном калориметре (рис. 4).
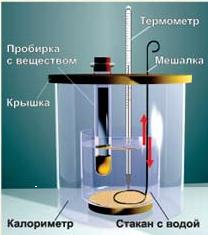
Рис. 4. Схема калориметра
Воздушная прослойка между двумя сосудами калориметра обеспечивает теплоизоляцию внутреннего сосуда, в котором происходит растворение вещества.
Отмерьте 50,0 мл дистиллированной воды с помощью цилиндра и перенесите во внутренний сосуд калориметра. Опустите в воду термометр и записывайте показания термометра с точностью до 0,1оС через 30 с в течение 5 мин.
 Скачать 5.49 Mb.
Скачать 5.49 Mb. Н = U + pV
Н = U + pV 
 G = H T S = Gкон. Gнач.
G = H T S = Gкон. Gнач.  0 – экзэргонические (самопроизвольные) процессы или реакции;
0 – экзэргонические (самопроизвольные) процессы или реакции; 




 роизводство энтропии системой, находящейся в стационарном состоянии, стремится к минимуму (принцип И. Пригожина): ΔS min .
роизводство энтропии системой, находящейся в стационарном состоянии, стремится к минимуму (принцип И. Пригожина): ΔS min . 
 сопряж.р ций 0.
сопряж.р ций 0. 
 люкоза + фруктоза сахароза + Н2О; Gрo ции I =+20,9 кДж/моль
люкоза + фруктоза сахароза + Н2О; Gрo ции I =+20,9 кДж/моль  Gрo ции I II = 29,2 кДж/моль;
Gрo ции I II = 29,2 кДж/моль;  0.
0.  ругая особенность биохимических процессов, протекающих в организме, заключается в их многостадийности, так как вероятность обратимого протекания отдельной стадии значительно выше, чем всего процесса в целом (рис. 2). Это объясняется тем, что разница между величинами Gнач и Gкон для каждой отдельной стадии обычно невелика (| Gр| 10 Дж/моль). Обратимость отдельных стадий биохимических процессов позволяет живому организму легко регулировать синтез тех или иных соединений в зависимости от потребности и тем самым поддерживать стационарное состояние.
ругая особенность биохимических процессов, протекающих в организме, заключается в их многостадийности, так как вероятность обратимого протекания отдельной стадии значительно выше, чем всего процесса в целом (рис. 2). Это объясняется тем, что разница между величинами Gнач и Gкон для каждой отдельной стадии обычно невелика (| Gр| 10 Дж/моль). Обратимость отдельных стадий биохимических процессов позволяет живому организму легко регулировать синтез тех или иных соединений в зависимости от потребности и тем самым поддерживать стационарное состояние. 
 амое замечательное свойство химических реакций, протекающих в живых клетках, которое в конечном итоге и делает возможным успешное функционирование клеток в качестве химических машин, состоит в том, что реакции катализируемые ферментами, протекают со 100%-ным выходом и не сопровождаются образованием побочных продуктов.
амое замечательное свойство химических реакций, протекающих в живых клетках, которое в конечном итоге и делает возможным успешное функционирование клеток в качестве химических машин, состоит в том, что реакции катализируемые ферментами, протекают со 100%-ным выходом и не сопровождаются образованием побочных продуктов.  Обучающие тесты с решением
Обучающие тесты с решением 
 H] > [T S] 3) [ Н] < [T S]
H] > [T S] 3) [ Н] < [T S]  ри любых соотношениях Н и Т S 4) [ Н] = [T S] Ответ: При постоянстве температуры и давления химические реакции могут
ри любых соотношениях Н и Т S 4) [ Н] = [T S] Ответ: При постоянстве температуры и давления химические реакции могут  ри каких соотношениях Н и Т S химический процесс направлен в сторону эндотермической реакции:
ри каких соотношениях Н и Т S химический процесс направлен в сторону эндотермической реакции: 
 < T S 2) Н > Т S 3) Н = Т S 4) Н Т S
< T S 2) Н > Т S 3) Н = Т S 4) Н Т S  ожет при высоких температурах, так как |Т S| > | Н|
ожет при высоких температурах, так как |Т S| > | Н|  е может, так как |Т S| > | Н|
е может, так как |Т S| > | Н|  бучающие задачи с решением
бучающие задачи с решением 
 ообр(СО(NH2)2) = 319,2 кДж/моль; Нообр(H2O) = 286 кДж/моль.
ообр(СО(NH2)2) = 319,2 кДж/моль; Нообр(H2O) = 286 кДж/моль. 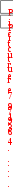
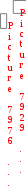
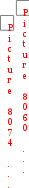 осгор(С2Н5ОС2Н5) = 2727 кДж/моль;
осгор(С2Н5ОС2Н5) = 2727 кДж/моль; 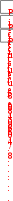 осгор(С2Н5ОН) = 1371 кДж/моль; Носгор(Н2О) = 0 кДж/моль.
осгор(С2Н5ОН) = 1371 кДж/моль; Носгор(Н2О) = 0 кДж/моль. 
 ля решения используем 2-е следствие из закона Гесса: Нор-ции = 2 Носгор(С2Н5ОН) [ Носгор(С2Н5ОС2Н5) Носгор(Н2О)]; Нор-ции = [2 ( 1371)] [( 2727) 0] = 15 кДж/моль.
ля решения используем 2-е следствие из закона Гесса: Нор-ции = 2 Носгор(С2Н5ОН) [ Носгор(С2Н5ОС2Н5) Носгор(Н2О)]; Нор-ции = [2 ( 1371)] [( 2727) 0] = 15 кДж/моль. 
 ообр(СО2) = 393 кДж/моль;
ообр(СО2) = 393 кДж/моль;  ообр(О2) = +205 Дж/моль К;
ообр(О2) = +205 Дж/моль К; 
 ообр(О2) = 0 кДж/моль; Gообр(СО2) = 394 кДж/моль;
ообр(О2) = 0 кДж/моль; Gообр(СО2) = 394 кДж/моль; 
 ор-ции = [12 Нообр(СО2) + 11 Нообр(Н2О)] –
ор-ции = [12 Нообр(СО2) + 11 Нообр(Н2О)] –  Gообр(С12Н22О11) + 11 Gообр(О2)] =
Gообр(С12Н22О11) + 11 Gообр(О2)] = 
 твет: Нор-ции = 5676 кДж/моль; Sор-ции = +723 Дж/мольК; Gор-ции = 5790 кДж/моль.
твет: Нор-ции = 5676 кДж/моль; Sор-ции = +723 Дж/мольК; Gор-ции = 5790 кДж/моль. 

 max = n(С6Н12О6) Нсгор.(С6Н12О6)
max = n(С6Н12О6) Нсгор.(С6Н12О6)  = m q h = 70 кг 9,8 кг/с2 3 м = 2058 Дж = 2,058 кДж.
= m q h = 70 кг 9,8 кг/с2 3 м = 2058 Дж = 2,058 кДж.  = n(H2O) Hисп(Н2О).
= n(H2O) Hисп(Н2О).  1552 кДж n(H 2O) = = 35,3 моль;
1552 кДж n(H 2O) = = 35,3 моль;  соответствии с законом Гесса энтальпия процесса растворения безводной соли ( Н3) будет равна сумме энтальпий гидратации безводной соли до кристаллогидрата ( Н1) и энтальпии растворения кристаллогидрата ( Н2): Н3 = Н1 + Н2.
соответствии с законом Гесса энтальпия процесса растворения безводной соли ( Н3) будет равна сумме энтальпий гидратации безводной соли до кристаллогидрата ( Н1) и энтальпии растворения кристаллогидрата ( Н2): Н3 = Н1 + Н2.  1 = Н3 Н2 = 2,3 78,6 = –80,9 кДж/моль.
1 = Н3 Н2 = 2,3 78,6 = –80,9 кДж/моль.  286 г/моль = 2,5 моль;
286 г/моль = 2,5 моль;  ораств-я(Na2CO310Н2О) = n(Na 2CO 3 10H 2O) ;
ораств-я(Na2CO310Н2О) = n(Na 2CO 3 10H 2O) ; 


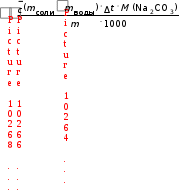 , кДж/моль
, кДж/моль  Na2СO3 Hтеор. Na2СO3(aq)
Na2СO3 Hтеор. Na2СO3(aq)
 0. Рассчитайте абсолютную и относительную ошибки определения энтальпии растворения Na2CO3: dабс. = Нэксп. Нтеор.; d отн. ΔH теор. 100% 11. Сделайте вывод к проделанной работе.
0. Рассчитайте абсолютную и относительную ошибки определения энтальпии растворения Na2CO3: dабс. = Нэксп. Нтеор.; d отн. ΔH теор. 100% 11. Сделайте вывод к проделанной работе. 
 (кДж/моль),
(кДж/моль),  Cl(водн.)+NaOH(водн) NaCl(водн) + Н2О(ж), Но298 =-55,9 кДж/моль d абс. 100
Cl(водн.)+NaOH(водн) NaCl(водн) + Н2О(ж), Но298 =-55,9 кДж/моль d абс. 100 Повторить:
Повторить: 