Учебнометодическое пособие для студентов i курса медицинского вуза Рекомендовано Учебнометодическим объединением по медицинскому и фармацевтическому образованию вузов России в качестве учебного пособия для студентов медицинских вузов
 Скачать 5.49 Mb. Скачать 5.49 Mb.
|
3. ДавлениеДавление влияет на скорость реакций с участием газов, потому что оно непосредственно определяет их концентрации (рис. 9). Из уравнения Менделеева-Клапейрона pV = nRT следует, что с = р/RT , т.е. давление и молярная концентрация газа связаны прямо пропорционально. Поэтому в закон действующих масс мы можем подставлять вместо концентрации давление.  Рис. 9. Влияние давления на скорость реакции 4. Температура. Влияние температуры на скорость реакции отражено в правиле Вант-Гоффа:  При повышении температуры на каждые 10 градусов скорость большинства химических реакций возрастает в 2–4 раза: 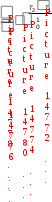 , , где υ1, υ2 – скорости реакции при температурах Т1 и Т2. Для обычных химических реакций Влияние температуры на скорость реакции связано с изменением константы скорости реакции, поэтому уравнение Вант-Гоффа лучше представить в следующем виде: 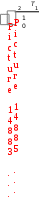 Tk2, k1 Правило Вант-Гоффа не является законом. Во-первых, Вант-Гофф мог изучать химические реакции в ограниченных условиях, которые обеспечивала лабораторная техника того времени. Как выяснилось позже, температурный коэффициент в значительном температурном интервале непостоянен. Во-вторых, из-за несовершенства технических средств невозможно было изучать как очень быстрые реакции (протекающие за миллисекунды), так и очень медленные (для которых требуются тысячи лет). Реакции с участием больших молекул сложной формы (например, белков) также не подчиняются правилу Вант-Гоффа. Правило Вант-Гоффа применимо лишь в узком температурном интервале, поскольку температурный коэффициент скорости реакции γ сам является функцией от температуры; при очень высоких и очень низких температурах γ становится равным единице (т.е. скорость химической реакции перестает зависеть от температуры). Н  идерландский химик Якоб Генрик Вант-Гофф (1852-1911) родился в Роттердаме, в семье врача Якоба Генрика Вант-Гоффа. В идерландский химик Якоб Генрик Вант-Гофф (1852-1911) родился в Роттердаме, в семье врача Якоба Генрика Вант-Гоффа. В 1871 г. Вант-Гофф стал студентом естественно- математического факультета Лейденского университета. На следующий год он перешел в Боннский университет, чтобы изучать химию под руководством Ф.А. Кекуле. Два года спустя Вант-Гофф продолжил свои занятия в Парижском университете, где и завершил работу над диссертацией. Вернувшись в Нидерланды, он представил ее к защите в Утрехтском университете. Вант-Гофф предложил теорию асимметрического углеродного атома, объясняющую оптическую активность органических соединений. Вант-Гофф предположил, что оптическая активность связана с асимметрической молекулярной структурой, причем атом углерода находится в центре тетраэдра, а в четырех его углах располагаются атомы или группы атомов, отличающиеся друг от друга. Таким образом, взаимообмен расположенных в углах тетраэдра атомов или групп атомов может приводить к появлению молекул, идентичных по химическому составу, но являющихся зеркальным отображением друг друга по структуре. Со временем эта теория легла в основу современной стереохимии – области химии, изучающей пространственное строение молекул. В отличие от большинства химиков своего времени Вант-Гофф имел основательную математическую подготовку. Она пригодилась ученому, когда он взялся за сложную задачу изучения скорости реакций и условий, влияющих на химическое равновесие. В результате проделанной работы Вант-Гофф в зависимости от числа участвующих в реакции молекул классифицировал химические реакции как мономолекулярные, бимолекулярные и многомолекулярные, а также определил порядок химической реакции для многих соединений. После наступления химического равновесия в системе с одинаковой скоростью протекают и прямые, и обратные реакции без каких бы то ни было конечных превращений. Если в такой системе увеличивается давление (меняются условия или концентрация ее компонентов), точка равновесия сдвигается таким образом, чтобы давление уменьшилось. Этот принцип был сформулирован в 1884 г. французским химиком Ле Шателье. В том же году Вант-Гофф применил принципы термодинамики при формулировании принципа подвижного равновесия, возникающего в результате изменения температуры. Тогда же он ввел общепринятое сегодня обозначение обратимости реакции двумя стрелками, направленными в противоположные стороны. Результаты своих исследований Вант-Гофф изложил в «Очерках по химической динамике», опубликованных в 1884 г. Вант-Гофф пришел к заключению, что закон Авогадро справедлив и для разбавленных растворов. Сделанное им открытие было очень важным, поскольку все химические реакции и реакции обмена внутри живых существ происходят в растворах. Ученый также экспериментально установил, что осмотическое давление, представляющее собой меру стремления двух различных растворов по обе стороны мембраны к выравниванию концентрации, в слабых растворах зависит от концентрации и температуры и, следовательно, подчиняется газовым законам термодинамики. Проведенные Вант-Гоффом исследования разбавленных растворов явились обоснованием теории электролитической диссоциации Аррениуса. Впоследствии Аррениус переехал в Амстердам и работал вместе с ВантГоффом. Вант-Гофф начал также заниматься проблемами биохимии, в частности изучением ферментов, которые служат катализаторами химических изменений, необходимых для живых организмов. В 1901 г. Вант-Гофф стал первым лауреатом Нобелевской премии по химии, которая была ему присуждена «в знак признания огромной важности открытия им законов химической динамики и осмотического давления в растворах». Представляя Вант-Гоффа от имени Шведской королевской академии наук, С. Т. Однер назвал ученого основателем стереохимии и одним из создателей учения о химической динамике, а также подчеркнул, что исследования Вант-Гоффа «внесли значительный вклад в замечательные достижения физической химии». Влияние температуры на скорость химической реакции объясняет теория активных соударений. Основные положения этой теории: не каждое соударение приводит к акту химического взаимодействия; к химическому взаимодействию приводят только те столкновения, в которых участвуют частицы, обладающие энергией, необходимой для данного взаимодействия (энергией активации); – при соударении частицы должны быть определенным образом расположены относительно друг друга. Э  нергия активации – это минимальная избыточная энергия взаимодействующих частиц, достаточная для того, чтобы эти частицы вступили в химическую реакцию (Еa, кДж/моль). нергия активации – это минимальная избыточная энергия взаимодействующих частиц, достаточная для того, чтобы эти частицы вступили в химическую реакцию (Еa, кДж/моль). Энергия активации – это, по существу, энергетический барьер, который должны преодолеть исходные вещества на пути их превращения в продукты реакции (рис. 10).  Экзотермическая реакция Эндотермическая реакция Рис. 10. Энергетическая диаграмма химической реакции А – реагенты, В – активированный комплекс (переходное состояние), С – продукты Величина энергии активации зависит от природы реагирующих веществ и от характера реакции, но не зависит от концентрации компонентов и температуры. Опытным путем установлено, что реакции с Еa< 50 кДж/моль при 298 К идут с высокой скоростью. Это характерно для реакций с участие радикалов или ионов. Если Еa > 100 кДж/моль, то скорость реакции при 298 К мала. Чем больше энергия активации Еa, тем сильнее возрастает скорость реакции при увеличении температуры. Энергия активации связана с константой скорости реакции и температурой уравнением Аррениуса: k = Ae –Ea/RT где A - предэкспоненциальный множитель, постоянная величина, учитывающая частоту столкновения ориентированных определенным образом частиц; R - универсальная газовая постоянная, R = 8,314 Дж/(мольК). Уравнение Аррениуса для двух температур имеет вид: 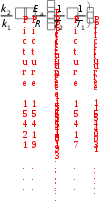 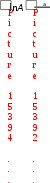 Eln k; ln RT |
