|
|
Учебнометодическое пособие для студентов i курса медицинского вуза Рекомендовано Учебнометодическим объединением по медицинскому и фармацевтическому образованию вузов России в качестве учебного пособия для студентов медицинских вузов
 Обучающие тесты с решением Обучающие тесты с решением
Стационарное состояние для живого организма характеризуется:
а) равенством скоростей прямой и обратной реакций; б) отсутствием изменений параметров и функций состояния систем; в) постоянством скорости поступления и удаления веществ и энергии; г) постоянством скорости изменения параметров и функций состояния систем.
в, г 2) а, в 3) б, г 4) а, б Ответ: Для равновесного состояния характерны равенство скоростей прямой и обратной реакции, отсутствие изменений параметров и функций состояния системы во времени.
Для стационарного состояния характерно постоянство скоростей поступления и удаления веществ и энергии, а также постоянство скорости изменения параметров и функций состояния.
Живые организмы – открытые термодинамические системы, находящиеся в стационарном состоянии. Правильный ответ 1.
Несколько одновременно существующих равновесий можно рассматривать как изолированные, если: а) они независимы друг от друга; б) смещение равновесия в одном не влияет на положение равновесия в другом; в) имеется несколько тождественных по типу химической реакции частиц; г) изменение положения равновесия в одном из них влечет за собой изменение и в других.
1) в, г 2) а, б 3) а, г 4) а, в
Ответ: Несколько равновесий можно рассматривать как изолированные, если они протекают независимо друг от друга и смещение равновесия в одном равновесном процессе не влияет на положение в другом.
Если же равновесия зависят друг от друга и смещение равновесия в одном из них влечет за собой изменение в других, то такие равновесия являются совмещенными. Правильный ответ 2.
В биологических системах протекают совмещенные равновесия, в которых преобладающим становится процесс, характеризующийся:
большим значением константы равновесия, т.е. меньшей убылью энергии Гиббса
меньшим значением константы равновесия, т.е. меньшей убылью энергии Гиббса
большим значением константы равновесия, т.е. большей убылью энергии Гиббса
меньшим значением константы равновесия, т.е. большей убылью энергии Гиббса
О твет: Если в системе протекают несколько совмещенных равновесных процесса, то с точки зрения термодинамики преобладающим становится то, для которого больше убыль энергии Гиббса (ΔG < 0) и больше значение константы равновесия, так как они связаны следующим уравнением: ΔG = –R T lnK. Правильный ответ 3. твет: Если в системе протекают несколько совмещенных равновесных процесса, то с точки зрения термодинамики преобладающим становится то, для которого больше убыль энергии Гиббса (ΔG < 0) и больше значение константы равновесия, так как они связаны следующим уравнением: ΔG = –R T lnK. Правильный ответ 3.
Гидроксид алюминия – антацидное средство, снижение кислотности желудочного сока обусловлено реакцией:
Al(OH)3 + H+ 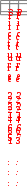 Al(OH) 2 + H2O. Растворение прекращается при рН =4. Укажите преобладающий конкурирующий процесс: Al(OH) 2 + H2O. Растворение прекращается при рН =4. Укажите преобладающий конкурирующий процесс:
а) при рН < 4 преобладает протолитическое равновесие; б) при рН > 4 преобладает гетерогенное равновесие; в) при рН > 4 преобладает протолитическое равновесие; г) при рН < 7 преобладает гетерогенное равновесие
а, б 2) в, г 3) а, г 4) б, в
Ответ: В соответствии с принципом Ле Шателье: а) при увеличении кислотности, при pH < 4, рассматриваемое равновесие будет смещаться в сторону растворения осадка Al(OH)3, т.е. будет преобладать протолитический процесс, в котором Al(OH)3 выполняет функцию основания; б) при уменьшении кислотности, при pH > 4, равновесие будет смещаться в сторону образования осадка Al(OH)3, т.е. будет преобладать гетерогенный процесс. Правильный ответ 1.

Обучающие задачи с решением
1. Как повлияет повышение давления и температуры на равновесие следующих обратимых реакций:
  а) СО(г) + 2Н2(г) СН3ОН(г); Н < 0 а) СО(г) + 2Н2(г) СН3ОН(г); Н < 0
-
3 моль 1 моль
|
|
|
б ) N2(г) + О2(г) 2NО(г); ) N2(г) + О2(г) 2NО(г);
2 моль 2 моль
|
|
Н > 0 > 0
|
Решение:
а) Протекание реакции в прямом направлении приводит к уменьшению общего числа молей газов, т.е. к уменьшению давления в системе. Поэтому, согласно принципу Ле Шателье, повышение давления вызывает смещение равновесия в сторону прямой реакции.
Как видно из уравнения реакции, прямая реакция является экзотермической, то есть идет с поглощением тепла. Следовательно, повышение температуры вызывает смещение равновесия в сторону обратной реакции.
б) Число моль газов в правой и левой частях уравнения одинаково, поэтому при изменении давления равновесие не смещается. Прямая реакция является эндотермической, следовательно, повышение температуры приводит к смещению равновесия в сторону прямой реакции.
К ак повлияет на равновесную концентрацию водорода в системе: CH4(г) + 2H2S(г) CS2(г) + 4H2(г) увеличение концентрации СН4? Напишите математическое выражение константы равновесия, используя парциальные давления. Решение: ак повлияет на равновесную концентрацию водорода в системе: CH4(г) + 2H2S(г) CS2(г) + 4H2(г) увеличение концентрации СН4? Напишите математическое выражение константы равновесия, используя парциальные давления. Решение:
В соответствии с принципом Ле Шателье при увеличении концентрации исходных веществ равновесие смещается в сторону образования продуктов реакции, т.е. вправо. Следовательно, увеличение концентрации исходного вещества метана приведет к увеличению скорости прямой реакции и, соответственно, к увеличению выхода водорода. Константу равновесия можно выражать тремя способами: через равновесные концентрации (Kс), через парциальные давления (Kр) и через активные концентрации (Kа). Для данного обратимого процесса
p(CS 2) p4(H2)
K равн = Kр = p(CH 4) p2(H2S) . равн = Kр = p(CH 4) p2(H2S) .
В ычислите константу равновесия, образования метилового спирта: СО(г)+2Н2(г) СН3ОН(г), при с. у. Сделайте заключение о практической обратимости реакции при с.у. ычислите константу равновесия, образования метилового спирта: СО(г)+2Н2(г) СН3ОН(г), при с. у. Сделайте заключение о практической обратимости реакции при с.у.
Решение:
Справочные данные:
Н ообр(СО) = 110 кДж/моль; ообр(СО) = 110 кДж/моль;
Н ообр(СН3ОН)= 239 кДж/моль; ообр(СН3ОН)= 239 кДж/моль;
Нообр(Н2)= 0 кДж/моль;
S ообр(СО) = +198 Дж/мольК;
Sообр(СН3ОН)= +127 Дж/моль К; Sообр(Н2)= +131 Дж/моль К.
Н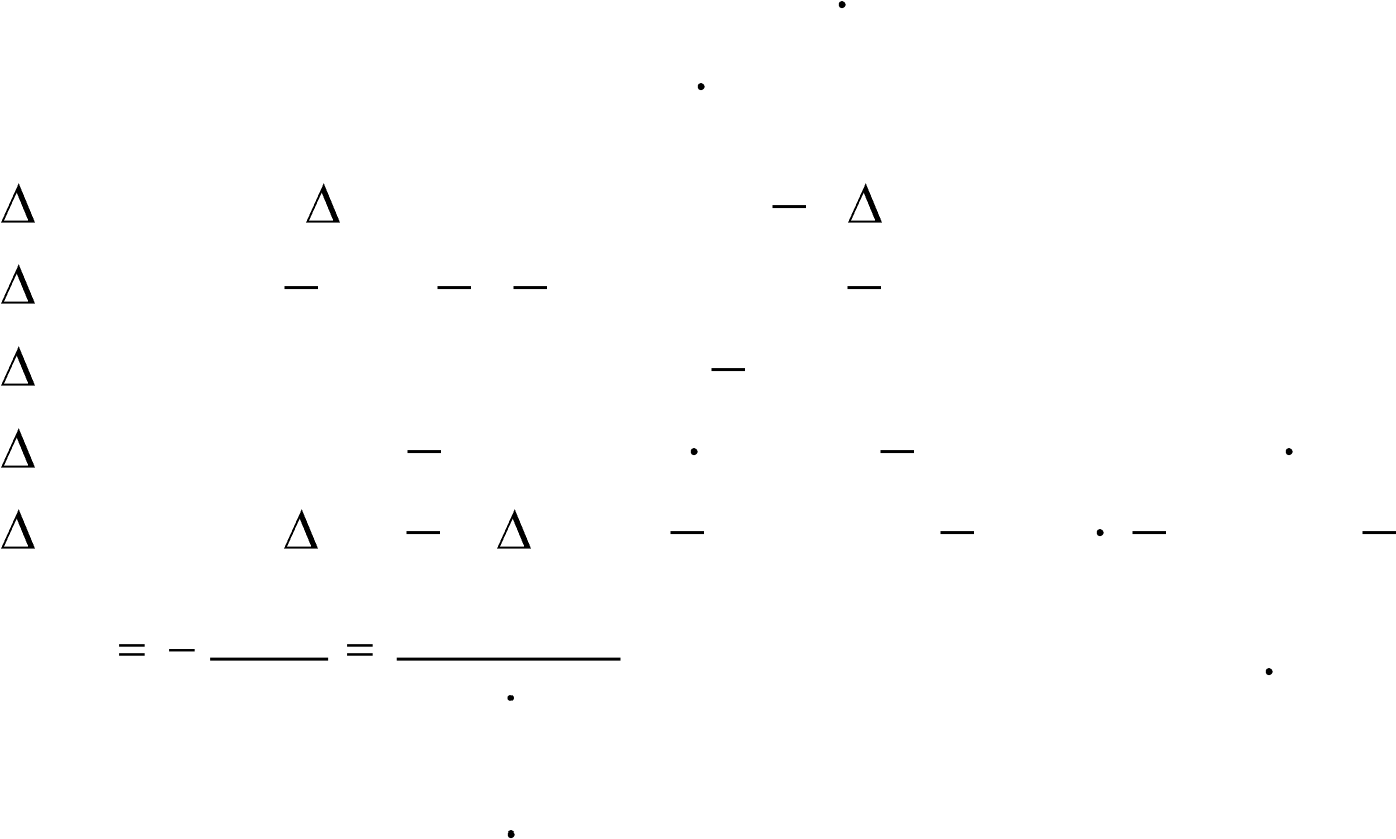  ор-ции = [ Нообр(СН3ОН)] [ Нообр(СО) + 2 Нообр(Н2)]; Нор-ции = 239 ( 110 + 0) = 129 000 Дж/моль. ор-ции = [ Нообр(СН3ОН)] [ Нообр(СО) + 2 Нообр(Н2)]; Нор-ции = 239 ( 110 + 0) = 129 000 Дж/моль.
Sор-ции = [Sообр(СН3ОН)] [ Sообр(СО) + 2Sообр(Н2)]; Sор-ции = +127 [198 + 2 131]= 333 Дж/моль К.
Gор-ции = Но T Sо = 129 000 298 ( 333) = 29766 Дж/моль;
ln K ΔG o 29766 12 = 1,65 105.
= 12; K = е
RT 8,31 298
О твет: K = 1,65 105, т.е. K 103, следовательно, реакция при с.у. твет: K = 1,65 105, т.е. K 103, следовательно, реакция при с.у.
практически необратима.
4. Реакцию:
L -глутаминовая кислота + пировиноградная кислота -кетоглутаровая кислота + L-аланин, -глутаминовая кислота + пировиноградная кислота -кетоглутаровая кислота + L-аланин,
у  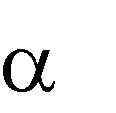 скоряет фермент L-глутаматпируватаминотрансфераза. При 300 К константа равновесия этой реакции равна 1,11. Будет ли происходить самопроизвольно эта реакция, если концентрации исходных веществ и продуктов реакции в системе равны: [L-глутаминовая кислота] = 310-5 М; [пировиноградная кислота] = 3,3 10-4 М; [ -кетоглутаровая кислота] = 1,610-2 М; [L-аланин] = 6,2610-3 М. Решение: скоряет фермент L-глутаматпируватаминотрансфераза. При 300 К константа равновесия этой реакции равна 1,11. Будет ли происходить самопроизвольно эта реакция, если концентрации исходных веществ и продуктов реакции в системе равны: [L-глутаминовая кислота] = 310-5 М; [пировиноградная кислота] = 3,3 10-4 М; [ -кетоглутаровая кислота] = 1,610-2 М; [L-аланин] = 6,2610-3 М. Решение:
О самопроизвольности процесса можно судить по изменению свободной энергии системы для равновесного процесса. Изменение свободной энергии Гиббса зависит как от константы равновесия химической реакции, так и от концентраций реагирующих веществ и продуктов реакции. Эта зависимость выражается уравнением изотермы химической реакции Вант-Гоффа и для данной реакции имеет вид:
[α кетоглутар овая к та] [L аланин]
 G RT (ln К ln G RT (ln К ln
[L глутаминов ая к та] [ппировино радная к та]
1,6 10 2 6,25 10 3
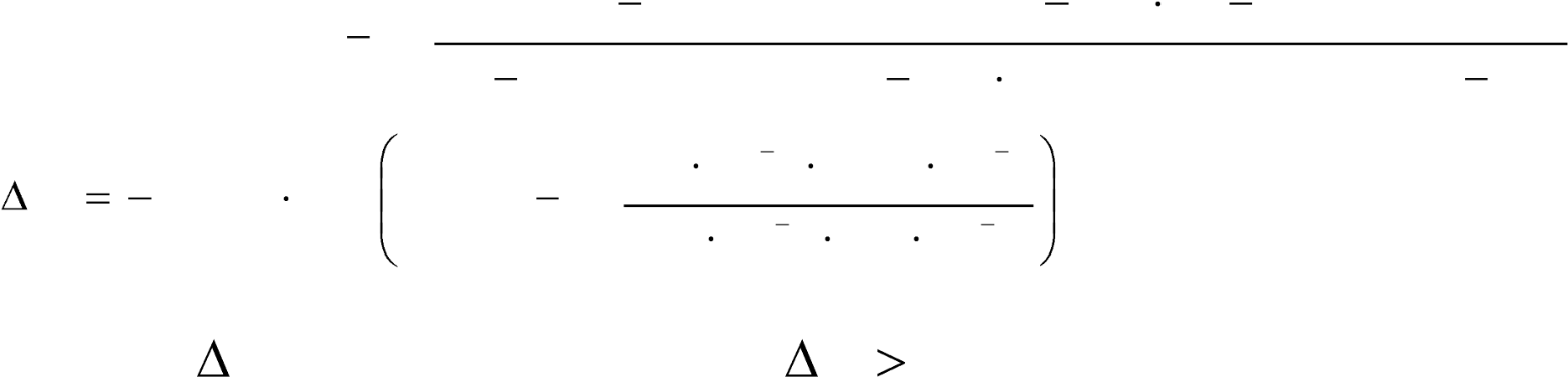 G 8,314 300 ln 1,11 ln 3,5 10 5 3,3 10 4 = +22,74 кДж/моль. G 8,314 300 ln 1,11 ln 3,5 10 5 3,3 10 4 = +22,74 кДж/моль.
Ответ: G = +22,74 кДж/моль ( G 0), реакция самопроизвольно протекать не будет.

|
|
|
 Скачать 5.49 Mb.
Скачать 5.49 Mb. ) N2(г) + О2(г) 2NО(г);
) N2(г) + О2(г) 2NО(г);  > 0
> 0  ак повлияет на равновесную концентрацию водорода в системе: CH4(г) + 2H2S(г) CS2(г) + 4H2(г) увеличение концентрации СН4? Напишите математическое выражение константы равновесия, используя парциальные давления. Решение:
ак повлияет на равновесную концентрацию водорода в системе: CH4(г) + 2H2S(г) CS2(г) + 4H2(г) увеличение концентрации СН4? Напишите математическое выражение константы равновесия, используя парциальные давления. Решение:  равн = Kр = p(CH 4) p2(H2S) .
равн = Kр = p(CH 4) p2(H2S) .  ычислите константу равновесия, образования метилового спирта: СО(г)+2Н2(г) СН3ОН(г), при с. у. Сделайте заключение о практической обратимости реакции при с.у.
ычислите константу равновесия, образования метилового спирта: СО(г)+2Н2(г) СН3ОН(г), при с. у. Сделайте заключение о практической обратимости реакции при с.у.  ообр(СО) = 110 кДж/моль;
ообр(СО) = 110 кДж/моль;  ообр(СН3ОН)= 239 кДж/моль;
ообр(СН3ОН)= 239 кДж/моль; 
 -глутаминовая кислота + пировиноградная кислота -кетоглутаровая кислота + L-аланин,
-глутаминовая кислота + пировиноградная кислота -кетоглутаровая кислота + L-аланин, 
 G RT (ln К ln
G RT (ln К ln  G 8,314 300 ln 1,11 ln 3,5 10 5 3,3 10 4 = +22,74 кДж/моль.
G 8,314 300 ln 1,11 ln 3,5 10 5 3,3 10 4 = +22,74 кДж/моль. 

 Обучающие тесты с решением
Обучающие тесты с решением  твет:
твет: Al(OH) 2 + H2O. Растворение прекращается при рН =4. Укажите преобладающий конкурирующий процесс:
Al(OH) 2 + H2O. Растворение прекращается при рН =4. Укажите преобладающий конкурирующий процесс: 
 а) СО(г) + 2Н2(г) СН3ОН(г); Н < 0
а) СО(г) + 2Н2(г) СН3ОН(г); Н < 0