Учебнометодическое пособие для студентов i курса медицинского вуза Рекомендовано Учебнометодическим объединением по медицинскому и фармацевтическому образованию вузов России в качестве учебного пособия для студентов медицинских вузов
 Скачать 5.49 Mb. Скачать 5.49 Mb.
|
 2 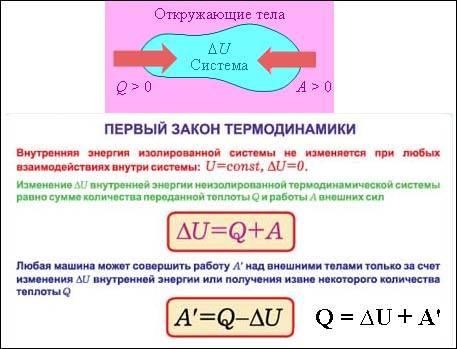 Энергия мира не изменяется. Энтропия мира стремится к максимуму. Р. Клаузиус Все наша жизнь – это борьба с энтропией. А  . Шредингер . Шредингер МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ РФ ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ» ______________________________________________________________ Кафедра общей химии Учебно-методическое пособие для студентов I курса медицинского вузаРекомендовано Учебно-методическим объединением по медицинскому и фармацевтическому образованию вузов России в качестве учебного пособия для студентов медицинских вузов Краснодар 2009 г. УДК 541.1:536 ББК 24.5 О–75 Составители: зав. кафедрой общей химии Кубанского государственного медицинского университета, д.п.н., профессор Т.Н. Литвинова; доцент кафедры общей химии КГМУ, к.х.н. С.А. Овчинникова. Под редакцией профессора Т.Н. Литвиновой Рецензенты: зав. кафедрой общей химии Санкт-Петербургской государственной медицинской академии им. И.И. Мечникова, профессор, д.х.н. Слесарев В.И.; зав. кафедрой бионеорганической и биофизической химии Ярославской государственной медицинской академии, к.б.н., доцент Широкова Т.Ю. «Основы химической термодинамики, химической кинетики и равновесия»: учебно-методическое пособие. Краснодар, КГМУ, 2009. – 122 с. Учебно-методическое пособие «Основы химической термодинамики, химической кинетики и равновесия» составлено на основе примерной программы по общей химии для студентов медицинских вузов (2002 г.) и в соответствии с интегративно-модульной системой обучения, разработанной на кафедре общей химии КГМУ. Рекомендованы к печати ЦМС КГМУ протокол № 1 от 5 сентября 2008 г. УМО – 17–28/599–Д 18.09.08 г. Предисловие Модуль курса общей химии «Основы химической термодинамики, химической кинетики и равновесия» для студентов медицинского вуза включает следующие подразделы (модульные единицы): Основы химической термодинамики, термохимии. Основы химической кинетики и катализа. Химическое равновесие, основные понятия. Цели изучения модуля: Сформировать у студентов представления, знания, умения и навыки на основе содержания модуля, а также ценностное отношение к приобретенным знаниям и умениям как профессионально ориентированным. Студент должен получить представление: а) об основных термодинамических и кинетических закономерностях, определяющих протекание химических и биологических процессов; б) о первом и втором началах химической термодинамики как основы биоэнергетики; энергии Гиббса и ее значении для термодинамических расчетов; в) о законе Гесса, как основы термохимических расчетов, г) о законах и закономерностях химической кинетики; д) о химическом равновесии и гомеостазе живого организма. Студент должен знать: а) основные понятия модуля, формулировки и биологическое значение первого и второго законов термодинамики, закона Г.И. Гесса, следствий из него, закона действующих масс; б) суть термодинамических и кинетических закономерностей, а также конкурирующий характер протекания основных типов реакций в организме человека; в) основные принципы катализа, особенности ферментативного катализа; г) главные термодинамические и кинетические особенности биохимических реакций, протекающих в живом организме. Студент должен уметь: а) выполнять различные термодинамические, термохимические и кинетические расчеты, адаптированные для студентов 1 курса нехимического вуза, рассчитывать константу равновесия; б) использовать результаты расчетов термодинамических, кинетических и физико-химических параметров (энергия Гиббса, энтальпия, энтропия, скорость химической реакции, энергия активации для прогнозирования и интерпретации физико-химических процессов, в том числе протекающих в живых организмах; в) экспериментально определять: тепловой эффект растворения вещества; влияние различных факторов на скорость химической реакции; направление смещения химического равновесия под влиянием различных факторов. Студент должен приобрести и закрепить навыки: а) самостоятельно работать с учебной, научной и справочной литературой, вести поиск, в том числе в Интернете, и делать обобщающие выводы; б) соблюдать элементарные правила техники безопасности и правила работы в химических лабораториях, с лабораторной посудой, калориметром. Данное пособие включает краткую теоретическую часть, описание учебно-исследовательских лабораторных работ, обучающие тесты, обучающие задачи с решениями, упражнения и задачи для самостоятельного решения с ответами, вопросы для защиты модуля, экзаменационные вопросы по модулю для студентов разных факультетов, список основной и дополнительной литературы. Введение Химическая термодинамика и химическая кинетика являются теоретической основой биофизической химии. Знание законов химической термодинамики, их использование при проведении термохимических расчетов дают возможность будущему врачу получить представление об энергетическом балансе человеческого организма, установить специфические особенности преобразования химической энергии в другие виды энергии в процессах жизнедеятельности, оценить калорийность потребляемой пищи, установить энергозатраты человека на выполнение различных видов труда. Умение составить меню диетического и лечебно-профилактического питания с использованием данных об энергетической ценности пищевых продуктов необходимо врачам-лечебникам, диетологам, гигиенистам для профилактики и лечения заболеваний, связанных с нарушением обмена веществ. Энергетика процессов растворения играет огромную роль в жизнедеятельности живых организмов. Врач должен уметь с позиций термодинамики и кинетики рассматривать процессы усвоения пищи и выведения из организма продуктов жизнедеятельности, прогнозировать термодинамическую устойчивость биологических жидкостей, лекарственных препаратов при их введении в организм. Термодинамика дает врачу ключ к пониманию характера протекания биохимических процессов в организме, процессов эмбриогенеза, регенерации тканей, старения и возможность регулировать эти процессы осуществлением санитарно-гигиенических мероприятий и лечебных назначений. Все биологические системы являются открытыми, обмениваясь с окружающей средой веществом и энергией. Так организм человека за 40 лет жизни потребляет примерно 40 т воды, 6 т пищи, 12 млн. л кислорода. Термодинамика открытых систем описывается с помощью очень сложного математического аппарата. Для характеристики закрытых систем, которые обмениваются с окружающей средой только энергией, используется более простой математический аппарат, который позволяет получать удовлетворительные результаты для прогнозирования физико-химических процессов, поэтому иногда закрытые системы можно рассматривать как модели организма или его отдельных частей. На основе общих законов химической термодинамики можно понять функции отдельных систем и организма в целом, его взаимодействие с окружающей средой. Живые организмы поддерживают присущую им упорядоченность систем за счет увеличения энтропии внешней среды. Знание законов химической термодинамики особенно необходимо при изучении энергетических превращений на молекулярном и клеточном уровнях. Приобретение навыков экспериментального и расчетного определения энтальпии химических и физико-химических процессов необходимо студентам для освоения физико-химических методов анализа, используемых в научно-исследовательской работе. Одним из разделов биофизической химии является кинетика биологических процессов – учение о закономерностях и скоростях протекания различных биологических процессов: биохимических реакций, биоэлектрических явлений, проницаемости биологических мембран и т.д. В основе кинетики биологических процессов лежит кинетика химических реакций, изучающая законы протекания химических процессов во времени и их механизмы. Химические реакции в биологических системах имеют свои особенности: Биологические реакции – это ферментативные процессы, протекающие в живых организмах – сложных, с точки зрения термодинамики, открытых системах. Сложные ферментативные реакции обладают свойством осуществлять саморегуляцию, т.е. изменять скорость процесса конечными или промежуточными продуктами реакции. Ферментативные реакции представляют собой совокупность сопряженных, последовательных, параллельных и других реакций. Ферменты по своей химической природе являются белками, что определяет характерные особенности ферментативного катализа. Важную роль в живых организмах играют реакции, в ходе которых образуются продукты, являющиеся катализаторами – автокаталитические реакции. В биологических системах, в основном в мембранных структурах клеток при радиационных поражениях, действии некоторых ядовитых веществ развиваются цепные реакции, которые приводят к окислению липидов клеточных мембран и разрушению клеточных структур. Ингибиторы таких реакций выполняют защитную роль при лучевых поражениях. Большинство биохимических процессов представляют собой обратимые химические реакции, поэтому химические процессы, протекающие в организме, можно рассматривать как непрерывный ряд смещений химического равновесия. Константа равновесия определяет глубину протекания процесса, позволяет судить о направлении реакции, т.к. связана с энергией Гиббса и восстановительным потенциалом, а также кислотно-основных, гетерогенных и лигандообменных равновесий, рассчитать теоретически возможный выход продуктов. Результаты исследований кинетики биологических процессов находят применение в медицинской практике: изучение физикохимических механизмов возникновения патологических состояний; установление физико-химических, биохимических критериев отбора, направленного поиска фармакологически активных веществ; изучение динамики ферментативных процессов в норме и патологии; динамики роста злокачественных опухолей. Закономерности химической кинетики используют в фармакокинетике и токсикокинетике, изучающих скорости действия и выведения из организма соответственно лекарственных средств и ядов. Обычный путь действия лекарственного средства в организме можно рассматривать как последовательность двух процессов: всасывания из желудка в кровь (характеризуется константой всасывания kв) и выведения (элиминации) из крови в мочу (характеризуется константой выведения kэ): 
kв Кинетика изменения массы лекарственного средства в желудке mж, в крови mк и в моче mм описывается системой трех дифференциальных уравнений, решаемой графически; на основании этого прогнозируют лечебную дозу лекарства m0 и время принятия очередной дозы. Синтез многих лекарственных веществ, определение срока годности препаратов, изучение действия лекарств на молекулярном уровне основаны на использовании закономерностей химической кинетики. Литература Основная: Общая химия. Биофизическая химия. Химия биогенных элементов. Учебник для мед. спец. вузов /А. Берлянд, Ю. Ершов, А. Книжник.– М., Высшая школа, 2007. – 560 с. Попков В.А., Пузаков С.А.Общая химия. Электронный учебник для вузов. – Москва: ГЭОТАР-Медиа, 2007.– 976 с. Слесарев В.И. Химия: Основы химии живого. СПб: Химиздат, 2005. – 784 с. Пузаков С.А., Попков В.А., Филиппова А.А. Сборник задач и упражнений по общей химии: Учеб. пособие. – М.: Высшая школа, 2004.-225 с. Литвинова Т.Н. Сборник задач по общей химии. Задачи по общей химии с медико-биологической направленностью: учебное пособие для студентов медицинских вузов.- 3-е изд., перераб. Гриф УМО МЗ и СР/ - М: ООО «Изд-во Оникс»: ООО «Издательство «Мир и образование», 2007 – 224 с.- (Высшее образование). 1000 тестов по общей химии для студентов медицинских вузов. Учебное пособие. Гриф УМО МЗ и СР/ Т.Н.Литвинова и др..- Изд. 2-е испр. и доп. – Ростов н/Д: Феникс, 2007. – 429 с. Дополнительная: Беляев А.П. Физическая и коллоидная химия. – Москва: ГЭОТАР-Медиа, 2008.– 704 с. Евстратова К.И., Купина Н.А., Малахова Е.Е. Физическая и коллоидная химия. – М.: Высшая школа, 1990. – 487 с. Ленский А.С. Введение в бионеорганическую и биофизическую химию. – М.: Высшая школа, 1989. –256 с. Хмельницкий Р.А. Физическая и коллоидная химия.– М.: Высшая школа, 1988. –400 с. Чанг Р. Физическая химия с приложением к биологическим системам. –М.: Мир, 1980. –662 с. Уильямс В., Уильямс Х. Физическая химия для биологов. –М.: Мир, 1976. –600 с. |
