МОДУЛЬ 1 Смысловой модуль 1.2. Анализ качества лекарственных веществ илекарственныхформ в условиях аптеки. МОДУЛЬ 1 Смысловой модуль 1.2. Анализ качества лекарственных в. Учебнометодическое пособие для студентов IV курса фармацевтического факультета специальности Фармация Запорожье 2012
 Скачать 3.59 Mb. Скачать 3.59 Mb.
|
|
ИДЕНТИФИФКАЦИЯ АНИОНОВ Бромиды А) Бромид-ион обнаруживают по осаждению его серебра нитратом. При этом образуется осадок светло-желтого цвета, медленно растворимый в растворе аммиака: Br‾ + AgNO3 → AgBr↓ + NO3‾; AgBr + 2NH4OH → [Ag(NH3)2]Br + 2H2O. При взаимодействии серебра бромида с раствором аммиака образуется растворимое комплексное соединение. Методика: навеску испытуемой субстанции, эквивалентную около 3 мг бромида (Br‾), растворяют в 2 мл воды Р. Полученный раствор или 2 мл раствора, указанного в частной статье, подкисляют кислотой азотной разведенной Р,прибавляют 0,4 мл раствора серебра нитрата Р1, перемешивают и отстаивают; образуется светло-желтый творожистый осадок. Осадок отделяют центрифугированием и промывают тремя порциями воды Р по 1 мл каждая. Эти операции проводят быстро в защищенном от яркого света месте, при этом допускается, чтобы жидкость над осадком не была полностью прозрачной. Полученный осадок суспендируют в 2 мл воды Р и прибавляют 1,5 мл раствора аммиака Р, осадок медленно растворяется. В) Бромид-ион при взаимодействии со свинца (IV) оксидом в уксуснокислой среде окисляется до свободного брома: 2Br‾ + PbO2 + 4CH3COOH → Br2 + Pb(CH3COO)2 + 2CH3COO‾ + 2H2O. Выделившийся бром образует бромзамещенное фуксина, в результате чего появляется фиолетовое окрашивание:  Методика: навеску испытуемой субстанции, эквивалентную около 5 мг бромида (Br‾), или количество субстанции, указанное в частной статье, помещают в небольшую пробирку, прибавляют 0,25 мл воды Р, около 75 мг свинца (IV) оксида Р, 0,25 мл кислоты уксусной Р и осторожно встряхивают. Верхнюю внутреннюю часть пробирки высушивают с помощью фильтровальной бумаги и оставляют на 5 мин. Полоску фильтровальной бумаги необходимого размера пропитывают, помещая ее край в каплю раствора фуксина обесцвеченного Р и тотчас помещают пропитанную часть в пробирку. В течение 10 секунд у нижнего края фильтровальной бумаги появляется фиолетовое окрашивание, которое четко отличается от красной окраски фуксина, наблюдаемой в верхней пропитанной части полоски бумаги. С) Бромид-ион при взаимодействии с раствором хлорамина в кислой среде окисляется до свободного брома. Хлорамин в кислой среде разлагается до активного хлора, который и окисляет бромид-ион до свободного брома: 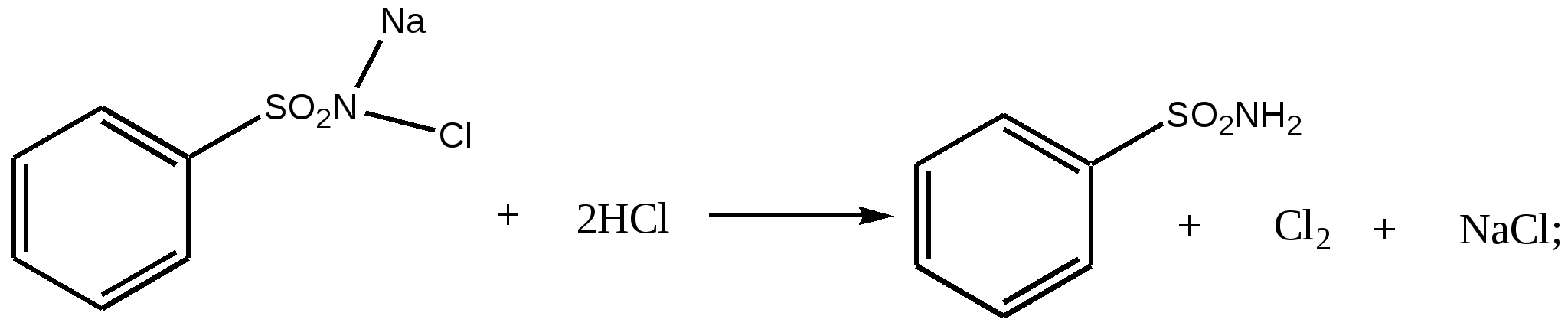 2Br‾ + Cl2 → Br2 + 2Cl‾. К полученному раствору прибавляют хлороформ для экстрагирования брома. Смесь энергично встряхивают, при отстаивании хлороформный слой приобретает желто-бурую окраску. Методика: к 1 мл раствора, содержащего испытуемую субстанцию в количестве, эквивалентном около 30 мг бромид-иона (Br‾), прибавляют 1 мл кислоты хлористоводородной разведенной Р, 0,5 мл раствора хлорамина (свежеприготовленного), 1 мл хлороформа Р и взбалтывают; хлороформный слой приобретает желто-бурую окраску. Йодиды А) Серебра нитрат образует с йодид-ионом желтый осадок AgI, нерастворимый в азотной кислоте, а также в аммиаке (отличие от Cl‾ и Br‾): I‾ + Ag+ → AgI↓ В отличие от серебра хлорида (ПР = 1,78∙10‾10) серебра йодид имеет гораздо меньшее произведение растворимости (8,3∙10‾17) и практически нерастворим в аммиаке. Методика: навеску испытуемой субстанции, эквивалентную около 4 мг йодида (I‾), растворяют в 2 мл воды Р. Полученный раствор или 2 мл раствора, указанного в частной статье, подкисляют кислотой азотной разведенной Р, прибавляют 0,4 мл раствора серебра нитрата Р1, перемешивают и отстаивают до образования светло-желтого творожистого осадка. Осадок отделяют центрифугированием и промывают 3 порциями воды Р по 1 мл каждая. Эту операцию проводят быстро в защищенном от яркого света месте, при этом допускается, чтобы жидкость над осадком не была полностью прозрачной. Осадок суспендируют в 2 мл воды Р и прибавляют 1,5 мл раствора аммиака Р; осадок не растворяется. В) Йодиды в кислой среде являются восстановителями и сами способны окисляться с выделением свободного галогена. Это свойство используется для определения подлинности йодидов. Государственная фармакопея рекомендует для открытия йодидов использовать в качестве окислителя раствор калия дихромата в кислой среде: 6I‾ + K2Cr2O7 + 7H2SO4 → 3I2 + Cr2(SO4)3 + K2SO4 + 7H2O + 3SO42‾. Методика: к 0,2 мл раствора испытуемой субстанции, содержащей около 5 мг йодида (I‾) в 1 мл, или к 0,2 мл раствора, указанного в частной статье, прибавляют 0,5 мл кислоты серной разведенной Р, 0,1 мл раствора калия бихромата Р, 2 мл воды Р, 2 мл хлороформа Р, встряхивают в течение нескольких секунд и оставляют до расслоения; хлороформный слой приобретает фиолетовую или фиолетово-красную окраску. Другие реакции идентификации йодидов: 2NaI + 2NaNO2 + 2H2SO4 → I2 + 2NO↑ + 2Na2SO4 + 2H2O; (2I‾ + 2NO2‾ + 4H+ → I2 + 2NO↑ + 2H2O); 2KI + 2FeCl3 → 2FeCl2 + I2 + 2KCl; (2I‾ + 2Fe3+ → 2Fe2+ + I2). Методика: к 2 мл раствора йодида (0,003-0,02 г иона йодида) прибавляют 0,2 мл кислоты серной разведенной, 0,2 мл раствора натрия нитрита или раствора железа (III) хлорида и 2 мл хлороформа; при взбалтывании хлороформный слой окрашивается в фиолетовый цвет. Карбонаты и гидрокарбонаты А) При действии кислот, даже слабых, таких как уксусная, карбонаты разлагаются с выделением диоксида углерода: CO32‾ + 2H+ → H2O + CO2↑; HCO3‾ + H+ → H2O + CO2↑. Выделяющийся диоксид углерода пропускают в раствор бария гидроксида: Ba(OH)2 + CO2 Образующийся осадок растворяется в избытке кислоты хлористоводородной: BaCO3↓ + HCl → BaCl2 + H2O + CO2↑. Методика: 0,1 г испытуемой субстанции помещают в пробирку и суспендируют в 2 мл воды Р. К полученной суспензии или к 2 мл суспензии, указанной в частной статье, прибавляют 3 мл кислоты уксусной разведенной Р. Пробирку тотчас закрывают притертой пробкой со стеклянной трубкой, дважды изогнутой под прямым углом; наблюдается бурное выделение пузырьков газа без цвета и запаха. Пробирку осторожно нагревают и пропускают выделяющийся газ через 5 мл раствора бария гидроксида Р, образуется белый осадок, растворяющийся при прибавлении избытка кислоты хлористоводородной Р1. В) К испытуемому раствору карбоната прибавляют насыщенный раствор магния сульфата. Образуется белый осадок: 4CO32‾ + 4Mg2+ + 4H2O → 3MgCO3∙Mg(OH)2∙3H2O↓ + CO2↑. Гидрокарбонаты в этих условиях образуют осадок только при кипячении, поскольку магния гидрокарбонат растворим в воде: 4Mg(HCO3)2 → 3MgCO3∙Mg(OH)2∙3H2O↓ + 5CO2↑. Методика: 0.2 г испытуемой субстанции растворяют в 2 мл воды Р. К полученному раствору прибавляют 0.5 мл насыщенного раствора магния сульфата Р, образуется белый осадок (отличие от гидрокарбонатов, растворы которых образуют осадок только при кипячении смеси). Примечание. Для получения насыщенного раствора магния сульфата, к 100 г магния сульфата Р прибавляют 100 мл воды Р и оставляют на 24 ч при частом взбалтывании. Раствор фильтруют. С) Испытание проводят с помощью индикатора фенолфталеина. Интервал перехода этого индикатора лежит в области от 8,2 до 10,0. Гидрокарбонат имеет рН 8,35, а карбонат – рН 12,1. Поэтому появление красного окрашивания свидетельствует о присутствии карбонатов. Методика: 0.2 г испытуемой субстанции растворяют в 2 мл воды Р. К полученному раствору прибавляют 0.05 мл раствора фенолфталеина Р; появляется красное окрашивание (отличие от гидрокарбонатов, растворы которых остаются бесцветными). Нитраты А) Для обнаружения нитратов исследуемую субстанцию нагревают с нитробензолом Р и концентрированной серной кислотой, затем охлаждают, прибавляют концентрированный раствор натрия гидроксида Р и ацетон Р, появляется фиолетовое окрашивание. По-видимому, вначале протекает нитрование нитробензола, а образующийся динитробензол со щелочью образует аци-соли (псевдо-соли). Методика: навеску порошка субстанции, эквивалентную около 1 мг нитрат-иона (NО3‾), или количество, указанное в частной статье, прибавляют к смеси 0,1 мл нитробензола Р и 0,2 мл кислоты серной Р и через 5 мин охлаждают в ледяной воде. Продолжая охлаждение, медленно при перемешивании прибавляют 5 мл воды Р, 5 мл раствора натрия гидроксида концентрированного Р, 5 мл ацетона Р, взбалтывают и отстаивают; верхний слой приобретает темно-фиолетовую окраску. В) Нитраты, являясь окислителями, не могут восстанавливать перманганат-ионы в растворе калия перманганата, поэтому последний и не обесцвечивается. Методика: раствор, содержащий испытуемую субстанцию в количестве, эквивалентном около 2 мг нитрат-иона (NО3‾), не обесцвечивает раствор 1 г/л калия перманганата Р, подкисленный кислотой серной разведенной Р (отличие от нитритов). Нитриты Нитрит-ион идентифицируют при взаимодействии с антипирином в присутствии кислоты хлористоводородной разведенной. Нитриты при взаимодействии с кислотой хлористоводородной образуют кислоту азотистую, которая нитрозирует антипирин по четвертому положению пиразолонового цикла с образованием 4-нитрозоантипирина окрашенного в зеленый цвет:  Методика: несколько кристаллов антипирина растворяют в фарфоровой чашке в 0,1 мл кислоты хлористоводородной разведенной Р, прибавляют 0,1 мл раствора, содержащего около 1 мг нитрит-иона; появляется зеленое окрашивание (отличие от нитратов). Кроме фармакопейных реакций на нитраты и нитриты используют реакции с дифениламином и концентрированной серной кислотой. 1. К субстанции (около 0,001 г иона нитрата или нитрита) прибавляют 2 капли раствора дифениламина; появляется синее окрашивание:  2. К субстанции (около 0,001 г иона нитрата) прибавляют по 2-3 капли воды и кислоты серной концентрированной, кусочек металлической меди и нагревают; выделяются бурые пары двуокиси азота: Cu + 2NaNO3 + 2H2SO4 → CuSO4 + 2NO2↑ + Na2SO4 + 2H2O. 3. К субстанции (около 0,03 г иона нитрита) прибавляют 15 мл кислоты серной разведенной; выделяются желто-бурые пары (отличие от нитратов): 2NaNO2 + H2SO4 → Na2SO4 + 2HNO2; 2HNO2 → NO2↑ + NO↑ + H2O. Силикаты Идентификация силикатов основана на образовании кремния тетрафторида и дальнейшем взаимодействии его с полимером. Вначале, взаимодействием натрия фторида с кислотой серной получают фтористый водород: 2NaF + H2SO4 → 2HF + Na2SO4, который взаимодействует с силикатами с образованием кремния фтористого: Si4+ + 4HF → SiF4↑ + 4H+ или H2SiO3 + 6HF → H2[SiF6] + 3H2O. Исследование проводят в металлических тиглях, так как фтористый водород реагирует со стеклом. Образующийся фтористый водород в присутствии влаги вступает во взаимодействие с полимером, образуя фторпроизводное. Методика: количество испытуемой субстанции, указанное в частной статье, смешивают в свинцовом или платиновом тигле с помощью медной проволоки с около 10 мг натрия фторида Р и несколькими каплями кислоты серной Р до образования суспензии. Тигель накрывают тонкой прозрачной пластиковой пластинкой с висящей каплей воды Р и осторожно нагревают; через короткий промежуток времени вокруг капли воды появляется белое кольцо. Сульфаты А) Бария хлорид из растворов сульфатов выделяет белый осадок бария сульфата, нерастворимый ни в воде, ни в минеральных кислотах, ни в щелочах (даже при нагревании). Некоторые другие анионы (карбонаты, сульфиты) с раствором бария хлорида также образуют нерастворимые соли, которые, в отличие от бария сульфата, растворяются в кислоте хлористоводородной. Поэтому, при проведении реакции на сульфат-ион с раствором бария хлорида необходимо добавлять кислоту хлористоводородную: SO42‾ + BaCl2 → BaSO4↓ + 2Cl‾. Методика: около 45 мг испытуемой субстанции растворяют в 5 мл воды Р. К полученному раствору или к 5 мл раствора, указанного в частной статье, прибавляют 1 мл кислоты хлористоводородной разведенной Р и 1 мл раствора бария хлорида Р1; образуется белый осадок. В) Методика: к суспензии, полученной в результате реакции (а), прибавляют 0,1 мл 0,05 М раствора йода; желтая окраска йода не исчезает (отличие от сульфитов и дитионитов), но обесцвечивается при прибавлении по каплям раствора олова хлорида Р (отличие от йодатов). Смесь кипятят; осадок не окрашивается (отличие от селенатов и вольфраматов): SnCl2 + I2 + 2HCl → SnCl4 + 2I‾ + 2H+. Сульфиты А) Идентификация сульфит-ионов основана на том, то в свободном состоянии кислота сернистая неизвестна; она может существовать только в водном растворе, подобно кислоте угольной, легко разлагаясь на диоксид серы и воду: SO32‾ + 2HCl → 2Cl‾ + H2SO3; H2SO3 → SO2↑ + H2O; SO32‾ + 2HCl → SO2↑ + H2O + 2Cl‾. Методика: к 2 мл раствора, содержащего испытуемую субстанцию в количестве, эквивалентном 10-30 мг сульфит-иона (SO32‾), прибавляют 2 мл кислоты хлористоводородной разведенной Р и встряхивают; постепенно выделяется сернистый газ, обнаруживаемый по характерному резкому запаху. В) Сульфиты окисляются раствором йода, кроме йода можно использовать и другие окислители (калия перманганат, калия бихромат, бромная вода). При этом происходит окисление сульфитов до сульфатов, реакция среды становится кислой и бурый раствор йода обесцвечивается: SO32‾ + I2 + H2O → SO42‾ + 2H+ + 2I‾. Чтобы убедиться в образовании сульфатов, прибавляют к полученному после реакции раствору еще 2-3 капли 2 М раствора кислоты хлористоводородной и несколько капель раствора бария хлорида. Выпадает белый осадок бария сульфата: SO42‾ + Ba2+ → BaSO4↓. Большинство реакций окисления сульфитов проводят в кислой или нейтральной среде. Особенно важно соблюдать это условие при окислении сульфит-ионов раствором йода, так как йод в щелочной среде обесцвечивается вследствие самоокисления-самовосстановления. Методика: к указанному в частной статье раствору, содержащему сульфит-ион (SO32‾), прибавляют 0,1 мл 0,05 М раствора йода; реактив обесцвечивается. Фосфаты (Ортофосфаты) Определяются двумя методами: А) Исследуемый раствор с раствором серебра нитрата образует желтый осадок, цвет которого не изменяется при кипячении. Осаждение серебра нитратом проводится из нейтральных растворов: 2HPO42‾ + 3Ag+ → Ag3PO4↓ + H2PO4‾ или PO43‾ + 3AgNO3 → Ag3PO4↓ + 3NO3‾. Осадок серебра фосфата растворяется в растворе аммиака (в щелочной среде): Ag3PO4↓ + NH3 + H2O → 3[Ag(NH3)2]OH + (NH4)3PO4 или 2Ag3PO4↓ + 18NH4OH → 6[Ag(NH3)2]OH + 2(NH4)3PO4 + 12H2O. Осадок также растворяется в кислоте азотной: Ag3PO4↓ + 3HNO3 → 3AgNO3 + H3PO4. Учитывая то, что серебра фосфат растворяется в кислых и щелочных растворах, при необходимости исследуемый раствор нейтрализуют (доводят до нейтральной реакции). Методика: к 5 мл раствора, указанного в частной статье, при необходимости нейтрализованного, прибавляют 5 мл раствора серебра нитрата Р1; образуется желтый осадок, цвет которого не изменяется при кипячении и который растворяется при прибавлении раствора аммиака Р. В) Исследуемый раствор с молибденованадиевым реактивом образует желтое окрашивание. Молибденованадиевый реактив представляет собой раствор аммония молибдата Р и аммония ванадата Р в кислоте азотной Р. Окрашивание наступает вследствие образования аммонийной соли 12-молибдофосфорной гетерополикислоты: PO43‾ + 24NH4+ + 12MoO42‾ + 21HNO3→(NH4)3H4[P(Mo2O7)6] + 21NH4NO3 + 10H2O Окрашивание может наступить также вследствие образования и другого продукта: PO43‾ + HVO3 + 11H2MoO4 + 4NH4+ → (NH4)4[PO4(MoO3)11VO3] + 11H2O +H+ Методика: к 1 мл раствора, указанного в частной статье, прибавляют 2 мл молибденованадиевого реактива Р и перемешивают; появляется желтое окрашивание. Фториды 1). С цирконий-ализариновым комплексом (состоит из смеси растворов ализарина и цирконила нитрата) (ГФУ): 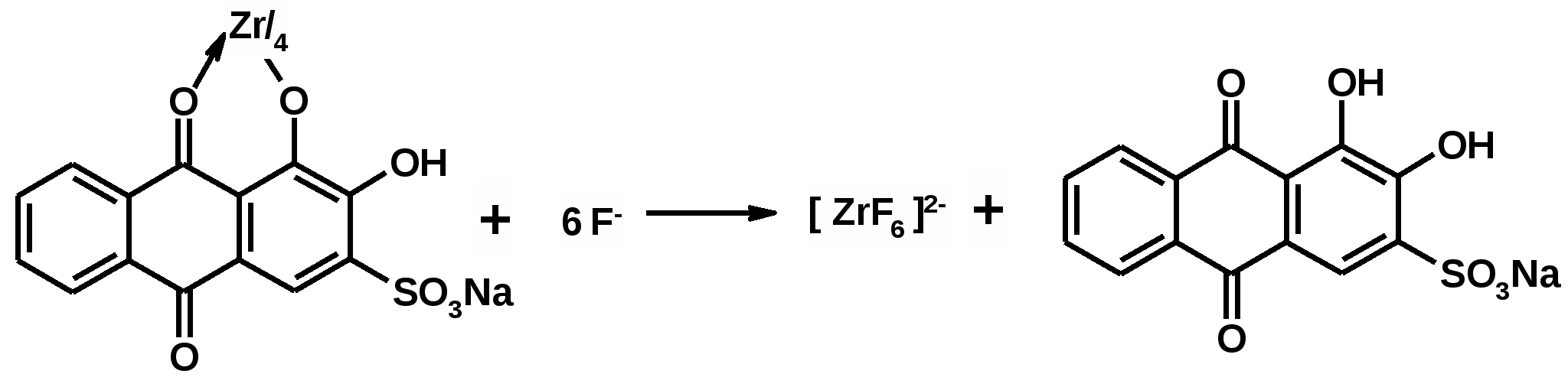 2). Соли кальция с F- дают белый осадок фторида кальция: Ca2+ + 2F- → CaF2 3). После сжигания в токе кислорода, фторид-ионы, поглощенные раствором Н2О2, обесцвечивают раствор тиоцианата железа (ІІІ) красного цвета: Fe(CNS)3 + 6F- → [FeF6]3- + 3SCN- Хлориды А) Соли хлористоводородной кислоты с раствором серебра нитрата в азотнокислой среде образуют белый творожистый осадок. Осадок нерастворим в разбавленных кислотах, растворим в растворе аммиака: Cl‾ + Ag+ → AgCl↓; AgCl↓ + 2NH4OH → [Ag(NH3)2]Cl + 2H2O. Методика: навеску испытуемой субстанции, эквивалентную около 2 мг хлорида (Cl‾), растворяют в 2 мл воды Р. Полученный раствор или 2 мл раствора, указанного в частной статье, подкисляют кислотой азотной разведенной Р, прибавляют 0,4 мл раствора серебра нитрата Р1, перемешивают и отстаивают; образуется белый творожистый осадок, который центрифугируют и промывают тремя порциями воды Р по 1 мл каждая. Эту операцию проводят быстро в защищенном от яркого света месте, при этом допускается, чтобы жидкость над осадком не была полностью прозрачной. Осадок суспендируют в 2 мл воды Р и прибавляют 1,5 мл раствора аммиака Р; осадок быстро растворяется; допускается наличие нескольких крупных частиц, растворяющихся медленно. В) Калия бихромат в смеси с кислотой серной, взаимодействуя с хлоридами, образует хлорид хромила, выделяющиеся пары которого, соприкасаясь с фильтровальной бумагой, пропитанной раствором дифенилкарбазида (бесцветный) окисляют его до дифенилкарбазона, который имеет окраску и бумага окрашивается в фиолетово-красный цвет: K2Cr2O7 + 4NaCl + 6H2SO4 → 2CrO2Cl + 2KHSO4 + 4NaSO4 + 3H2O  Методика: навеску испытуемой субстанции, эквивалентную около 15 мг хлорида (Cl‾), или количество, указанное в частной статье, помещают в пробирку, прибавляют 0,2 г калия дихромата Р и 1 мл кислоты серной Р. У входного отверстия пробирки помещают фильтровальную бумагу, пропитанную 0,1 мл раствора дифенилкарбазида Р (при этом пропитанная бумага не должна соприкасаться с калия бихроматом); бумага окрашивается в фиолетово-красный цвет. Не фармакопейные реакции: Реакция с диоксидом марганца. Диоксид марганца окисляет кислоту хлористоводородную концентрированную при нагревании до элементарного хлора: 4HCl + MnO2 → Cl2 + MnCl2 + 2H2O. При дальнейшем прибавлении к реакционной смеси раствора калия йодида и хлороформа, хлороформный слой окрашивается в фиолетовый цвет: Cl2 + 2KI → I2 + 2KCl. |
