МОДУЛЬ 1 Смысловой модуль 1.2. Анализ качества лекарственных веществ илекарственныхформ в условиях аптеки. МОДУЛЬ 1 Смысловой модуль 1.2. Анализ качества лекарственных в. Учебнометодическое пособие для студентов IV курса фармацевтического факультета специальности Фармация Запорожье 2012
 Скачать 3.59 Mb. Скачать 3.59 Mb.
|
|
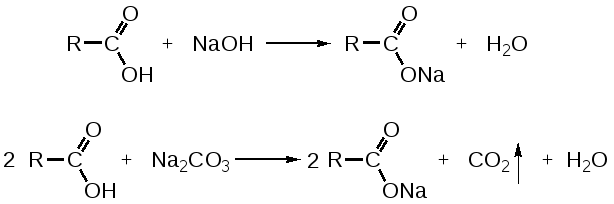
АНАЛИЗ ПО ФУНКЦИОНАЛЬНЫМ ГРУППАМ (качественный и количественный) Методы качественного и количественного анализа галогенпроизводных углеводородов Методы качественного и количественного анализа галогенпроизводных углеводородов сводятся чаще всего к определению галогена. Галоген в молекулах органических лекарственных веществ ковалентно связан с атомом углерода, в связи с чем для его определения необходимо предварительно минерализовать лекарственное средство. В зависимости от природы галогена, а также от строения органической молекулы прочность ковалентной связи галоген-углерод неодинакова, поэтому для минерализации применяют различные, соответствующие этой прочности методы. Для минерализации галогенов в органических соединениях широко применяются методы восстановления водородом в момент выделения. Существует несколько вариантов метода восстановления, в зависимости от способа получения водорода: 1) действием металлического натрия на спирт; 2) цинковой пыли в кислой среде; 3) цинковой пыли в щелочной среде. Из этих методов наиболее удобным и часто применяемым является восстановление цинком в щелочной среде, так как в этом случае образуется нелетучие галогениды. Хлористый этил, хлороформ качественно и количественно определяется взаимодействием с серебра нитратом после переведения хлора в ионное состояние при взаимодействии со щелочами: 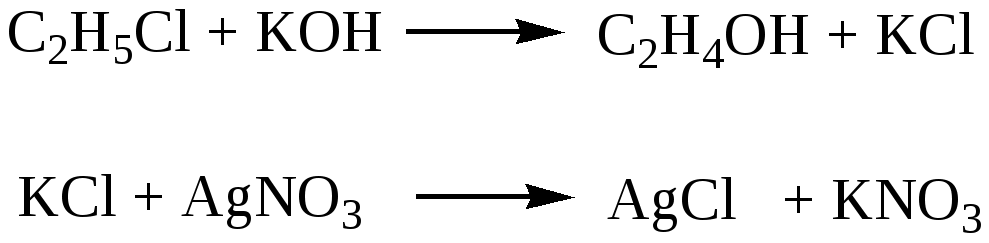 В галотане (фторотане) для переведения фтора в ионогенное состояние лекарственное средство сплавляют с металлическим натрием, при этом хлор и бром также переходят в ионное состояние. Фторид ионы открывают смесью циркония нитрата и ализаринового красного, Нагреванием с избытком серебра нитрата в азотнокислой среде определяют количественно йодоформ, предохраняя его от действия света. Избыток серебра нитрата оттитровывают раствором аммония тиоционата с индикатором железа (III) аммония сульфатом.  Окислительный метод количественной оценки галоген-углеводородов по содержанию, например ковалентно связанного йода (тиреоидин), основывается на разрушении субстанции пероксидом водорода в смеси с концентрированной серной кислотой. При этом образуются йодиды и частично йодаты. Йодиды окисляются до йодатов 5% раствором калия перманганата: Избыток калия перманганата удаляют натрия нитритом: Избыток нитрита разрушают с помощью мочевины: 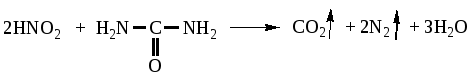 После удаления окислителей в растворах остается только йодноватая кислота в количестве, эквивалентном содержанию йода в навеске тиреоидина. Её определяют методом йодометрии: 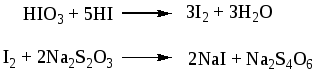 Международная фармакопея 3 издания и фармакопеи ряда стран включили метод сжигания органических веществ в атмосфере кислорода для определения галогенов. Сущность метода состоит в том, что органическое вещество сжигают в колбе, наполненной кислородом. Образующиеся продукты сгорания (галогенводородные кислоты) поглощаются раствором щелочи. Хлориды и бромид определяют меркуриметрически. При анализе йодпроизводных йодид окисляют до йодатов, а после прибавления калия йодида выделившийся йод титруют тиосульфатом. Спирты – углеводороды, в которых один или несколько атомов водорода замещены гидроксилом. Введение гидроксила в молекулу углеводорода оказывает влияние на физико-химические и биологические свойства: повышает растворимость вещества в воде; с увеличением числа гидроксильных групп снижается токсичность, появляется сладкий вкус (глицерин, маннит, сорбит). Спирты реагируют со щелочными металлами с выделением водорода: образующийся алкоголят подвергается гидролизу: Спирты проявляют восстановительные свойства, окисляясь под действием сильных окислителей (KMnO4, K2Cr2O7) до альдегидов и далее до кислот. Вследствие того, что раствор калия перманганата при этом изменяет окраску, данная реакция может быть использована для идентификации спиртов: Вторичные спирты окисляются до кетонов: 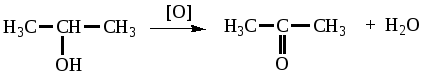 Образование сложных эфиров при взаимодействии с неорганическими и органическими кислотами используется для синтеза лекарственных средств из группы сложных эфиров, а также для идентификации спиртов (при условии, что образующийся эфир имеет характерный запах): Альдегиды и кетоны характеризуются наличием в их структуре карбонильной группы >С=О, которая у альдегидов связана с радикалом (алифатическим, ароматическим, гетероциклическим) и водородом – В химическом отношении альдегиды являются реакционно-способными соединениями, что обусловлено наличием в их молекуле сильно поляризованной двойной связи (С=О), за счёт которой происходит большинство реакций, характеризующих химические свойства альдегидов. Многие из этих реакций используются для идентификации лекарственных веществ, содержащих в своем составе карбонильную группу, для определения этих веществ в качестве примесей, в количественном анализе. 1. Альдегиды способны легко окислятся, т.е. являются сильными восстановителями. Они подвергаются окислению даже под действием таких слабых окислителей как соли тяжелых металлов до соответствующих кислот. Однако для повышения редокспотенциала пары 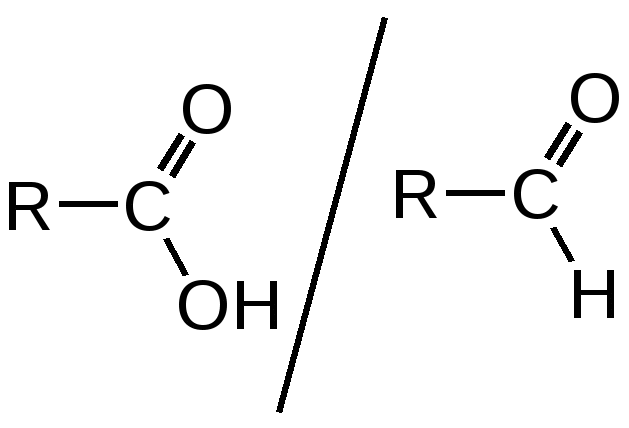 реакцию необходимо проводить в щелочной среде. реакцию необходимо проводить в щелочной среде.
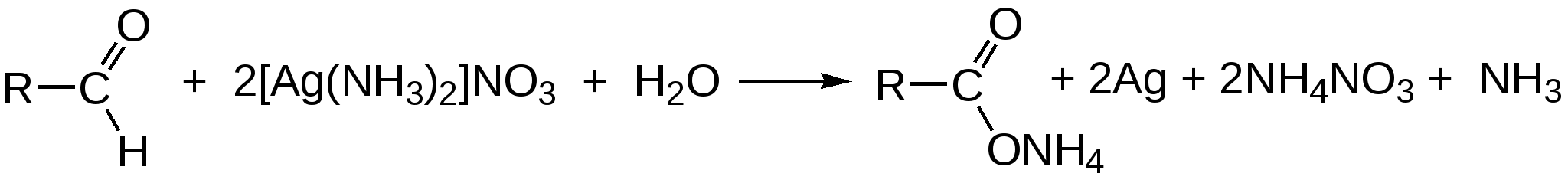
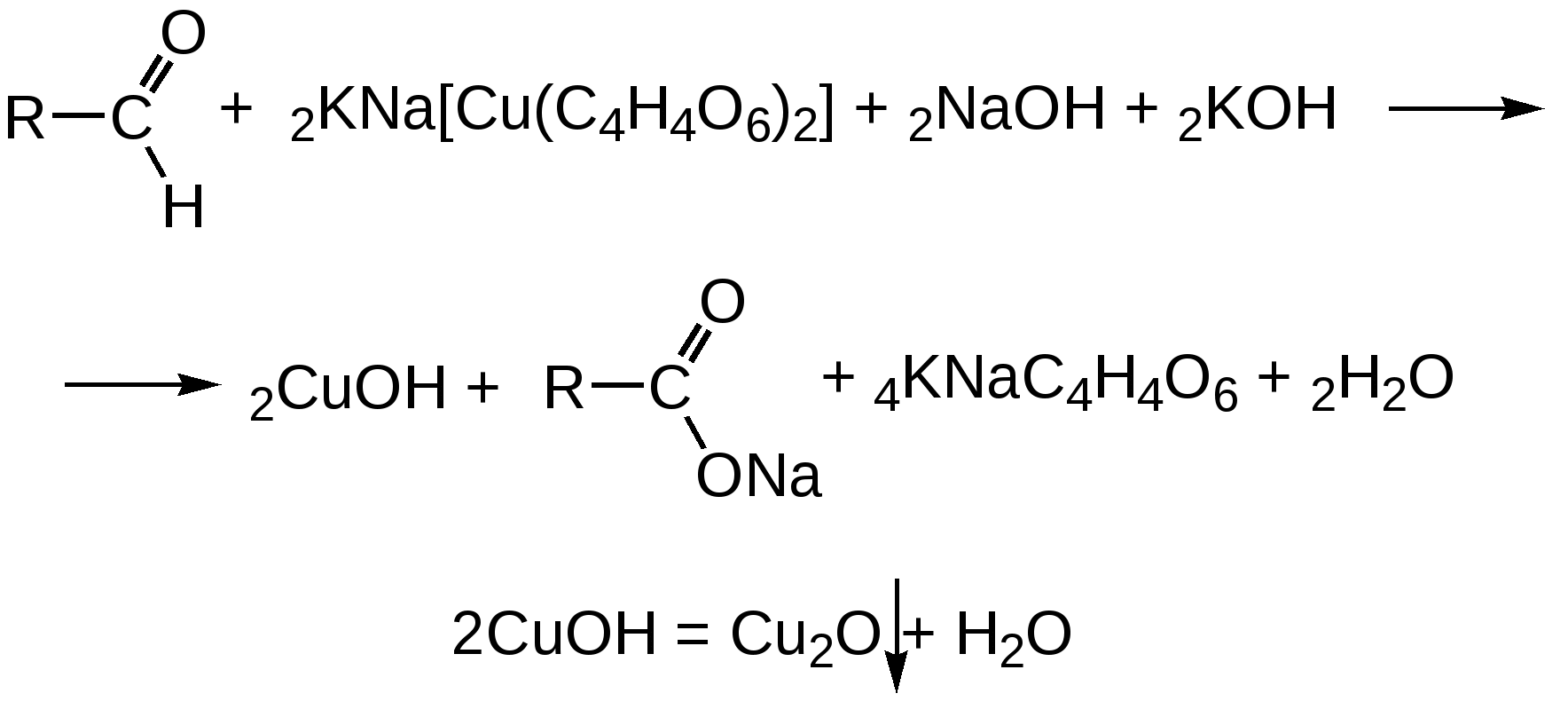
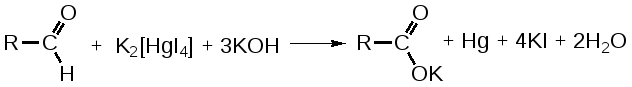 2. Для альдегидов типичны реакции присоединения по месту разрыва двойной связи. Присоединение воды приводит к образованию гидратной формы альдегида, что приводит к снижению его токсичности: 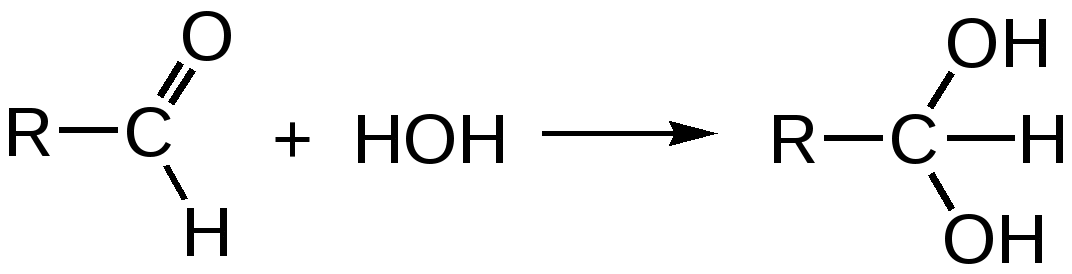 К реакциям присоединения относятся взаимодействие альдегидов с фуксинсернистой кислотой (используется для идентификации формальдегида); натрия бисульфитом. Бисульфитные производные альдегидов – кристаллические вещества, что даёт возможность использовать их образование для идентификации альдегидов (по температуре плавления) и их очистке. 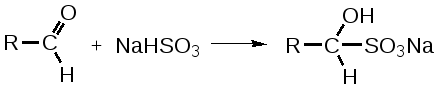 3. Характерным свойством альдегидов является их способность конденсироваться как между собой (альдольная конденсация), так и с соединениями, содержащими в своей структуре фенольный гидроксил. Эта реакция характерна для многих веществ, содержащих карбонильную группу. 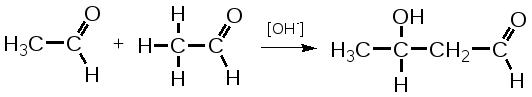 ГФУ предлагает для идентификации формальдегида его конденсацию с хромотроповой кислотой. Реакция протекает в присутствии концентрированной кислоты серной, при этом образуется продукт конденсации, окрашенный в фиолетовый цвет:  4. Для альдегидов и кетонов характерны реакции замещения, которые являются своеобразным типом реакций конденсации. Реакции замещения с аминами (алифатическими, ароматическими, гетероциклическими) используют как для идентификации альдегидов (часто получают окрашенные соединения, причем окраска может быть специфична для каждого альдегида), так и для количественного определения (оксимный метод). Для идентификации чаще всего используют замещенный гидразин, при этом образуются гидразоны; семикарбазид (семикарбазоны). Все перечисленные соединения имеют определенную температуру плавления. 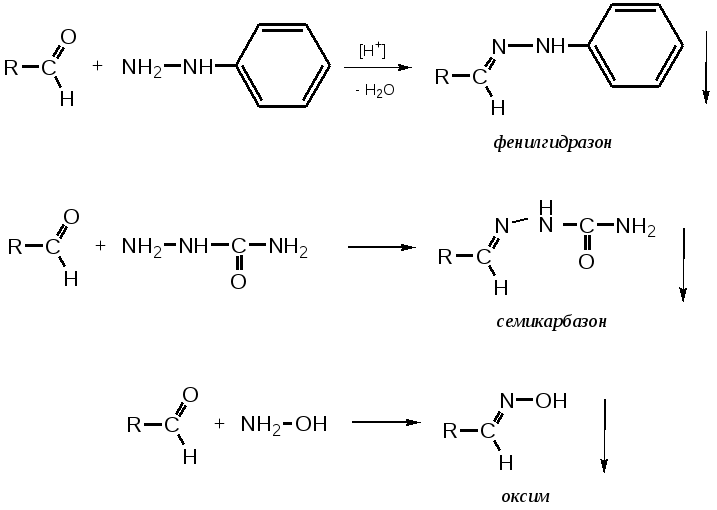 5. Способность альдегидов к полимеризации, которая может протекать в водном растворе через гидратную форму учитывается при хранении растворов альдегидов. Образующийся полимер является примесью, снижающий фармакологический эффект препарата. Например, примесь параформа в растворе формальдегида, гексаметилентетрамине 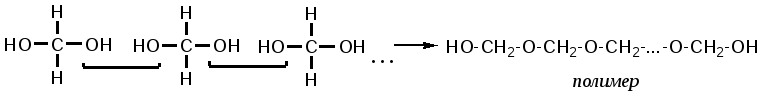 В фармакологическом отношении альдегиды проявляют антисептические и наркотические свойства. Альдегидная группа увеличивает токсичность соединений. Количественное определение альдегидов Фармакопейным методом количественного определения лекарственных средств, содержащих в своем составе альдегидную группу является метод йодометрии (обратный способ) в щелочной среде. 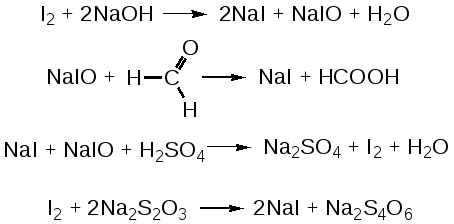 Карбоновые кислоты можно рассматривать как производные углеводородов, у которых атом водорода замещен на карбоксильную группу 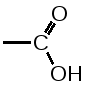 . .Присутствие карбоксильной группы увеличивает растворимость вещества. Электронная плотность карбоксильной группы смещена в сторону наиболее электроотрицательного атома кислорода карбоксильной группы, вследствие чего связь между кислородом и водородом гидроксила ослабевает, что облегчает отщепление водорода в виде катиона, т.е. наступает диссоциация кислоты, которая зависит от величины и характера радикала, связанного с карбоксильной группой. Химические свойства карбоновых кислот в основном определяются свойствами карбоксильной группы.
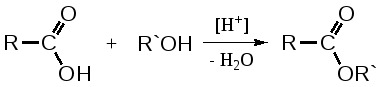
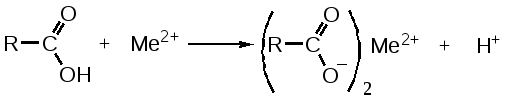
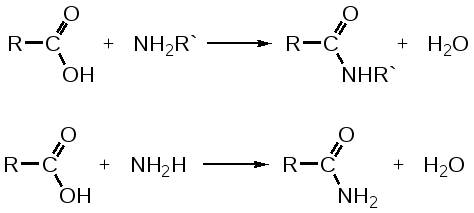 Отщепление ионогенного водорода карбоксильной группы придаёт карбоновым кислотами раздражающее действие. Чем выше степень диссоциации кислоты, тем больше она проявляет раздражающее, прижигающее действие. Введение в углеводородную цепь гидроксильной группы приводит к образованию оксикислот: Для оксикислот характерны все реакции, что и для карбоновых кислот, кроме того, за счет гидроксильной группы они проявляют восстановительные свойства и могут окисляться сильными окислителями до кетонов. Если гидроксильная группа стоит в α-положении по отношению к карбоксильной группе, происходит окисление с последующим декарбоксилированием (лактат-ион, цитрат-ион): 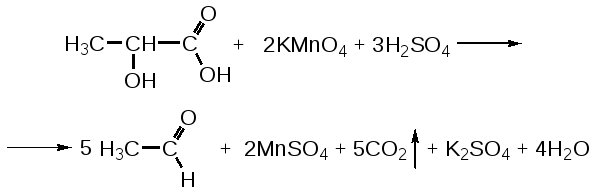 Введение в молекулу карбоновых кислот аминогруппы приводит к образованию аминокислот 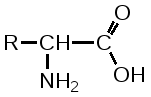 , которые проявляют амфотерные свойства и взаимодействуют как со щелочами, так и с кислотами с образованием солей: , которые проявляют амфотерные свойства и взаимодействуют как со щелочами, так и с кислотами с образованием солей: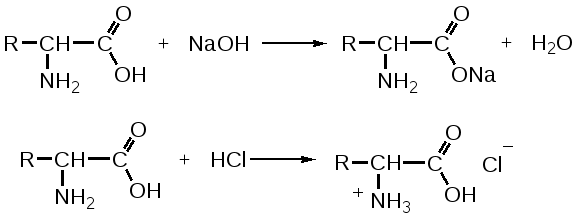 Являясь амфотерными электролитами, аминокислоты существуют в виде биполярных ионов (внутренние соли), как в водных растворах, так и в твёрдом состоянии. Это свойство объясняет растворимость аминокислот в воде:  Одним из характерных свойств аминокислот является их способность легко окисляться до NH3, CO2 и альдегидов с более короткой цепью (взаимодействие с нингидрином). При действии натрия нитритом в кислой среде или кислоты азотной, окисление идёт только по аминогруппе, при этом образуется оксикислота и выделяется азот (N2). Взаимодействие с нингидрином является общегрупповой реакцией идентификации аминокислот. Конечным продуктом реакции является образование аммонийной соли, окрашенной в сине-фиолетовый цвет: 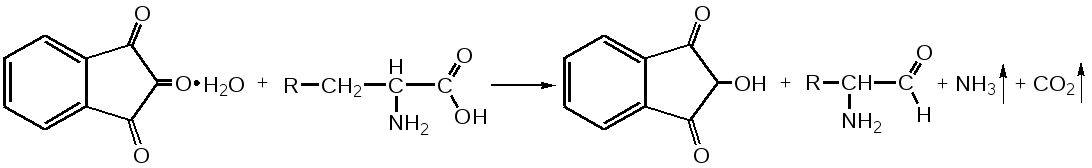 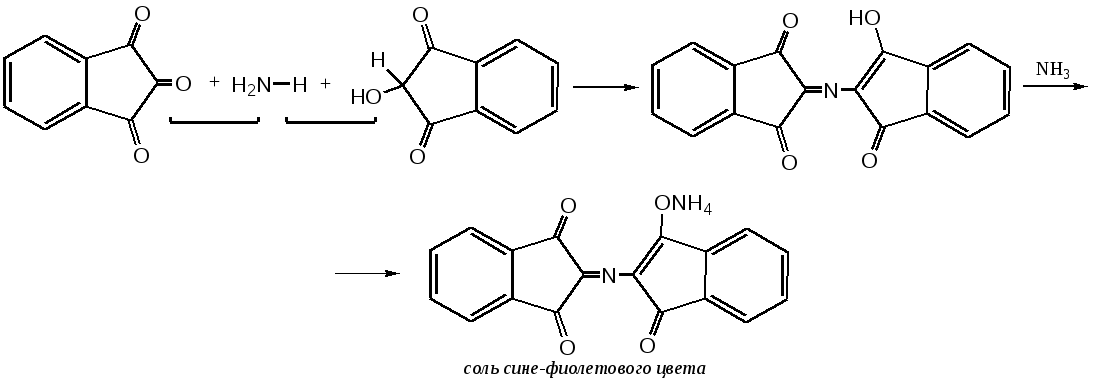 Для аминокислот также характерно образование медных солей, в которых Cu2+ связан дополнительными связями с атомом азота, образуя комплекс темно-синего цвета: 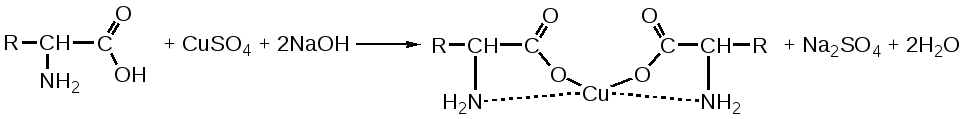 Аминокислоты являются оптически активными соединениями; для их идентификации используют определение удельного вращения. Согласно требованиям ГФУ соли органических кислот со щелочными металлами, аминокислоты и ряд лекарственных средств, представляющих собой органические основания или их соли количественно определяются методом кислотно-основного титрования в неводных средах. Данный метод используют для титрования органических лекарственных средств, которые в водной среде практически бывает невозможно определить методом нейтрализации, либо вследствие плохой растворимости этих веществ, либо вследствие нечеткого перехода окраски индикатора в точке эквивалентности, а также нейтрального характера некоторых солей. Ввиду того, что органические основания являются чаще всего слабыми электролитами, определить их количественно методом нейтрализации не представляется возможным и они определяются методом неводного титрования. Большое количество лекарственных средств является солями органических оснований с минеральными и органическими кислотами и провести количественное определение этих соединений можно также с учетом основных свойств атома азота. Преимущество метода кислотно-основного титрования в неводных средах состоит в том, что он позволяет определить соли органических кислот или оснований по фармакологически активной части молекулы. В основу теории неводного титрования положена протонная теория Бренседа-Лоури, согласно которой нейтрализация рассматривается как процесс, сопровождающийся переходом протона кислоты к основанию. Любой растворитель может выполнить функцию кислоты или основания в зависимости от характера растворённого в нем вещества. Подбирая определенный неводный растворитель можно оттитровать любые кислоты или основания независимо от величины их констант диссоциации. При количественном определении лекарственных средств из групп солей органических кислот со щелочными металлами, аминокислот; оснований и их солей с неорганическими и органическими кислотами в качестве растворителя используют протогенные (отдающие протон водорода) растворители: НСООН, СН3СООН, уксусный ангидрид и др. Молекулы этих растворителей отдают свои протоны и превращаются в основания: 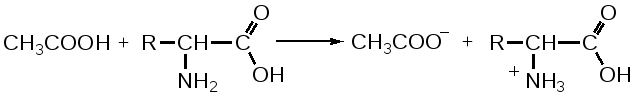 В качестве титранта используют раствор кислоты хлорной, индикатора – кристаллический фиолетовый. Количественное определение метионина (ГФУ): 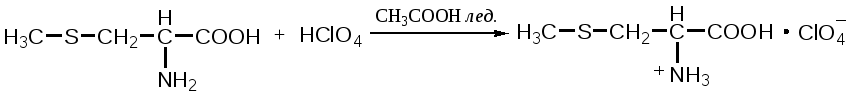 Механизм реакции: 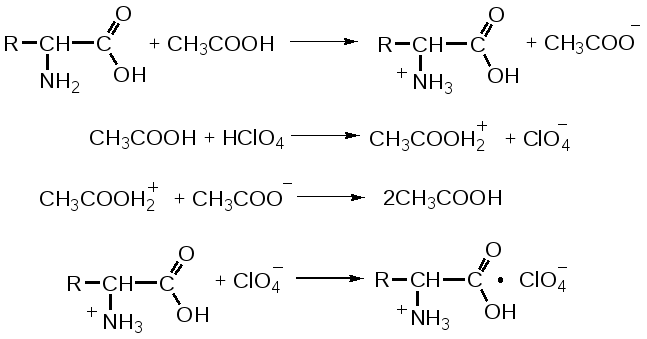 Количественное определение натрия цитрата (ГФУ): 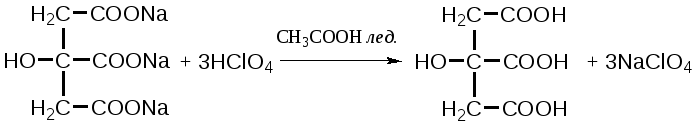 Фенолы представляет собой ароматические соединения в которых один или несколько атомов водорода в ядре замещены на гидроксилы. Соответственно различают 1,2 и 3-х атомные фенолы. 1. В отличие от алифатических спиртов, фенолы проявляют, хотя и в слабой степени ясно выраженный кислый характер и поэтому обладают способностью растворяться в щелочах с образованием фенолятов 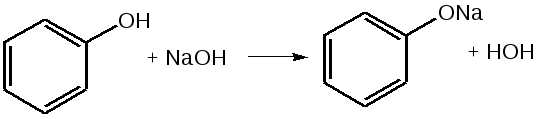 Так как кислый характер фенолов выражен слабо, феноляты в водных растворах сильно гидролизованы и. даже такая слабая кислота как угольная вытесняет фенолы из их солей. 2. Подтвердить наличие ОН- группы в фенолах можно с раствором железа(ІІІ)хлорида, эффект реакции – окрашивание раствора: 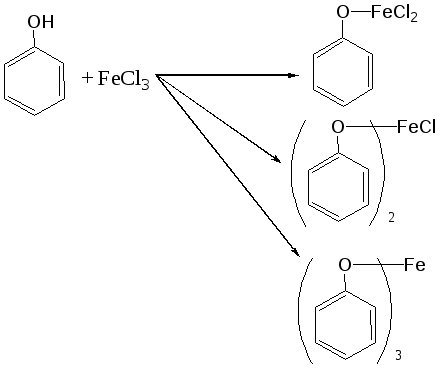 3. Фенолы также как и спирты, образуют простые и сложные эфиры: а) образование простых эфиров: 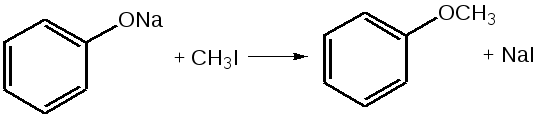 б) образование сложных эфиров: 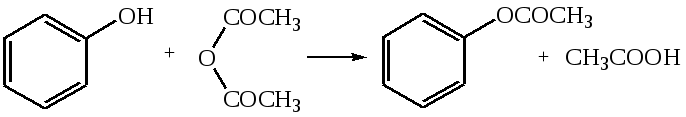 4) Введение ОН- группы в молекулу бензола приводит к глубокому изменению в свойствах самого ядра. Так, бензол устойчив к окислению, а фенолы легко окисляются; в бензоле атомы водорода замещаются в присутствии катализатора, а в феноле атомы водорода, находящиеся в о- и п- по отношению к фенольному гидроксилу легко замещаются (бромируются, йодируются даже при комнатной температуре): 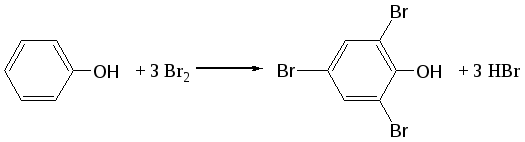 Эта реакция положена в основу количественного определения фенолов (фенола, резорцина, тимола и т.д.). Реакция окисления: при взаимодействии с гипохлоритами образуются хиноны, которые при взаимодействии с аммиаком или аминами образуют хиноимины, а далее индофенолы: 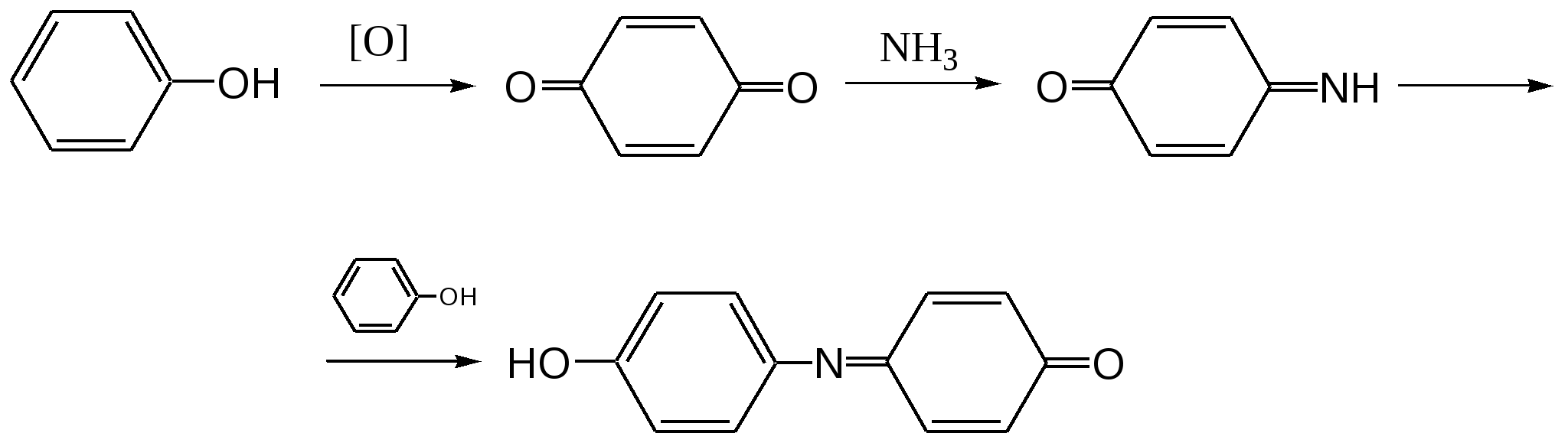 в) для идентификации фенолов используют их способность вступать в реакцию сочетания с солями диазония в щелочной среде – образование азокрасителя. Реакция высокочувствительная и дает возможность открывать фенолы в малых количествах: 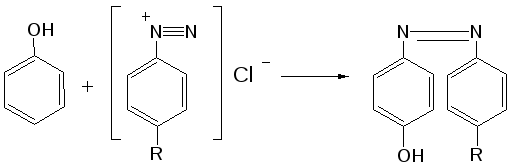 Метод броматометрии: Броматометрия (бромометрия) относится к фармакопейным методам количественного анализа, в качестве реагента, взаимодействующего с определяемым веществом, выступает раствор брома. Растворы брома неустойчивы и очень токсичны, поэтому в качестве титранта не применяются. Источником брома является бромат-бромидная смесь (KBrO3 + KBr). Бром, образующийся при взаимодействии бромат (BrO3-) и бромид (Br-) ионов в кислой среде, вступает в реакцию с определяемым веществом (см. выше). Метод применяется для количественного определения различных органических веществ, содержащих фенольный гидроксил, первичную ароматическую аминогруппу (фенола, резорцина, салициловой кислоты, сульфаниламидных препаратов, аминобензойных кислот). Существуют два способа броматометрического титрования: прямое и обратное. Фармакопейный метод количественного определения тимола (способ прямого титрования) Раствор анализируемой субстанции подкисляют, добавляют калия бромид и далее титруют смесь раствором калия бромата до исчезновения розовой окраски индикатора (метилового оранжевого). При этом протекают следующие реакции: 1. Образование брома: 2. Бромирование тимола: 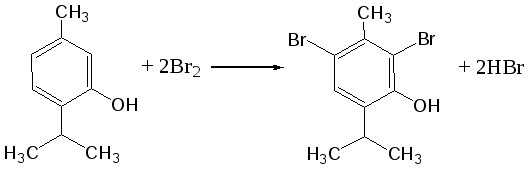 После того, как тимол прореагирует, последующая капля титранта приводит к образованию брома, разрушающего индикатор. Раствор обесцвечивается и титрование заканчивают. Параллельно проводят контрольный опыт (холостое титрование) для определения количества титранта, израсходованного на реакцию с индикатором. Фармакопейный метод количественного определения фенола, резорцина (способ обратного титрования) Анализируемый раствор подкисляют, добавляют избыточное количество титранта KBrO3, избыток KBr. Смесь перемешивают и оставляют на время для бромирования. 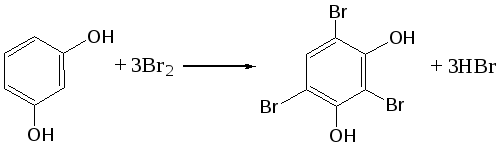 Избыток брома определяют йодометрически 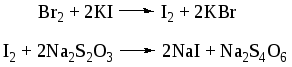 Аналогично методу броматометрического титрования для количественного определения выше перечисленных групп препаратов можно применить метод йодометрии и йодхлорметрии. Йодометрический метод анализа Йодометрический метод анализа аналогичен броматометрическому методу, отличается тем, что йодометрию проводят в среде натрия гидрокарбоната, т.к. в процессе йодирования препаратов выделяется HI, которая делает процесс обратимым. 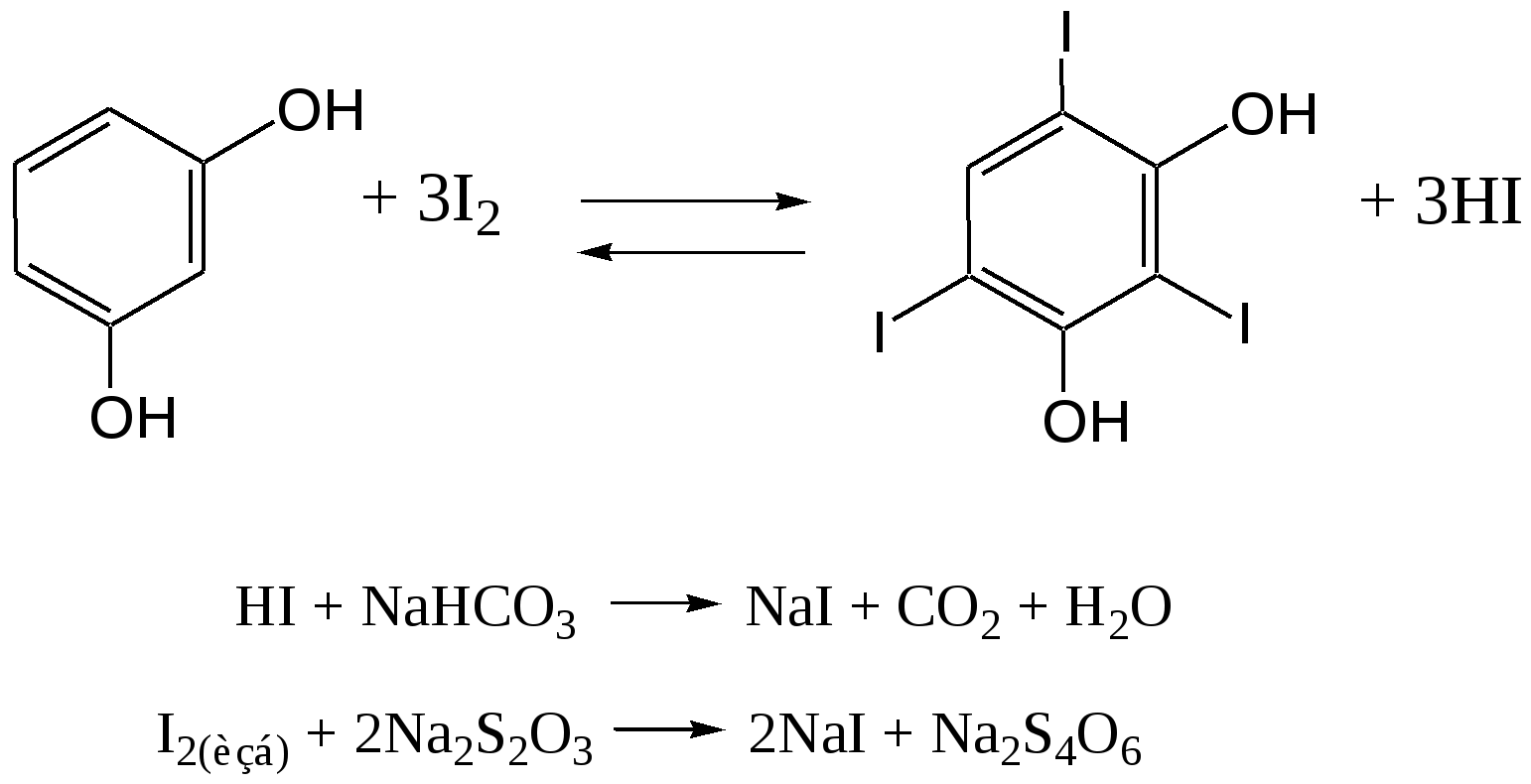 Метод йодхлорметрического определения Метод обратного титрования. В качестве титрованного раствора используют избыток йода хлорида. Происходит йодирование препарата; избыток йода хлорида определяют йодометрически: 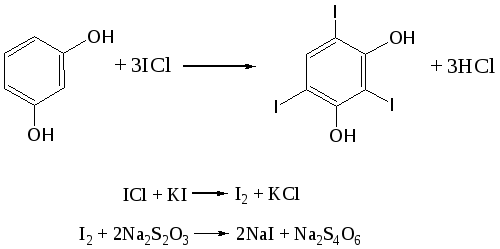 Количественное определение ароматических кислот методом кислотно-основного титрования: Количественное определение кислоты бензойной и салициловой по ГФУ проводится методом алкалиметрии. В следствии того, что кислоты трудно растворимы в воде. качестве растворителя используют спирт, который предварительно нейтрализуют по фенолфталеину. Навеску растворяют в спирте и титруют раствором натрия гидроксида с тем же индикатором. 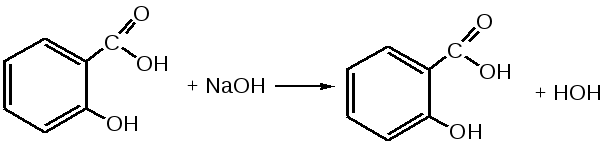 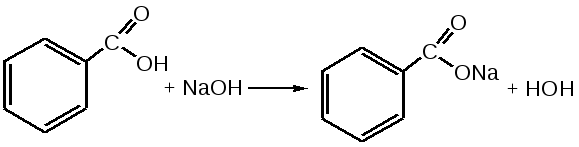 Фармакопейный метод количественного определения натриевых солей салициловой и бензойной кислот является метод кислотно-основного титрования в неводной среде. В качестве титранта используется раствор хлорной кислоты, растворитель – безводная уксусная кислота. Конец титрования определяется потенциометрически. Не фармакопейным методом количественного определения натриевых солей салициловой и бензойной кислот является метод кислотно-основного титрования в двухфазном растворителе. Титрование ведут в присутствии эфира, т.к. выделяющаяся в процессе реакции кислота (салициловая или бензойная) изменяет рН среды в кислую сторону, в результате переход окраски индикатора наступает раньше точки эквивалентности. Присутствие эфира предотвращает это явление, т.к. он извлекает выделившеюся кислоту (салициловую или бензойную). 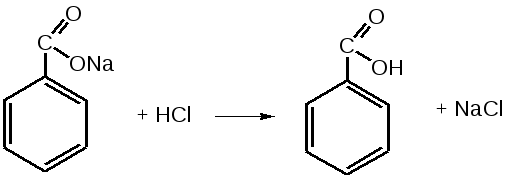 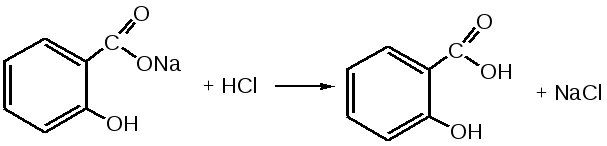 Определение первичной аминогруппы в ароматическом ядре 1) Реакция диазотировання и азосочетания. Препараты, молекулы которых содержат аминогруппы в ароматическом ядре (стрептоцид, сульфацил, сульгин, уросульфан, норсульфазол, сульфадимезин, этазол, сульфадиметоксин, сульфа- пиридазин, анестезин, новокаин и др.) способны образовывать с нитритом натрия в кислой среде соли диазония, которые при сочетании с фенолами в щелочной среде образуют окрашенные продукты реакции (азокрасители). Эта реакция является групповой. 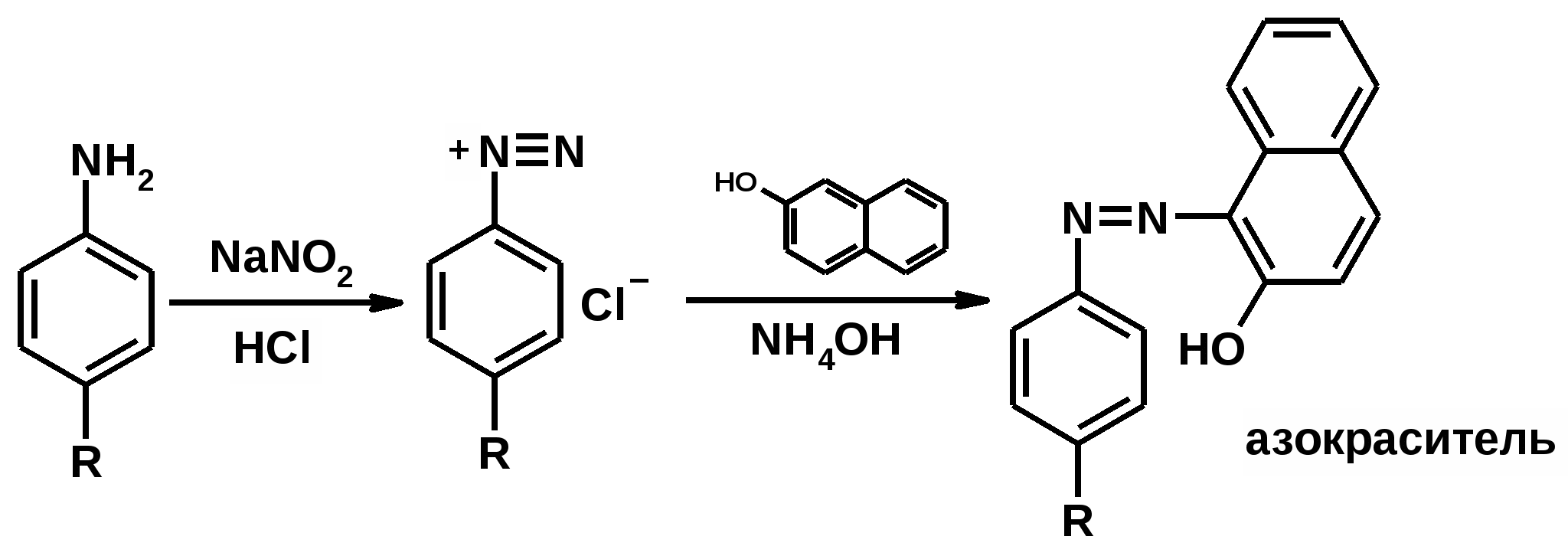 Методика. 0,05-0,1 г препарата растворяют в 1мл разведенной соляной кислоты и добавляют 2-3 капли 5% раствора нитрита натрия. Полученный раствор до-бавляют каплями в щелочной раствор β-нафтола или резорцина до получения вишнево-красного раствора. Исключение из этой группы препаратов представляет этакридина лактат, который уже после реакции диазотирования, протекающей в кислой среде, дает вишнево-красное окрашивание, характерное для его соли диазония: 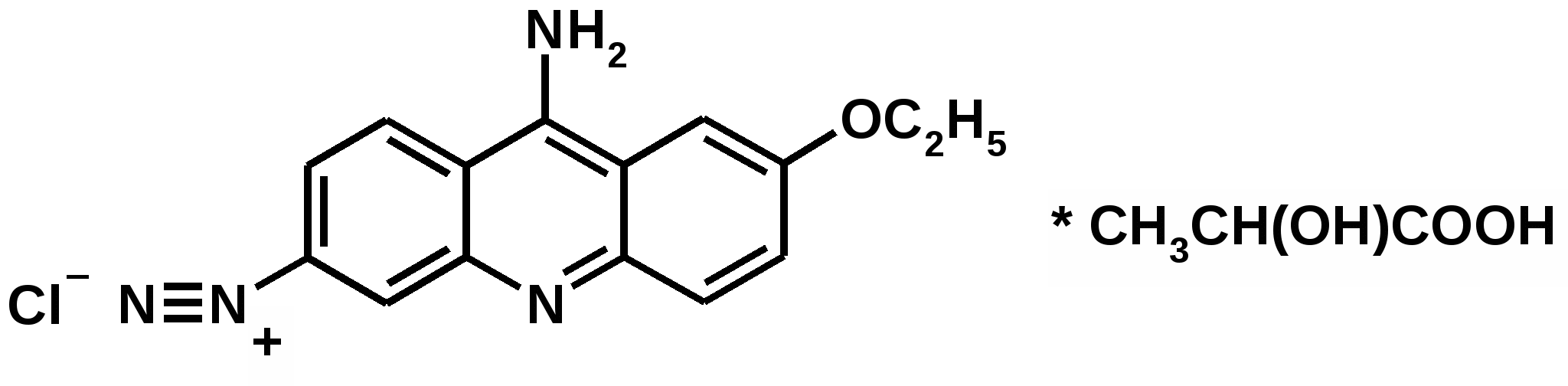 2) Реакция окисления. Некоторые первичные амины ароматического ряда легко окисляются даже кислородом воздуха с образованием окрашенных продуктов. В качестве окислителей можно применять хлорамин, белильную известь, бихромат калия в кислой среде и др. Эта реакция рекомендуется, например, для анестезина, некоторых ацилированных ароматических аминов (после гидролиза) и др. Методика. 0,05 г анестезина растворяют в 2 мл воды, добавляют 5 капель разведенной соляной кислоты и 2 мл раствора хлорамина. Через 2-3 мин добавляют 2 мл эфира и взбалтывают - эфирный слой окрашивается в оранжевый цвет: 3) Реакция образования оснований Шиффа. При взаимодействии в кислой среде с алифатическими или ароматическими альдегидами (п-диметиламинобензальдегид, альдегиды лигнина, ванилин и др.) первичные ароматические амины образуют окрашенные в желтый или оранжевый цвет основания Шиффа: 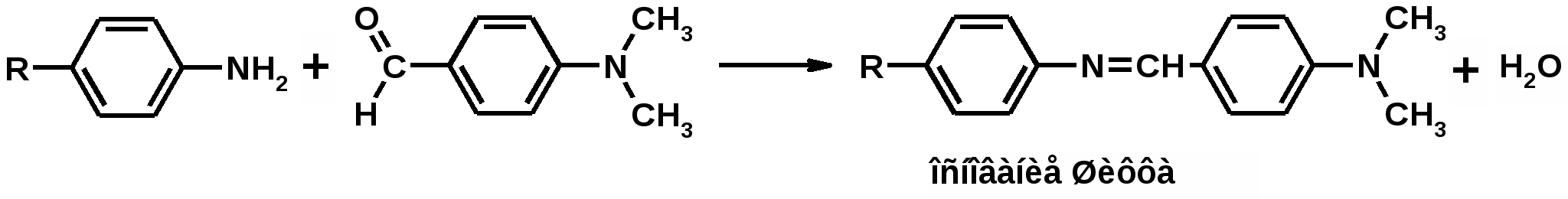 Разновидностью этой реакции является «лигниновая проба»: при нанесении на газетную бумагу или дерево (содержат лигнин) первичного амина и капли соляной кислоты появляется желтое окрашивание. Имеющиеся в лигнине альдегиды (п-оксибензальдегид, сиреневый альдегид, ванилин) с первичным амином образуют желтое шиффово основание. Определение сложноэфирной группы Сложные эфиры ( 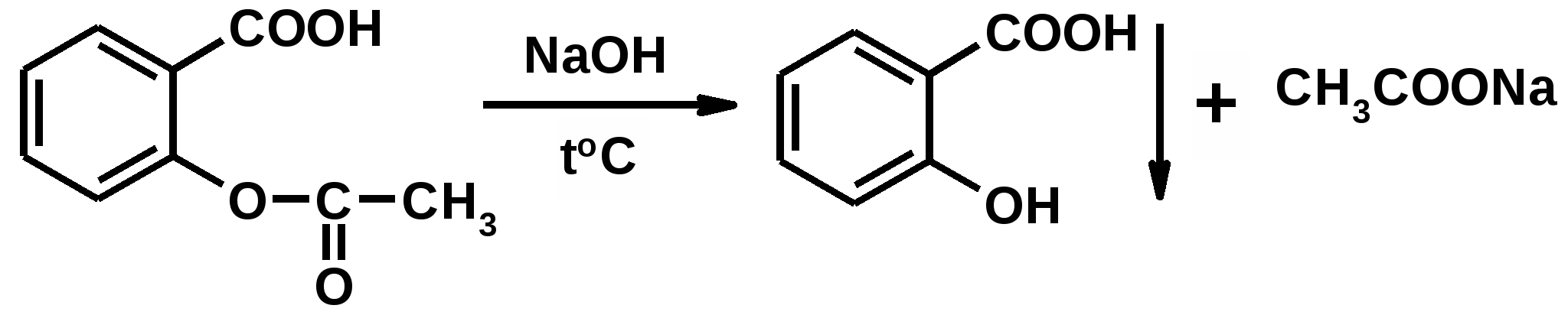 Осадок салициловой кислоты после добавления раствора хлорида окисного железа окрашивается в фиолетовый цвет. Ацетат натрия при добавлении серной кислоты и спирта образует уксусно-этиловый эфир, который определяется по запаху: Методика. 0,5 г препарата кипятят в течение 3минут с 5 мл раствора едкого натрия, затем охлаждают и подкисляют разведенной серной кислотой - выделяется белый кристаллический осадок (салициловая кислота). Раствор сливают в другую пробирку и добавляют к нему 2 мл спирта и 2 мл концентрированной серной кислоты, при этом ощущается запах уксусно-этилового эфира. К осадку добавляют 1-2 капли раствора хлорида окисного железа - появляется фиолетовое окрашивание. При гидролизе ацетилсалициловой кислоты концентрированной серной кислотой продуктами гидролиза являются уксусная кислота, которая ощущается по запаху, и салициловая кислота, которая при добавлении формалина дает розовое окрашивание: 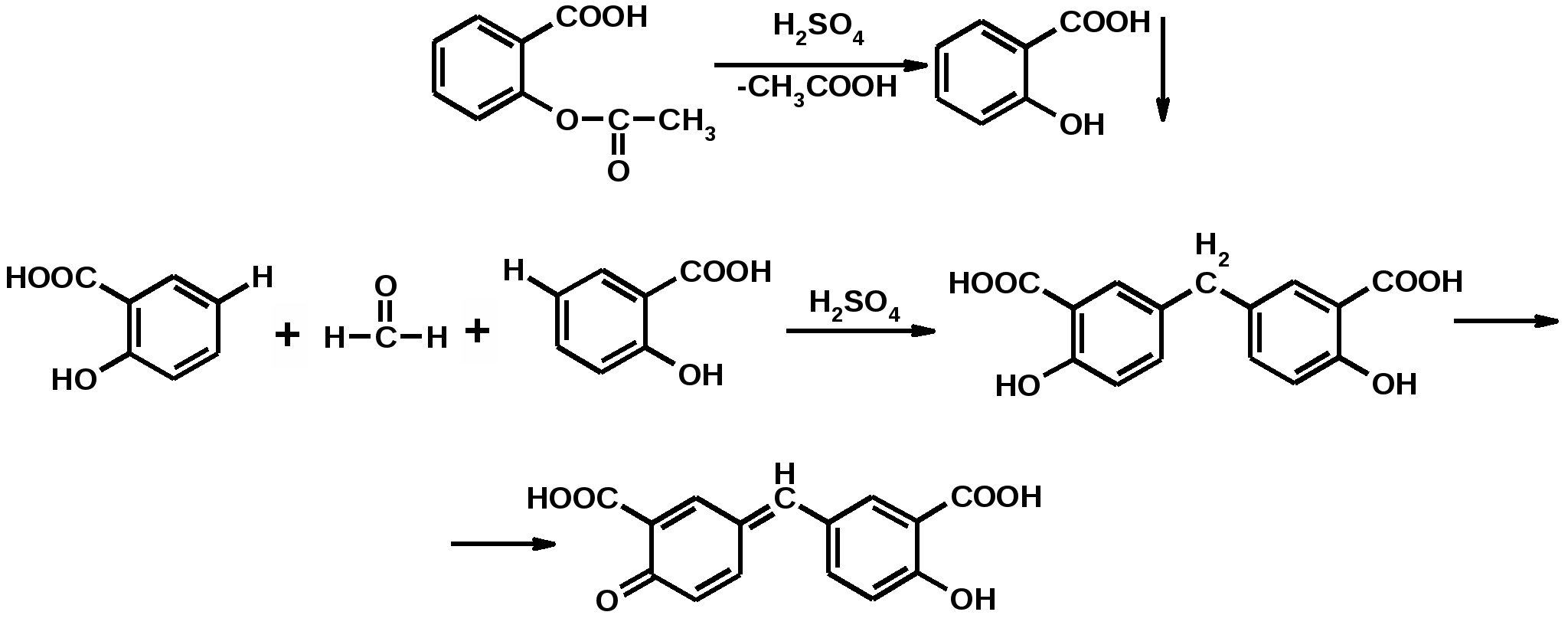 Методика. 0,2 г препарата помещают в фарфоровую чашку, добавляют 0,5 мл концентрированной серной кислоты, перемешивают и добавляют 1-2 капли воды - ощущается запах уксусной кислоты. Затем добавляют 1-2 капли формалина - появляется розовое окрашивание. Реакция образования гидроксаматов. При гидролизе сложных эфиров в щелочной среде в присутствии гидроксиламина образуются гидроксамовые кислоты, которые с металлами дают окрашенные соли - гидроксаматы. Чаще всего используются гидроксаматы Fе3+, которые в зависимости от состава соли окрашены в красно-бурый, вишнево-красный и красно-фиолетовый цвет. 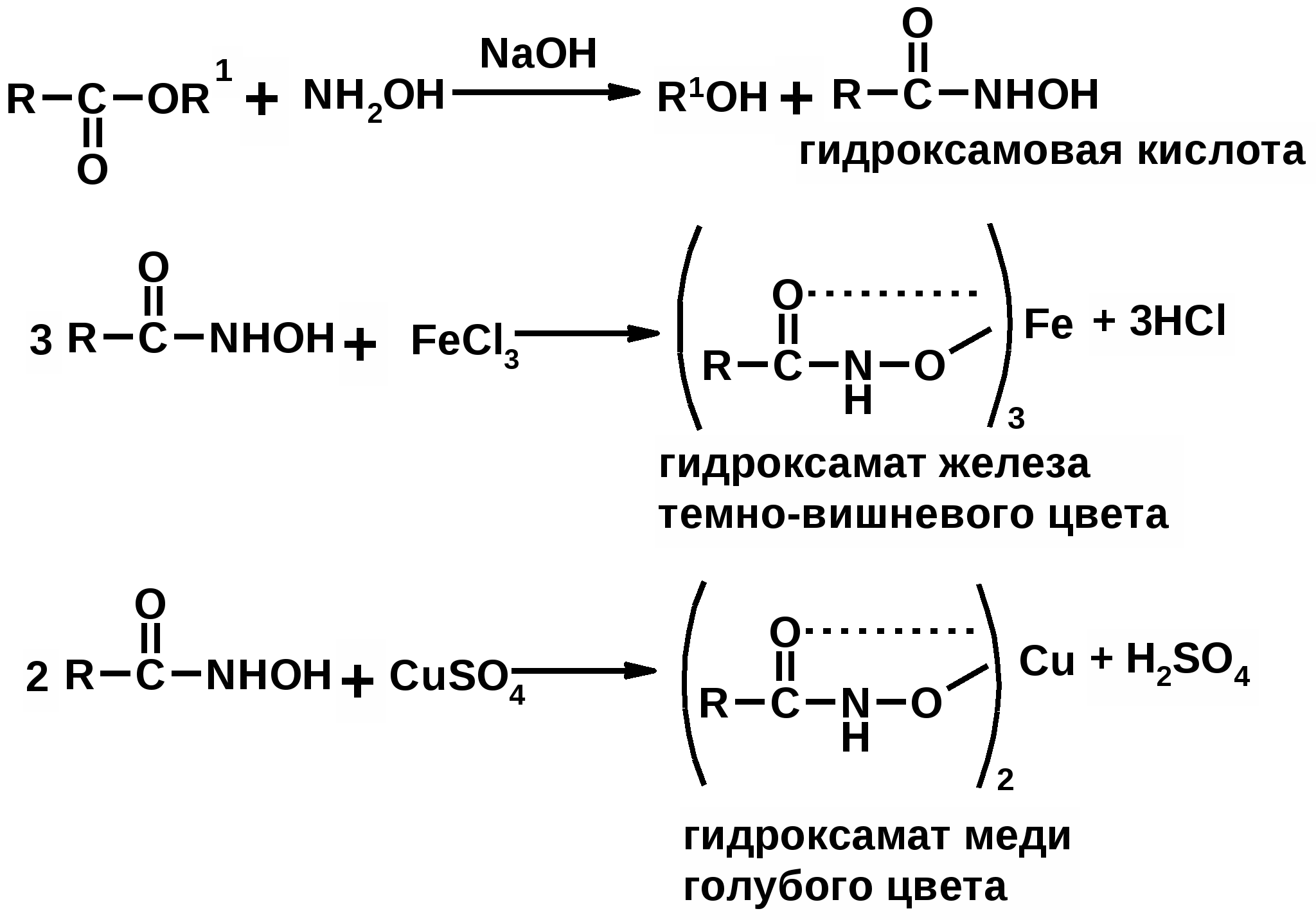 Определение простой эфирной группы Простые эфиры (R-O-R1)обладают способностью образовывать оксониевые соли с концентрированными кислотами, которые в большинстве своем окрашены. Поэтому эта реакция используется в фармацевтическом анализе для определения подлинности препаратов, имеющих в молекуле простую эфирную связь. Например, димедрол с концентрированной серной кислотой образует оксониевую соль, окрашенную в желтый цвет, переходящий в кирпично-красный: 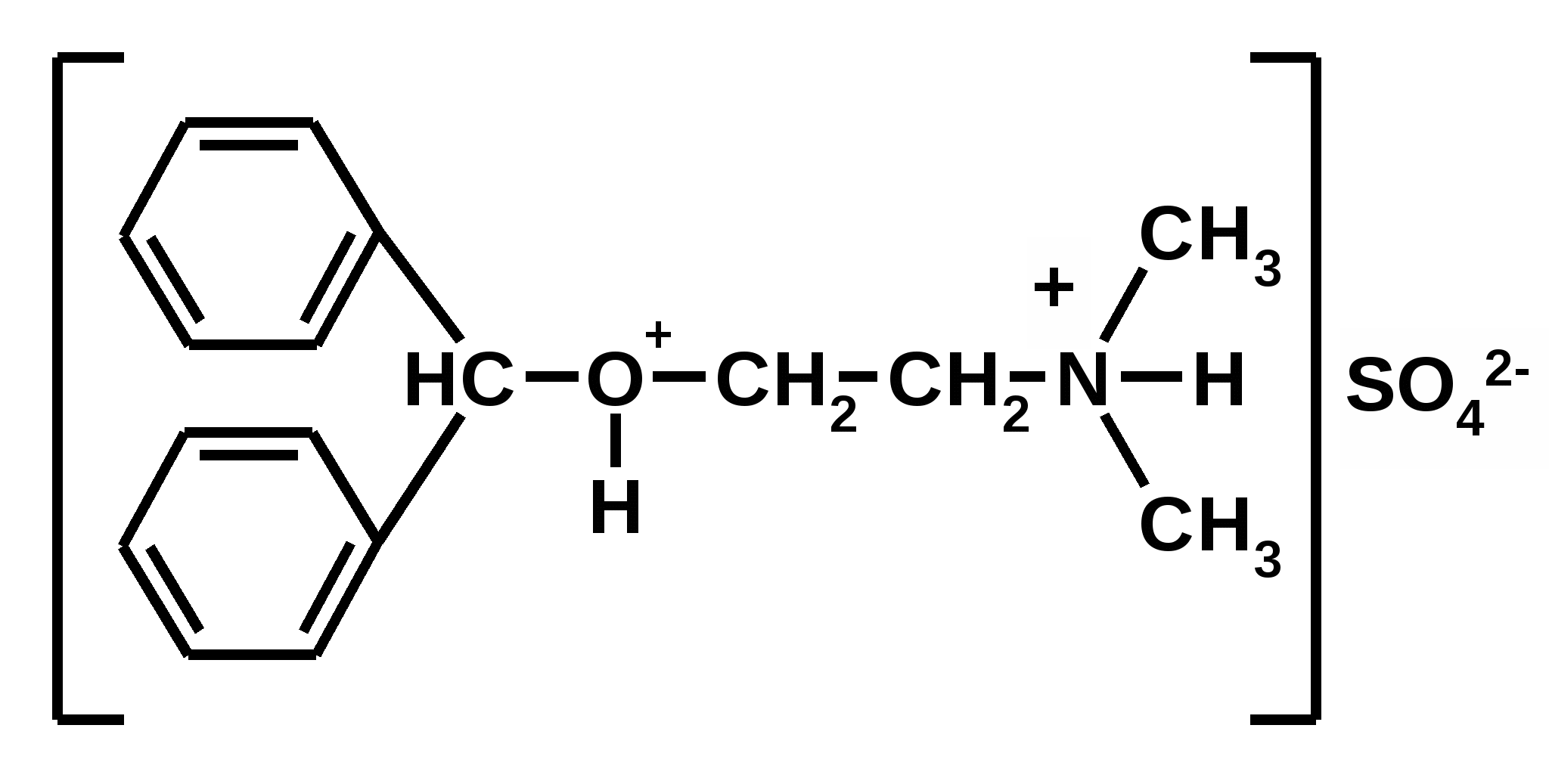
Качество изготовленной жидкой лекарственной формы во многом зависит от качества используемой воды. Вода может служить как вспомогательным веществом, так и растворителем для приготовления лекарственной формы, а также она используется для растворения или разведения лекарственных средств непосредственно перед использованием, для промывания (ополаскивания) оборудования и упаковочных материалов. В зависимости от предполагаемого назначения в фармацевтической практике используют воду различной степени очистки. В Европейскую, так и в ГФУ, дополнении I к ГФУ включены монографии на «Воду очищенную», «Воду для инъекций», а также «Воду высокоочищенную». Монография на «Воду высокоочищенную» включена в ЕФ 4-го издания, которая введена в действие с 1 января 2002 года, для тех фармацевтических продуктов, приготовление которых требует использования воды особого, повышенного биологического качества. В процессе контроля качества воды возникает ряд проблем. Критическим является обеспечение устойчивой микробиологической чистоты, надежное удаление бактерий и бактериальных эндотоксинов. Во всем мире в фармацевтической индустрии прилагаются значительные усилия и расходуются огромные средства по усовершенствованию систем очистки воды и разработки простых, объективных методов оценки качества воды. наиболее широко применяемым методом очистки воды является дистилляция, которая имеет долгую историю достоверного функционирования. Этот метод может быть валидирован, поэтому остается официально принятым для получения воды для инъекций. Широко обсуждаются положительные и отрицательные стороны метода двойного обратного осмоса и связанные с этим технологии. Однако, на международном симпозиуме Комиссии Европейской Фармакопеи в 1999 году было принято решение о том, что в настоящее время указанный метод невозможно считать достаточно надежным по сравнению с техникой дистилляции для получения воды для инъекций. В Дополнении к первому изданию ГФУ приведены три статьи, регламентирующие качество используемой при изготовлении лекарственных средств воды дистиллированной. Как пример предлагаем рассмотреть следующую фармакопейную статью: ВОДА ОЧИЩЕННАЯ В КОНТЕЙНЕРАХ Вода очищенная в контейнерах - это вода очищенная «in bulk», расфасованная в подходящие контейнеры, хранящаяся в условиях, обеспечивающих требуемую микробиологическую чистоту, и не содержащая никаких добавленных веществ. СвойстваПрозрачная, бесцветная жидкость без вкуса и запаха. Испытания на чистоту вода очищенная в контейнерах должна выдерживать требования раздела «Испытания на чистоту» воды очищенной «in bulk»», а также испытания приведенные ниже. Кислотность или щелочность. К 10 мл субстанции, свежепрокипяченной в пробирке из боросиликатного стекла и охлажденной, прибавляют 0,05 мл раствора метилового красного Р; полученный раствор не должен окрашиваться в красный цвет. К 10 мл субстанции прибавляют 0,1 мл раствора бромтимолового синего Р1; раствор не должен окрашиваться в синий цвет. Окисляющиеся вещества. К 100 мл субстанции прибавляют 10 мл кислоты серной разведенной Р, прибавляют 0,1 мл 0,02 М раствора калия перманганата и кипятят в течение 5 мин; раствор должен оставаться слабо-розовым. Хлориды. К 10 мл субстанции прибавляют 1 мл кислоты азотной разведенной Р и 0,2 мл раствора серебра нитрата Р2; в течение 15 мин не должно быть видимых изменений раствора. Сульфаты. К 10 мл субстанции прибавляют 0,1 мл кислоты хлористоводородной разведенной Р и 0,1 мл раствора бария хлорида Р1; в течение 1 ч не должно быть видимых изменений раствора. Аммония соли. Не более 0.00002% (0,2 ppm). К 20 мл субстанции прибавляют 1 мл раствора калия тетрайодомеркурата щелочного Р; через 5 мин окраска полученного раствора должна быть не интенсивнее окраски эталона, приготовленного параллельно с испытуемым раствором прибавлением 1 мл раствора калия тетрайодомеркурата щелочного Р к смеси 4 мл эталонного раствора аммония (1ррm NH4) Р и 16 мл воды, свободной от аммиака, Р. Кальций и магний. К 100 мл субстанции прибавляют 2 мл аммиачного буферного раствора рН 10,0Р, 50 мг протравного черного 11 индикаторной смеси Р и 0,5 мл 0,01 М раствора натрия эдетата; появляется слабо-синее окрашивание. Сухой остаток. 100 мл субстанции упаривают досуха на водяной бане и сушат при температуре от 1000С до 1050С до постоянной массы. Масса сухого остатка не должна превышать 1 мг (0,001%). Микробиологическая чистота. Общее число жизнеспособных аэробныхмикроорганизмов (2.6.12) должно быть не более 102 в 1мл. Определение проводят методом мембранной фильтрации, используя плотную питательную среду В. Маркировка В необходимых случаях указывают:
__________________________________________N Вода очищенная «in bulk» Испытания на чистоту Если при производстве не проводится определение электропроводности, субстанция должна также выдерживать требования раздела “Испытания на чистоту” воды очищенной в контейнерах.
Формулы расчета, необходимые для проведения титриметрических методов анализа Результаты анализа существенно зависят от точности концентрации титрованного раствора. Изготовление титрованных растворов может осуществляться на договорных условиях в контрольно-аналитической лаборатории. Государственная фармакопея Украины рекомендует готовить титрованные растворы в соответствии с обычными требованиями химического анализа. В ГФУ концентрацию титрованных растворов выражают с помощью молярности. Под молярной концентрацией (М) понимают количество молей вещества, растворенного в 1л раствора. Молярность рассчитывают как отношение количества растворенного вещества к объему (размерность – моль/л). Титр – выраженная в граммах масса растворенного вещества, находящаяся в 1 мл раствора. Титр рассчитывают, как отношение массы растворенного вещества к объему (размерность – г/мл или мг/мл). Титр титранта по определяемому веществу выраженный в граммах или миллиграммах – это количество определяемого вещества, которое взаимодействует с 1 мл титрованного раствора. Титрованные растворы готовят из химически чистых веществ, чистых для анализа или путем растворения фиксаналов (точного количества вещества, находящегося в запаянной ампуле), в определенном объеме свежепрокипяченной и охлажденной дистиллированной воды или другого растворителя. При приготовлении титрованных растворов из исходных веществ концентрация полученного раствора может отличаться от требуемой. В этом случае рассчитывают коэффициент поправки к молярности. Коэффициент (К) показывает во сколько раз концентрация приготовленного раствора отличается от теоретической. Допускается коэффициент поправки в пределах от 0,9 до 1,1 (ГФУ требует – не более 10% от теоретической). Более разбавленные растворы получают разведением титрованных растворов водой, свободной от оксида углерода. При этом поправочные коэффициенты полученных растворов остаются такими же как и у исходных. Данные растворы готовят непосредственно перед употреблением. Титрованные растворы хранят при комнатной температуре, защищая их при необходимости от воздействия углекислоты, влаги воздуха и от прямых солнечных лучей. Согласно требованиям Государственной фармакопеи, титрованные растворы имеют ограниченный срок годности. Провизор-аналитик должен следить за их качеством и своевременно обновлять титрованные растворы. Титр определяемого вещества рассчитывают по формуле: где: М – молярность титрованного раствора, моль/л; М.м. – молярная масса определяемого вещества, г/моль; К1 – коэффициент при определяемом веществе в уравнении химической реакции определения количественного содержания К2 – коэффициент при титранте в уравнении химической реакции определения количественного содержания Перечень титрованных растворов приведенных в ГФУ с указанием их концентрации
|
