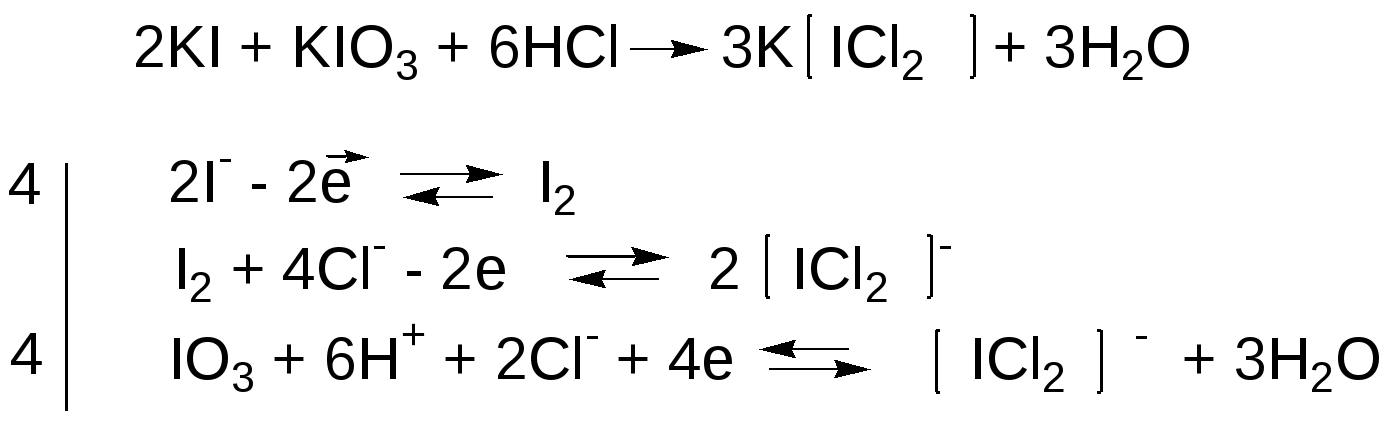|
|
МОДУЛЬ 1 Смысловой модуль 1.2. Анализ качества лекарственных веществ илекарственныхформ в условиях аптеки. МОДУЛЬ 1 Смысловой модуль 1.2. Анализ качества лекарственных в. Учебнометодическое пособие для студентов IV курса фармацевтического факультета специальности Фармация Запорожье 2012
I- + AgNO3 → AgI + NO 3-
до т.э. {(AgI)n · mI- (m-n)Ag +}x xAg+
в т.э. {(AgI)n · mAg+ (m-n)NO3-}x+ xNO3 -
после т.э. {(AgI)n · mInd (m-n)Ind}x+ xInd-
Описанные выше методы осадительного титрования не являются избирательными, при анализе раствора смеси галогенидов определяется их общее содержание. Для определения йодидов в растворах с хлоридами и бромидами существуют избирательные методы.
Метод Кольтгофа является методом прямого аргентометрического титрования. Используют обычно для определения йодидов в присутствии хлоридов и бромидов. Суть метода заключается в том, что осадок йодида серебра менее растворим, чем хлориды и бромиды серебра и поэтому выпадает в осадок в первую очередь. Для фиксирования точки эквивалентности к исследуемому раствору прибавляют раствор калия йодата, кислоту серную разведенную и крахмал
5KI + KIO3+3H2SO4=3K2SO4+3H2O+3I2
Раствор медленно, тщательно перемешивая, титруют 0,1М раствором серебра нитрата до перехода синей окраски в желтую, обусловленную цветом осадка серебра йодида. В процессе титрования в растворе уменьшается концентрация калия йодида, равновесие смещается влево, уменьшается концентрация йода, и синяя окраска исчезает. Возможность определения йодидов в присутствии остальных галогенидов достигается потому, что в растворе образуется буферная смесь, поддерживающая значение рН ‹ 5,5. Бромиды в этих условиях не окисляются йодатом калия при его незначительной концентрации.
В точке эквивалентности из раствора исчезают йодид-ионы, что сопровождается исчезновением синего окрашивания.

Определению йодидов по методу Кольтгофа не мешают хлориды. При наличии бромидов необходимо до прибавления серной кислоты прилить к реакционной смеси 5 мл 10% раствора карбоната аммония.
Другим методом прямого аргентометрического титрования является метод Шика (с внешним индикатором – нитрозо-крахмальной бумагой).
К анализируемому раствору приливают 4-5 мл воды, 5 мл разведенной серной кислоты и титруют раствором нитрата серебра. Индикатор – нитрозокрахмальная бумага (полоска фильтровальной бумаги, пропитанная смесью растворов нитрата натрия и крахмала). При нанесении на ее поверхность капли раствора до момента эквивалентности бумага окрашивается в синий цвет вследствие протекания реакции

При титровании серебра нитратом, когда йод-ионы удаляются из системы, происходит обесцвечивание крахмала.

Цвет бумаги не изменится после достижения точки эквивалентности. Для получения более точных результатов целесообразно предварительно рассчитать количество титровального раствора нитрата серебра, необходимого для титрования взятого количества йодидов, или выполнить ориентировочное титрование, а затем при повторном титровании иметь в виду результаты расчетов.
Метод йодатометрии
Йодиды по ГФУ определяют методом иодатометрии, основываясь на их восстановительных свойствах. Происходит процесс окисления лекарственных веществ титрованным раствором калия иодата KIO3. Водный раствор исследуемого препарата подкисляют кислотой хлористоводородной и титруют 0,05М раствором калия иодата до перехода окраски от красной до желтой. Прибавляют хлороформ и продолжают титровать, интенсивно перемешивая до обесцвечивания хлороформного слоя. При этом иодиды вначале окисляются до свободного йода, который затем окисляется калия иодатом и в среде кислоты хлористоводородной образуют комплекс, который извлекается хлороформом. Точку эквивалентности определяют по обесцвечиванию хлороформного слоя: когда йод превратится в монохлорид йода.
5J- + JO3- + 6H+ → 3J2 + 3H2O
J2 + 4HCl → 2H[JCl2] + 2H+
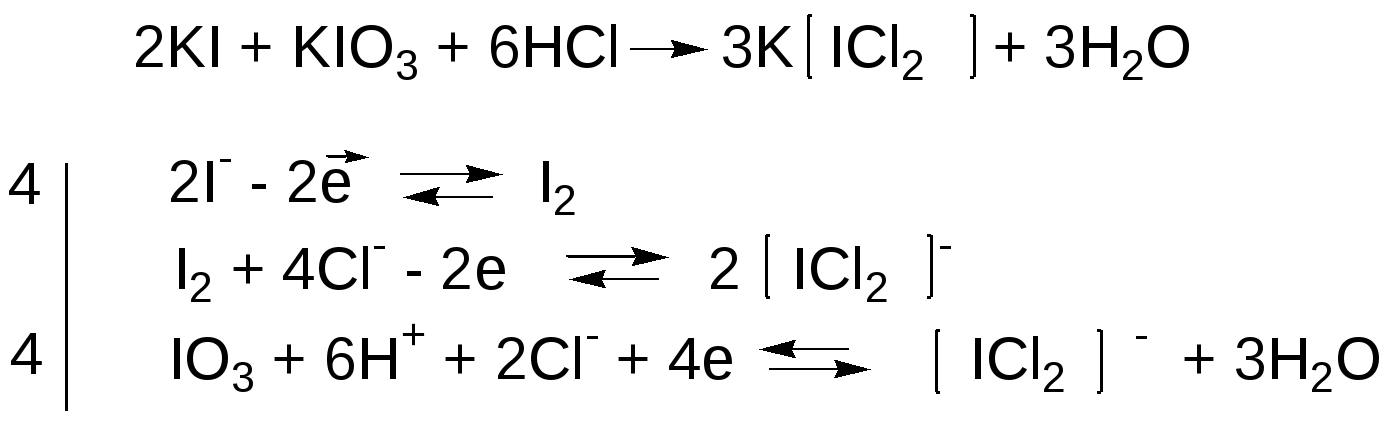
Меркуриметрическое определение.
При добавлении сильно ионизированной соли окисной ртути (например, нитрата ртути) к испытываемому раствору хлорида из раствора исчезают ионы Cl- вследствие образования малодиссоциированного галогенида ртути. Малейший избыток ионов ртути реагирует с индикатором дифенилкарбазидом, с образованием окрашенного в красно-фиолетовый цвет соединения.
2NaCl (NaBr) + Hg(NO3)2 → HgCl2 (HgBr2) + 2NaNO3
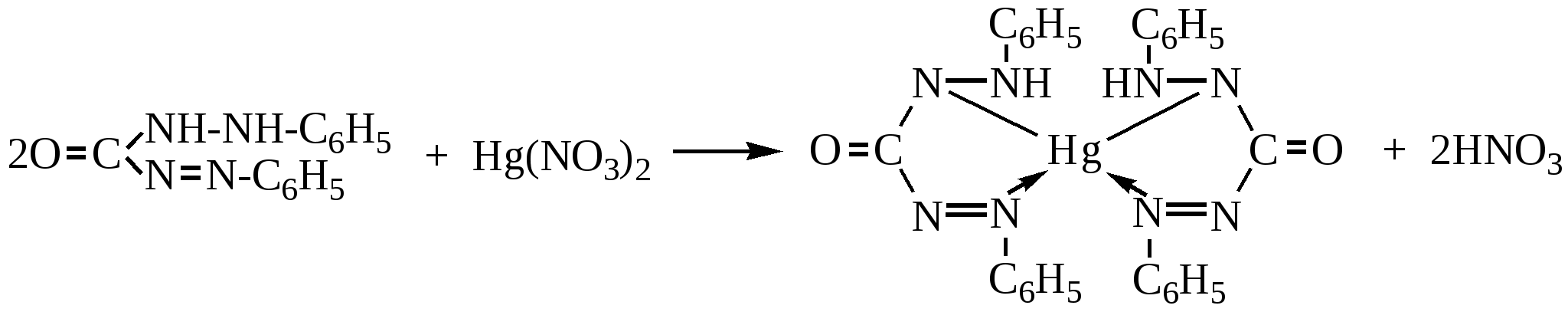
Точку эквивалентности можно установить с помощью нитропруссида натрия:(титруют до образования мути) требуется вводить поправку на индикатор.
Na2[Fe(CN)5NO] + Hg(NO3)2 → Hg[Fe(CN)5NO]↓ + 2NaNO3
Примечание: Для улучшения условий титрования можно к водному раствору хлорида или бромида прибавить несколько миллилитров 95% этилового спирта.
Меркуриметрическое определение йодидов. Точную массу калия или натрия йодида растворяют в минимальном объеме воды и титруют без индикатора раствором нитрата окисной ртути до появления не исчезающей розовой мути:
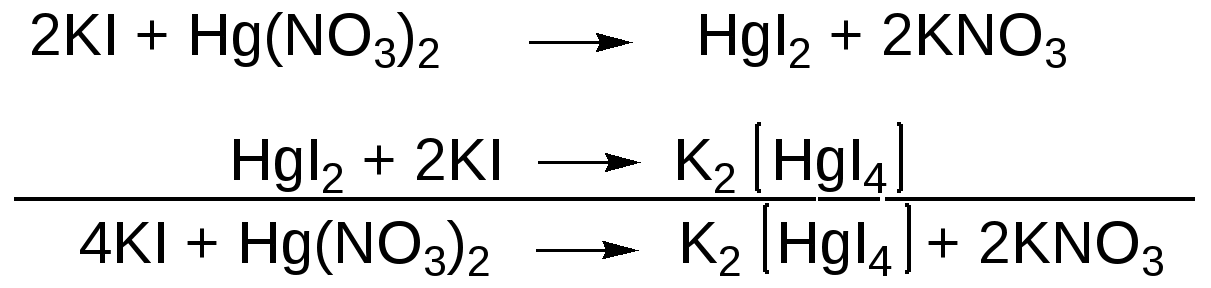
Избыточная капля нитрата окисной ртути реагирует с комплексом K2HgI4 c выделением осадка дийодида ртути, который и наблюдается в конце титрования:
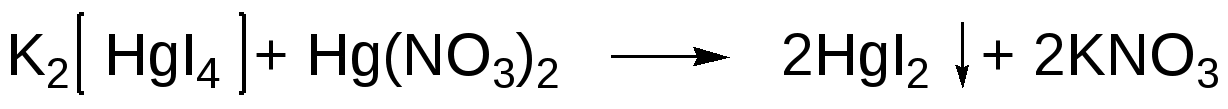
Перманганатометрическое определение йодидов. Около 0,05 г калия или натрия йодида растворяют в 5 мл воды, прибавляют 5 мл кислоты хлористоводородной 1:1 (приблизительно 18%) и титруют 0,02М. раствором калия перманганата до появления светло-бурой окраски раствора, затем прибавляют 1 мл раствора крахмала и продолжают титрование по каплям до перехода окраски в лимонно-желтую:
2KMnO4 + 5KI + 16HCl → 5IСl + 7KCl + 2MnCl2 + 8H2O
IСl + HCl → H[ICl2].
Ионообменная хроматография
Ионообменная хроматография является методом, в основе которого лежит обмен между ионами анализируемого раствора и ионогенными группами сорбента.
Иониты (ионообменные сорбенты) представляют собой неорганические или полимерные органические соединения, содержащие в своей структуре ионогенные группы, способные к обмену ионов.
В зависимости от характера ионогенных групп ионообменные сорбенты разделяются на катионообменные и анионообменные.
Катионообменные сорбенты содержат сульфо-, карбоксильные, оксифенильные или другие группы, способные к обмену катионов.
Анионообменные сорбенты являются ароматическими или алифатическими аминами или четвертичными аммониевыми основаниями, способными к обмену анионов.
Реакцию обмена между катионами, находящимися в растворе (М2+) и на катионообменном сорбенте (М1+), можно представить следующей схемой:
R-M1+ + M2 + A- 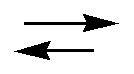 R-M2+ + M1+A- R-M2+ + M1+A-
Где R- - анион катионообменного сорбента;
А- - анион, находящийся в растворе.
Наиболее часто применяются следующие ионообменные сорбенты: сильнокислотные, содержащие сульфогруппы, -КУ-2, СДВ-3, СБС, слабокислотные, содержащие карбоксильные группы,- КБ-4, КБ-4П-2, и др.; сильноосновные анионообменные сорбенты – АВ-17, АВ-16, ЭДЭ-10 II и слабоосновные АН-2Ф, Н-О.
Н-формой катионообменного сорбента называют сорбент, содержащий обменные ионы водорода; солевой формой – сорбент, содержащий катионы металлов. ОН – формой анионообменного сорбента называют сорбент, содержащий обменные ионы гидроксила. Применяются также анионообменные сорбенты в хлоридной, карбонатной и других формах.
Методика работы с ионообменными сорбентами для количественного анализа состоит из следующих операций:
подготовка сорбента;
подготовка колонки;
хроматографирование и определение содержания анализируемого вещества;
регенерация сорбента;
Подготовка сорбента. 5-10 г сорбента ( с размером частиц 0,2-0,5 мм) помещают в стакан, промывают 2-3 раза дистиллированной водой, заливают разведенной соляной кислотой и оставляют набухать в течение 12 часов при периодическом перемешивании.
В случае анионообменного сорбента кислоту хлористоводородную отмывают несколько раз водой, заливают 5% раствором натрия карбоната или 2% раствором натра гидроксида и оставляют на 2-4 часа. Настаивание с раствором натрия карбоната или щелочи повторяют несколько раз до отрицательной реакции на хлор-ион. Обработку раствором щелочи проводят в делительной воронке для предупреждения поглощения углекислого газа из воздуха. Подготовленные таким образом сорбенты промывают 1-2 раза дистиллированной водой, переносят в колонку и промывают водой до нейтральной реакции.
Подготовка колонки. Колонка для хроматографирования представляет собой стеклянную трубку, нижняя суженная часть которой снабжена стеклянным краном или каучуковой трубкой с зажимом для регулирования скорости фильтрации. На высоте 0,5-1 см от места сужения трубки впаивают пористую стеклянную пластинку (фильтр №1).
Обычно применяют колонки длиной 15-25 см с внутренним диаметром 1-2 см, однако размеры колонок могут быть и другими.
Колонку устанавливают в строго вертикальном положении. Кран закрывают и колонку на ¾ наполняют дистиллированной водой. Затем подготовленный сорбент смывают в колонку, одновременно открывая кран. Необходимо строго следить, чтобы между зернами сорбента в колонке не задерживались пузырьки воздуха. Оставшиеся пузырьки воздуха можно удалить, пропуская через колонку снизу вверх струю воды. Когда слой сорбента достигнет высоты 8-10 см, закрывают кран и поверх сорбента помещают тампон из ваты, препятствующий всплытию зерен к поверхности раствора.
Хроматографирование и определение содержания анализируемого вещества. Перед началом определения следует проверить реакцию воды, вытекающей из колонки; она должна быть нейтральной. В противном случае колонку следует дополнительно промыть водой. Затем 5-10 мл анализируемого раствора, приготовленного, как указано в соответствующей статье, переносят в хроматографическую колонку, поддерживая скорость вытекания 20-25 капель в минуту. Собирают вытекающую жидкость в коническую колбу, промывают колонку водой до нейтральной реакции, собирая промывную воду в ту же колбу и поддерживая ту же скорость вытекания жидкости из колонки.
В полученном растворе определяют содержание анализируемого вещества титрованием раствором щелочи или кислоты или другими методами.
Регенерация сорбента. Через колонку катионообменного сорбента пропускают 4% раствор кислоты, через колонку анионообменного сорбента -5% раствор натрия карбоната или 2% раствор щелочи до тех пор, пока концентрация отходящей кислоты или щелочи не станет равной исходной. Затем колонку промывают дистиллированной водой до нейтральной реакции.
При анализе одну и ту же колонку сорбента можно использовать для ряда определений без регенерации.
Метод ионообменной хроматографии используется в фармацевтическом анализе для количественного определения солей органических и минеральных кислот, солей алкалоидов и азотистых оснований и других групп лекарственных веществ.
Для количественного определения солей галогенводородных кислот можно использовать как катионит, так и анионит.
ЗАНЯТИЕ №1-2
1. ТЕМА: Анализ качества лекарственных веществ и порошкообразных лекарственных форм в условиях аптеки.
2. ЦЕЛЬ: Овладеть анализом качества порошкообразных лекарственных средств и лекарственных форм в условиях аптеки.
3. ЦЕЛЕВЫЕ ЗАДАЧИ:
3.1. Знать определение понятия «лекарственное вещество», «лекарственная форма», «экспресс-анализ»;
3.2. Изучить все виды внутриаптечного контроля качества. Приказ МЗ Украины №626 от 15.12.2004;
3.3. Знать латинские названия, синонимы, формулы строения, химические названия, физико-химические свойства лекарственных веществ, входящих в состав предложенных лекарственных форм;
3.4. Изучить все возможные реакции идентификации и методы количественного определения ингредиентов, входящих в состав сложных лекарственных форм;
3.5. Давать теоретическое обоснование выбранной методики анализа качества лекарственных форм, основываясь на знании физических и физико-химических свойствах входящих ингредиентов;
3.6. Объяснить условия хранения, применение в медицинской практике, пути введения в организм предложенных экстемпоральных лекарственных форм.
4. ПЛАН И ОРГАНИЗАЦИОННАЯ СТРУКТУРА ЗАНЯТИЯ:
Организационные вопросы – 3 минуты.
Постановка цели занятия и мотивация изучения темы занятия (вступительное слово преподавателя) – 7 минут.
Инструктаж по технике безопасности в химической лаборатории –20 минут.
Контроль и коррекция исходного уровня знаний-умений – 40 минут.
Организация самостоятельной работы студентов (целевые указания преподавателя, техника безопасности) – 5 минут.
Лабораторная работа и оформление протоколов– 150 минут.
Итоговый контроль: проверка результатов лабораторной работы и протоколов – 10 минут.
Заключительное слово преподавателя, указания к следующему занятию–5 минут.
5. ЗАДАНИЕ ДЛЯ САМОПОДГОТОВКИ СТУДЕНТОВ:
Повторить теоретический материал из курса неорганической, органической и аналитической химий по проведению реакций идентификации катионов, анионов, функциональных групп.
Повторить теоретический материал из курса органической и аналитической химии по проведению количественного определения различными методами: ацидиметрии, алкалиметрии, комплексонометрии, осаждения, редоксметрии и др.
Изучить программный материал по данной теме согласно вопросам, приведенным ниже:
Учебные вопросы для самоподготовки студентов:
Единая государственная система контроля качества лекарственных средств.
Определение понятия «лекарственное вещество», «лекарственный препарат» (лекарственная форма), «экспресс-анализ».
Роль четко организованного контроля качества аптечной продукции. Приказ №626 от 15.12.2004 г. Виды внутриаптечного контроля качества.
Дифференциация характера и признаков неудовлетворительно приготовленных лекарственных веществ и лекарственных препаратов (форм) согласно приказа №276 от 27.09.91 г.
Причины недоброкачественности изготовленных лекарственных форм в аптеке и меры их предупреждения и устранения.
Нормы отклонений, допустимые при изготовлении лекарственных форм в аптеках.
Особенности химического экспресс-анализа.
Физико-химические свойства, все возможные методы идентификации и количественного анализа лекарственных веществ, входящих в состав всех предлагаемых порошкообразных лекарственных форм (список прилагается).
Схема установления доброкачественности порошкообразных лекарственных форм, изготовленных в аптеке.
Теоретическое обоснование нескольких вариантов идентификации и количественного анализа всех предложенных лекарственных форм (список прилагается). Выбор оптимального варианта методики анализа лекарственных форм.
Особенности расчетов в количественном экспресс-анализе: расчет навески, граммового и процентного содержания, абсолютной и относительной ошибки.
Применение, условия и сроки хранения лекарственных средств в аптеке.
5.4. Проработать тестовые задания:
#
Какие лекарственные вещества дают положительную реакцию с аммиачным раствором серебра нитрата:
кофеин
глюкоза*
анестезин
кислота нитратная
кислота борная
#
Идентификация глюкозы и кислоты аскорбиновой при совместном присутствии основана на:
различии кислотно-основных свойств
различии их окислительно-восстановительных свойств*
гидролитическом разложении
их различной растворимости в воде
различной растворимости в органических растворителях
#
Качественное определение дибазола в лекарственной форме дибазола 0,03, сахара 0,2 определяют по реакции с:
конц. сульфатной кислотой
раствором нитрата серебра в присутствии спирта и аммиака*
раствором нитрита натрия
раствором перманганата калия
раствором щавелевой кислоты
#
Для проведения идентификации дибазола используют:
раствор йода, разведенную кислоту хлористоводородную*
раствор калия йодата
реактив Марки
раствор натрия гидроксида
раствор железа (III) хлорида
#
Один из нижеприведенных реактивов используют для идентификации кодеина. Укажите его:
раствор танина
реактив Фреде*
реактив Фелинга
реактив Несслера
раствор нитрита натрия
#
Один из нижеприведенных реактивов используют для идентификации папаверина гидрохлорида. Укажите его:
концентрированная сульфатная кислота *
кислота хлористоводородная
кислота фосфатная
раствор аммиака
раствор калия карбоната
#
Провизор-аналитик проводит идентификацию пиридоксина гидрохлорида по реакции с:
раствором железа(III) хлорида*
раствором кальция хлорида
раствором натрия нитрата
раствором калия сульфата
реактивом Фелинга
#
При количественном определении галогенидов по методу Мора реакцию проводят в:
нейтральной или слабощелочной среде*
щелочной среде
присутствии кислоты азотной
присутствии кислоты сульфатной
присутствии кислоты фосфорной
#
Укажите реактивы, которые используют для разрушения кислоты аскорбиновой в лекарственной форме: кислота аскорбиновая, глюкоза, для возможности проведения идентификации глюкозы с реактивом Фелинга:
пергидроль и раствор аммиака*
минеральные кислоты
кислота уксусная
раствор аммиака
раствор калия гидроксида
#
Укажите какой реактив необходимо использовать для идентификации фенобарбитала в лекарственной форме: фенобарбитал 0,01, глюкоза 0,2:
раствор меди сульфата*
раствор магния сульфата
раствор натрия гидроксида
кислота сульфатная
раствор натрия нитрата
#
Укажите какой из приведенных реактивов использует провизор-аналитик при проведении идентификации эфедрина гидрохлорида:
раствор меди сульфата*
раствор натрия нитрита
раствор натрия гидроксида
раствор аммония хлорида
раствор калия йодида
#
На анализ поступила субстанция натрия цитрата. С помощью какого реактива рекомендуется определять катион натрия в анализируемом веществе?
раствора калия перманганата
раствора калия гидроксида
раствора калия нитрата
раствора калия хлорида
раствора калия пироантимоната*
#
Укажите ниже приведенный реактив, который использует провизор-аналитик при идентификации кислоты глутаминовой:
Нингидрин*
бензальдегид
дифениламин
пиридин
анилин
#
Наличие в составе лекарственной форме катиона железа(ІІI) может быть подтверждено провизором-аналитиком аптеки с помощью раствора:
магния сульфата
натрия хлорида
калия бромида
аммония сульфида*
натрия нитрата
#
Идентификацию кислоты борной провизор-аналитик может провести с помощью:
свинцовой бумаги
йодкрахмальной бумаги
куркумовой бумаги*
лакмусовой бумаги
универсальной индикаторной бумаги
#
Провизор-аналитик для идентификации цинка сульфата прибавил раствор сульфида натрия. Укажите какой видимый эффект он наблюдает?
выпадение черного осадка
появление зеленой флюоресценции
выделение пузырьков газа
появление желтой окраски
выпадение белого осадка*
#
В аптеку поступила субстанция тиамина хлорида. Одной из используемых реакций идентификации есть реакция образования:
азокрасителя
талейохина
тиохрома*
мурексида
индофенола
#
Провизор-аналитик аптеки проводит количественный анализ порошка, который содержит кислоту глютаминовую и кислоту аскорбиновую. Укажите какой метод он должен использовать для количественного определения кислоты аскорбиновой в присутствии кислоты глютаминовой.
нитритометрию
комплексонометрию
алкалиметрию
йодометрию *
ацидиметрию
#
Укажите в какой цвет окрашивает пламя газовой горелки катион натрия:
кирпичный
фиолетовый
красный
желтый*
зеленый
#
Укажите в какой цвет окрашивает пламя газовой горелки катион калия:
кирпичный
желтый
фиолетовый *
красный
зеленый
#
Бромид-ион в лекарственных средствах “Natrii bromidum” и “Kalii bromidum” идентифицируют со следующим реактивом:
раствором свинца нитрата
раствором натрия нитрата
раствором натрия нитрита
раствором серебра нитрата*
раствором кальция нитрата
#
Укажите какой реактив может использовать провизор-аналитик для подтверждения наличия пиридинового цикла в составе лекарственных препаратов:
1,3-динитробензол
2,4-динитрофенилгидразин
2,4-динитрохлорбензол*
нингидрин
натрия гидроксид
#
Укажите, какой реактив использует провизор-аналитик для идентификации витамина С:
кислоту нитратную
раствор Драгендорфа
раствор натрия сульфата
раствор железа(II) сульфат в присутствии натрия гидрокарбоната*
раствор натрия гидроксида
#
С целью идентификации кислоты ацетилсалициловой проводят ее гидролиз. Какой из приведенных ниже реактивов используется для идентификации продуктов ее гидролиза?
реактив Несслера
раствор железа(ІІІ) хлорида*
раствор натрия нитрата
раствор аммония молибдата
раствор аммония сульфата
#
В основу анализа качества лекарственных веществ натрия бромида и калия бромида положена реакция идентификации, видимым эффектом которой является образование желтого осадка трудно растворимого в растворе аммиака. Укажите продукт реакции и какой реактив используется для идентификации:
1. раствор кислоты азотной
|
А. натрий калий пироантимонат
|
2. раствор серебра нитрата
|
Б. серебра карбонат
|
3. раствор аммиака хлористого
|
В. калия гидроокись
|
4. раствор калия карбоната
|
Г. серебра бромид
|
5. раствор натрия сульфата
|
Д. молекулярный бром
|
#
Укажите какой реактив используется в качественном анализе для идентификации салицилат-аниона:
раствор натрия гидроксида
раствор железа(ІІІ) хлорида*
раствор магния сульфата
раствор натрия нитрита
раствор калия сульфата
#
Укажите какой реактив используется в качественном анализе для идентификации бензоат-аниона:
раствор аммония оксалата
реактив Несслера
раствор железа(III) хлорида*
раствор калия бихромата
раствор калия перманганата
#
Идентифицировать ион цинка в субстанции цинка сульфата можно реакцией с раствором калия ферроцианида по образованию:
желтого осадка
коричневого осадка
зеленого осадка
белого осадка*
розового осадка
#
Аналитик проводит контроль качества кислоты никотиновой. С помощью какого реактива можно подтвердить наличие пиридинового цикла в структуре кислоты никотиновой?
раствора натрия нитропруссида
раствора калия ферроцианида
раствора цианобромида*
раствора нингидрина
раствора бензальдегида
#
На анализ поступила субстанция глюкозы. При нагревании ее с медно-тартратным раствором образовался красный осадок, что свидетельствует о наличии в ее структуре:
альдегидной группы *
фенольного гидроксила
амидной группы
сложноэфирной группы
спиртового гидроксила
#
Количественное содержание димедрола в дозированных порошкобразных формах провизор-аналитик определяет методом:
кислотно-основного титрования
нитритометрии
броматометрии
кислотно-основного титрования в неводных растворителях*
поляриметрии
#
Провизор-аналитик определил количественное содержание кислоты аскорбиновой йодатометрическим методом. Титрование он должен выполнить в присутствии:
раствор калия йодида*
раствор аммония нитрата
раствор кальция сульфата
раствор магния хлорида
раствор натрия бромида
#
В аптеке изготовлены порошки дибазола с сахаром. Какой вид контроля осуществил аналитик, взвесив по отдельности 3% от общего количества порошков?
Физический*
органолептический
письменный
химический
опросный
#
Укажите наличие какой функциональной группы в молекуле пиридоксина гидрохлорида обеспечивает положительный результат реакции идентификации с раствором железа(III) хлорида:
спиртового гидроксила
фенольного гидроксила*
пиридинового цикла
метильной группы
оксиметильной группы
#
Для идентификации субстанции лекарственного вещества, содержащего карбонат-ион, согласно требованиям ГФ Украины, провизор-аналитик должен использовать следующий реактив:
кислоту уксусную разведенную и бария гідроксид*
реактив Несслера
раствор калия йодида
раствор натрия гидроксида
раствор натрия хлорида
#
Укажите, какой из реактивов используется для подтверждения наличия натрий-иона в лекарственном веществе:
калия пироантимонат (калия стибиат)*
кобальта хлорид
меди сульфат
серебра нитрат
калия перманганат
#
Провизор-аналитик при проведении анализа внес в бесцветное пламя горелки неорганическую соль натрия на платиновой петле. Что при этом наблюдается?
пламя окрашивается в желтый цвет *
пламя окрашивается в зеленый цвет
пламя окрашивается в кармино-красный цвет
пламя окрашивается в синий цвет
пламя окрашивается в фиолетовый цвет
#
При определении доброкачественности воды очищенной по реакции с нитратом серебра в азотнокислой среде наблюдалось выпадение белого творожистого осадка, какую примесь определял провизор-аналитик?
хлорид – ионов*
сульфат - ионов
оксалат - ионов
тартрат - ионов
фосфат - ионов
#
Для определения примеси сульфат-иона в водe очищенной провизор-аналитик использует следующие реактивы:
раствор бария хлорида и кислоту хлористоводородную*
раствор аммония хлорида и аммиак
раствор серебра нитрата и кислоту азотную
раствор бензолсульфокислоты
раствор дифениламина
#
Вода очищенная с раствором бария хлорида образовала белый осадок нерастворимый ни в кислотах, ни в щелочах. Какую примесь определял провизор - аналитик?
Сульфат*
сульфит
карбонат
оксалат
фосфат
#
Одним из показателей чистоты в воде очищенной является отсутствие примеси аммиака. Для определения этого показателя в качестве реактива следует использовать:
раствор калия тетрайодмеркурата щелочного (реактив Несслера)*
раствор бария хлорида
раствор циркония нитрата
раствор аммония оксалата
раствор лития карбоната
#
Выделение пузырьков газа наблюдается при добавлении кислоты хлористоводородной к:
натрию тетраборату
натрию гідрокарбонату*
раствору аммиака
кислоте борной
кальцию хлориду
#
Укажите, какой из реактивов используется для подтверждения наличия натрий-иона в натрия гидрокарбонате:
калия пироантимонат (калия гексагидроксистибиат)*
кобальта хлорид
меди сульфат
серебра нитрат
калия перманганат
|
|
|
 Скачать 3.59 Mb.
Скачать 3.59 Mb.