Учебнометодическое пособие к лабораторным работам Красноярск 2018 Составители Иртюго Л. А. Дидух С. Л
 Скачать 0.73 Mb. Скачать 0.73 Mb.
|
|
Экспериментальная часть Реактивы, приборы, посуда: - раствор гексацианоферрата(III) калия (К3[Fe(CN)6]) 0,02 М в буфере, - карбонатный буферный раствор, - раствор тиомочевины 0,02 М в буфере, - раствор тиоацетамида 0,02 М в буфере, - колбы объемом 50 мл (7 шт), 100 мл, 200 мл, 250 мл, - термостат, - спектрофотометр «SPEKOL 1300», - секундомер. Последовательность выполнения работы. Подготавливают спектрофотометр к измерениям, как указано в приложении 2. В мерных колбах (объемом 50 мл) готовят серию стандартных растворов К3[Fe(CN)6] (1·10-4, 2·10-4, 2,5·10-4, 3·10-4, 4·10-4, 5·10-4, 6·10-4 моль/л) разбавлением 0,02 М раствора К3[Fe(CN)6] карбонатным буферным раствором. Проводят измерения оптической плотности стандартов, используя в качестве раствора сравнения карбонатный буфер. Результаты измерений оформляют в виде таблицы 2.1. Строят калибровочный график. Таблица 2.1
Эксперименты проводят при двух температурах, заданных преподавателем (не ниже 35 0С). В термостат с заданной температурой помещают мерную колбу (объемом 250 мл) с 5 – 20 мл 0,02 М раствора К3[Fe(CN)6] в буферной смеси; колбу с 50 – 200 мл 0,02 М раствора тиомочевины (или 5-20 мл 0,02 М раствора тиоацетамида, в зависимости от задания) в буферной смеси; колбу с карбонатным буферным раствором. Объемы растворов реагентов рассчитываются, исходя из того, что концентрация тиомочевины в реакционной смеси должна быть в 10 раз больше концентрации гексацианоферрата (III) калия (в случае тиоацетамида концентрации реагентов могут быть близкими по значению). Высокая концентрация окислителя может привести к образованию элементной серы и, как следствие, к помутнению раствора. Нижний предел концентрации К3[Fe(CN)6] определяется чувствительностью спектрофотометра. При содержании [Fe(CN)6]3- выше 6·10-3 моль/л раствор перед определением разбавляют. После выравнивания температур раствор тиомочевины (тиоацетамида) приливают в колбу с раствором гексацианоферрата (III) калия. Отмечают время сливания и считают его временем начала реакции. Объем раствора доводят до метки термостатированным буфером. Колбу с реакционной смесью помещают в термостат. По ходу реакции из реакционной смеси отбирают пробы, которые быстро охлаждают водой со льдом и колориметрируют. Концентрацию гексацианоферрата определяют по значениям оптической плотности при помощи калибровочного графика (приложение 2, пункт 5). Первые две пробы отбирают с интервалом 3 и 5 мин. от начала реакции, затем – в зависимости от характера изменения оптической плотности раствора. Объем проб зависит от размера выбранной кюветы. Полученные результаты заносят в таблицу 2.2. Таблица 2.2
Поскольку концентрация гидроксид-ионов в ходе реакции практически не изменяется, а количество тиомочевины на порядок больше количества К3[Fe(CN)6], содержание тиомочевины можно считать постоянным и константу скорости рассчитать по уравнению для реакций первого порядка: 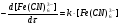 . .Вычисляют kдля каждого момента, рассчитывают среднее значение kср. и сравнивают со значением, полученным графически. Для этого строят график в координатах 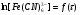 и определяют k, как тангенс угла наклона прямой к оси τ. и определяют k, как тангенс угла наклона прямой к оси τ.По значениям констант скоростей при двух температурах рассчитывают энергию активации реакции. Контрольные вопросы 1. Какие реакции называют сложными? Классификация сложных реакций. К какому типу относятся изучаемые в работе реакции? 2. Чем обусловлена разница кинетических уравнений для реакций окисления тиомочевины и тиоацетамида? 3. В чем заключается принципиальное отличие простых и сложных реакций? 4. Чем вызвана необходимость использования буферного раствора при изучении кинетики рассматриваемых в работе реакций? 5. На чем основан метод колориметрического изучения кинетики окисления тиомочевины (тиоацетамида) К3[Fe(CN)6]? 6. Какое допущение делает метод стационарных концентраций? В каких случаях данный метод может быть применен? 7. На каком основании при расчете кинетических характеристик реакции окисления тиомочевины используют уравнение для реакции первого порядка? Правомерно ли это? Работа №3 Изучение кинетики окисления металлов и сплавов Теоретическое введение Примером газовой коррозии металлов может служить окисление последних при высоких температурах. При комнатной температуре окисление металлов чаще всего ограничивается потускнением или образованием тонких пленок. Вследствие малой диффузии кислорода к поверхности металла при таких температурах толщина этих пленок практически не увеличивается. Особое положение в условиях химических производств имеет газовая коррозия при высоких температурах. Такая коррозия является равномерной, так как распространяется вглубь металла почти одинаково по всей поверхности, а образующиеся пленки из продуктов коррозии имеют одинаковую толщину по всей площади, подвергающейся коррозии. Скорость газовой коррозии оценивается по привесу с квадратного метра поверхности в единицу времени или по глубине коррозии. При повышении температуры скорость коррозии взрастает, так как увеличивается скорость диффузии и химических процессов. Вследствие этого пленки продуктов коррозии утолщаются. Увеличение толщины пленки на разных металлах протекает по различным законам: прямолинейному, параболическому и логарифмическому. Данное обстоятельство обусловливается главным образом природой образующихся оксидов, а также целостностью покрытия. У металлов, на которых при окислении не образуется защитная пленка, скорость роста остается постоянной. Толщину ее рассчитывают на основании формулы 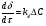 , ,т. е. 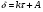 , , где δ - толщина слоя продукта коррозии, kδ- коэффициент скорости процесса, ΔC - движущая сила коррозии, А – постоянная интегрирования. Константа интегрирования определяет толщину пленки в начальный момент окисления, т. е. τ = 0. Если окисление начинается на чистой поверхности, то А = 0. Ряд металлов, применяемых в химической технологии, окисляется по параболическому закону, например, металлы, на которых в результате химической коррозии получаются сплошные пленки. В этом случае процесс тормозится диффузией агентов через пленку, и по мере ее роста коррозия замедляется. Представим сплошную пленку толщиной δ, находящуюся на поверхности окисляющегося металла (рис. 3.1). Для этого случая имеем соотношение  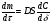 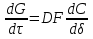 , ,где m – количество диффундирующего вещества, τ – время, D – коэффициент диффузии, 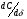 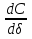 – градиент концентрации, S– площадь окисления. – градиент концентрации, S– площадь окисления.Если принять, что в процессе окисления устанавливается стационарный режим диффузии, т. е. не происходит накопления диффундирующего вещества в каком–либо сечении пленки, то производная 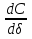 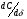 заменяется соотношением заменяется соотношением 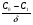 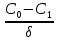 . Здесь С0 – концентрация кислорода на внешней поверхности пленки на границе с воздухом, С1 – концентрация кислорода на внутренней поверхности пленки на границе с металлом. Тогда скорость диффузии . Здесь С0 – концентрация кислорода на внешней поверхности пленки на границе с воздухом, С1 – концентрация кислорода на внутренней поверхности пленки на границе с металлом. Тогда скорость диффузии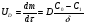 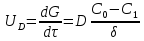 для единичной поверхности пропорциональна разности концентраций кислорода и обратно пропорциональна толщине слоя. Примем, что на корродируемом металле уже имеется защитная пленка, а процесс идет в диффузионной области, и весь кислород, диффундируя через пленку, не накапливается, т. е. немедленно вступает в реакцию. Для такого случая скорость роста пленки (Uкор) может быть равна скорости диффузии кислорода (UD): 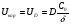 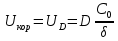 . . При постоянных условиях окисления (парциальное давление кислорода и температура процесса неизменны, например, при воздействии воздуха, нагретого до определенной температуры) 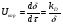 или после интегрирования 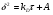 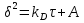 . .В некоторых случаях, например, при наличии в растущей пленке трещин (из-за нагревания или охлаждения), а также при сравнительно невысоких температурах коррозия металлов протекает по логарифмическому закону 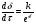 или 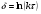 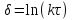 . .При увеличении температуры скорость окисления возрастает. Это происходит потому, что с ростом температуры увеличивается скорость диффузии кислорода и, как следствие, константа скорости окисления в соответствии с уравнением Аррениуса   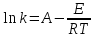 . .Перенос вещества через слой продукта реакции окисления – окалину осуществляется путем независимого движения заряженных частиц: ионов (катионов M+n X-m) и электронов е-. Согласно схеме, изображенной на рис. 3.2, катионы и электроны движутся в одном направлении – от границы окалины с металлом к границе с неметаллом, анионы – в противоположном. Процесс переноса через слой окалины является лимитирующей стадией процесса окисления: переход ионов или электронов через поверхность раздела фаз протекает без затруднений, поэтому на межфазных границах существует термодинамическое равновесие. Экспериментальная часть Реактивы, приборы, посуда: - металлы, заданные преподавателем, - установка для изучения окисления металлов. Последовательность выполнения работы. Исследование кинетики газовой коррозии проводится по методике периодического взвешивания на лабораторной установке, схема которой приведена на рис. 3.3. Испытуемый образец 2 подвешивают на нихромовом или кварцевом подвесе 5, состоящем из нескольких звеньев, в вертикальной трубчатой печи сопротивления 3, к коромыслу аналитических весов 6. Температуру в печи замеряют хромель- алюмелевой термопарой 1 и записывают на потенциометре КСП – 4 – 7. Конец термопары должен находиться вблизи испытуемого образца. Чтобы избежать нагрева весов, между печью и весами устанавливается экран 4. 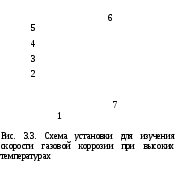 Работа по исследованию скорости окисления металла проводится следующим образом: включают обогрев печи и потенциометр КСП – 4. Работа по исследованию скорости окисления металла проводится следующим образом: включают обогрев печи и потенциометр КСП – 4.По достижению заданной температуры (регулируют при помощи ЛАТРа) подвешивают в печи испытуемый образец 2 и через 1 – 2 мин его взвешивают. За это время образец принимает температуру печи, но еще не успевает заметно окислиться. Далее в течение 1 – 2 ч через заданные преподавателем промежутки времени продолжают взвешивание образца. По окончании опыта при данной температуре образец вынимают, устанавливают в печи следующую заданную температуру, подвешивают в печи новый образец такого же металла и повторяют опыт в том же порядке. Результаты опытов по исследованию кинетики газовой коррозии сводят в таблицу по образцу табл.3.1. По табличным данным для каждой температуры строят графики в координатах Δms – f(τ), Δms2 – f(τ) и Δms 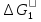 – f(ln τ), устанавливая таким образом, по какому закону идет окисление в определенной температурной области. – f(ln τ), устанавливая таким образом, по какому закону идет окисление в определенной температурной области.Таблица 3.1
Установив характер кривой, и какому уравнению она подчиняется, рассчитывают константы скорости окисления для каждой температуры, а затем определяют энергию активации и получают расчетное уравнение процесса окисления в зависимости от температуры. Для определения константы скорости окисления расчет проводится по формулам: - при прямолинейном характере кривых окисления 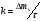 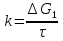 ; ;- при параболическом характере кривых 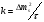 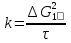 ; ;-при логарифмическом законе окисления 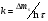 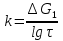 . .Контрольные вопросы 1. Какой можно ожидать закон окисления, если соотношение объемов оксида и металла Vок/Vм < 1? 2. Каким законом описывается процесс окисления, если он лимитируется диффузией в газовой фазе? 3. Напишите уравнения для 1 и 2 законов диффузии Фика. 4. Расскажите о механизмах окисления различных металлов. 5. Каков физический смысл коэффициента диффузии? 6. Какова температурная зависимость коэффициента диффузии? 7. Приведите условия стационарного и нестационарного состояний диффузионного потока. Работа №4 Изучение кинетики фотохимического разложения перекиси водорода Теоретическое введение Реакции, протекающие под действием светового излучения (видимого и ультрафиолетового), которое вызывает активацию частиц одного из реагирующих веществ, называются фотохимическими. Закон фотохимической эквивалентности был установлен А. Эйнштейном, согласно ему каждая молекула, реагирующая под влиянием света, поглощает только один квант излучения, вызывающий реакцию. Поэтому система, в которой прореагировало N молекул, должна поглотить энергию Е в соответствии с уравнением 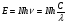 где ν – частота излучения; С – скорость света; λ – длина его волны. Обычно число прореагировавших молекул не равняется числу поглощенных квантов. Отношение числа фактически прореагировавших молекул к числу поглощенных квантов называется квантовым выходом. Эта величина бывает меньше, больше и равна единице. Важной особенностью фотохимических реакций является независимость их скорости от температуры. Первичная фотохимическая реакция обычно является лимитирующей, а энергия кванта, поглощенного в ней, много выше энергии теплового движения и изменения ее с температурой. Цепные реакции были открыты при изучении фотохимических процессов. Цепные реакции отличаются от обычных тем, что при их протекании элементарные акты не независимы друг от друга, а каждый предшествующий акт вызывает один или несколько других актов, то есть превращение исходных веществ в продукты реакции осуществляется путем регулярного чередования нескольких элементарных реакций. Это связано с тем, что частицы, которые возникают в результате реакции, обладают повышенной химической активностью. Цепные реакции являются основой многих процессов, имеющих большое практическое значение: - горение, - крекинг нефти, - производство пластических масс-полимеров, - атомная энергетика. В любой цепной реакции процесс развивается вследствие образования неустойчивых промежуточных продуктов – атомов или радикалов, которые также называются активными центрами. Эти промежуточные вещества являются валентно ненасыщенными. Вследствие неустойчивости атомов и радикалов время их жизни очень мало. Возникающие при появлении атомов или радикалов цепи либо неограниченно развиваются, что приводит к взрыву, либо обрываются вследствие гибели активных центров в результате адсорбции на стенках сосуда или тройных соударений в объеме смеси. Таким образом, для цепных реакций характерны три следующие стадии: 1. зарождение цепи (первичная реакция); 2. развитие цепи; 3. обрыв цепи. Зарождение цепи не обязательно происходит под влиянием света. Цепные реакции могут возникать под воздействием излучений радиоактивных веществ. В некоторых случаях начало цепных реакций обусловлено добавлением к реакционной смеси веществ, атомы которых поглощают свет определенной длины волны и становятся активными. Возникновение цепей может происходить и вследствие самого акта химической реакции при которой образуются радикалы. Кроме того, образование атомов или радикалов может быть обязано высокой температуре реакционной смеси или наличию катализаторов. Во второй стадии цепных реакций – развитие цепей – можно различать реакции с простыми и с разветвляющимися цепями. В первом случае каждый исчезающий атом или радикал вызывает появление лишь одного нового атома или радикала. Примером такой неразветвленной цепи может служить реакция между Н2 и С12: Cl2+hν=2Cl·, Сl· + Н2 = НС1 + Н·, Н· + С12=НС1 + С1 и т. д. В реакциях с разветвляющимися цепями на каждый исчезающий центр реакции возникает несколько новых. К числу таких реакций, в частности, принадлежит процесс расщепления водорода. При низких давлениях и при температуре около 500 0С он может развиваться согласно следующей схеме: Н + О2 = ОН + О; OH + Н2 = Н2О + Н; О + Н2 = ОН + Н и т. д. Существование свободных атомов и радикалов было доказано различными методами. Для этого в реакционную смесь вводят специальные зонды, снабженные чувствительными малоинерционными термопарами и покрытые катализаторами. На поверхности таких катализаторов происходят процессы рекомбинации атомов и радикалов, сопровождающиеся значительным выделением тепла. Например, катализатор ZnO-Cr2О3 ускоряет реакцию рекомбинации атомов водорода. По повышению температуры зонда можно определить концентрацию свободных частиц. Итак, отличительными чертами цепных реакций являются следующее: 1. большой квантовый выход при фотохимическом возбуждении; 2. высокая чувствительность к присутствию примесей; 3. зависимость скорости от формы и размера сосудов, в которых протекают реакции; 4. наличие верхнего и нижнего пределов воспламенения. Цепные реакции могут протекать с очень малыми и с большими скоростями. Для неразветвленных цепных реакций, когда каждая активная частица дает начало одной цепи, скорость зависит от длины цепи v и числа активных частиц n0, зарождающихся в единице объема в единицу времени: 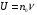 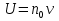 . .Подобная реакция после периода индукции протекает спокойно. По мере уменьшения исходной концентрации скорость ее постепенно падает, так как согласно закону действующих масс уменьшение концентрации снижает число столкновений, а следовательно, величины n0 и v. Однако во многих случаях каждая активная молекула – радикал порождает не один, а два и более новых радикала, так, что цепь разветвляется. Если такое разветвление цепей идет быстро, то реакция, в отличие от простой цепной, течет не стационарно, а самоускоряясь, достигая при высоких исходных концентрациях стадии самовоспламенения или взрыва. Изменение во времени скорости разветвленного цепного процесса описывается уравнением 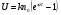 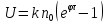 . .Отсюда при не слишком малых значениях времени 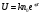 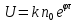 , (4.1) , (4.1)где 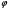 - константа нарастания, характеризующая скорость разветвления; k - постоянная. - константа нарастания, характеризующая скорость разветвления; k - постоянная.В зависимости от значения n0 начальная скорость реакции может быть большей или меньшей. При достаточно малом n0 скорость близка к нулю, и реакция практически не регистрируется в течение длительного периода индукции 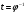 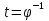 , (4.2) , (4.2)доходящего до десятков минут. Затем скорость реакции быстро возрастает и, достигнув минимума, начинает падать вследствие расхода компонентов реакции. Примером фотохимической реакции может быть разложение перекиси водорода, изучаемое в данной работе. Фотохимическое разложение H2O2 - это типично разветвленная цепная реакция протекает с участием различных активных радикалов. Реакция начинается с фотохимического разложения Н2О2 на радикалы ОН  под действием ультрафиолетового излучения и протекает по следующему механизму: под действием ультрафиолетового излучения и протекает по следующему механизму: 1. Н2О2 + h 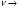 2OH 2OH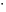 реакция возникновения активных радикалов; реакция возникновения активных радикалов;2. ОН 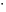  + Н2О2 + Н2О2  НО2 НО2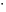 + Н2О реакции развития цепи + Н2О реакции развития цепи 3. НО2 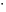 + (Н2О2)2 + (Н2О2)2  Н2О4 Н2О4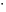 + ОН + ОН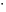 +Н2О (регенерация активных +Н2О (регенерация активных 4. Н2О4 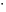 + h + h 2ОН 2ОН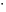 + О2 радикалов); + О2 радикалов);5.Н2О4 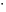 + S + S 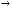 2НО2 2НО2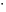 + S + S6. Н2О4 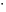 + S + S  Н2О2 + О2 + S реакции гибели активных Н2О2 + О2 + S реакции гибели активных7. ОН  + НО2 + НО2  Н2О + О2 радикалов. Н2О + О2 радикалов.8. НО2 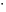 + НО2 + НО2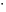  Н2О2 + О2 Н2О2 + О2Реакция (8) выделения кислорода относится к цепным реакциям с «вырожденными разветвлениями» (Цепными реакциями с «вырожденными разветвлениями» называются такие, в которых в результате распада продуктов реакции образуются свободные радикалы. В данной реакции промежуточный продукт НО2 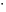 даст при взаимодействии с H2О2 радикал ОН даст при взаимодействии с H2О2 радикал ОН и молекулу тетраоксида водорода, приводящую далее кразветвлению цепи). В данном процессе разветвление осуществляется фотохимически за счет подвода энергии извне. Относительно устойчивым промежуточным продуктом является свободный радикал OH.. и молекулу тетраоксида водорода, приводящую далее кразветвлению цепи). В данном процессе разветвление осуществляется фотохимически за счет подвода энергии извне. Относительно устойчивым промежуточным продуктом является свободный радикал OH.. | |||||||||||||||||||||||||||||||||||||||||||||
